常规培养与缺氧条件下BCG菌体内外sRNA的表达检测
韩 雪, 顾 伟, 李 婷, 范云帆, 张文莉, 赵吉子, 付英梅
(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150081)
细菌中长度在50~500 nt的非编码RNA通常被定义为小RNA(small RNA,sRNA)[1]。细菌的sRNA的表达水平受环境因素诱导而改变,继而通过对靶基因的调节,帮助细菌适应环境因素的变化[2-3]。细菌的sRNA也可通过细胞外囊泡等方式被分泌到菌体外,在宿主体内以细胞间信号的跨物种传递方式,发挥基因表达调控的功能,参与感染与免疫进程。例如,细菌胞外sRNA可激活宿主细胞的模式识别受体途径,诱导保护性免疫反应[4-5];或模拟宿主的miRNA调节靶基因的表达,影响细胞因子和干扰素水平、诱导免疫细胞凋亡[6-7]。高通量测序技术发现,细菌的sRNA也可分布到宿主的各种体液和组织器官中[8-9]。因此,细菌的胞外sRNA,可作为感染性疾病的诊断标志物或治疗监测标志物,也可将其作为新型核酸疫苗加以研制。在NCBI数据库的结核分枝杆菌参考基因组中,注释了20种sRNA,研究发现这些sRNA的调控作用包括影响细菌的生长与转录,蛋白质的分泌,在感染时发挥一定的作用[2,10-11]。但对结核分枝杆菌菌体内外sRNA谱的情况还不清楚。为了研究结核分枝杆菌菌体内外sRNA的表达情况,本研究以BCG菌株为研究对象,测定细菌不同生长时期菌体内外的sRNA谱,并以缺氧为诱导条件,研究BCG菌体外sRNA的变化规律,为筛选有利于结核病诊断的sRNA候选标志物提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 菌株MycobacteriumbovisBacillus Calmette-Guerin Vaccine(BCG,卡介苗) Danish,由哈尔滨市南岗区结核病防治所惠赠。
1.1.2 培养基 BCG培养采用含白蛋白-葡萄糖-过氧化物酶(ADC)的Middlebrook 7H9培养基[12],购自美国BD公司。
1.1.3 试剂与仪器 RNA提取使用TRIzol试剂(美国Thermo Fisher Scientific公司);cDNA合成试剂盒和RT-qPCR检测试剂盒(加拿大abm公司);NanoDrop 2000(美国Thermo Fisher Scientific公司);荧光定量PCR仪(德国Roche公司)。
1.2 方法
1.2.1 转录组测序分析 离心收集在Middlebrook 7H9中培养至对数生长期的BCG菌体和上清液,上清液经0.22 μm滤膜过滤后,140 000 g离心获得BCG外泌体样本。分别使用Trizol和Trizol LS试剂提取BCG菌体和外泌体的总RNA,使用2 μg总RNA,去除rRNA后构建cDNA文库,末端修复加A并连接测序接头,经片段筛选、PCR富集、文库质检与定量后,经Illumina高通量测序平台测序。测序得到的原始序列经TrimGalore过滤得到Clean reads,使用H37Rv参考基因组(NC_000962.3)进行sRNA表达水平的分析。
1.2.2 BCG培养 采用含10% ADC的Middlebrook 7H9培养基,37 ℃,170 r/min进行常规培养。ADC配制方法:高压灭菌后的蒸馏水100 mL,加入BSA胎牛血清白蛋白粉末5 g,葡萄糖2 g,氯化钠0.85 g,过氧化物酶0.003 g充分溶解,0.22 μm 滤膜过滤除菌。根据Wayne描述的方法[13],将培养至对数期的BCG用新配制的7H9培养基以1∶30的比例稀释后充满培养管,旋紧盖子并用封口膜密封管口,将培养管置于无氧密封袋中,37 ℃,170 r/min进行缺氧培养。分别取常规培养和缺氧培养至0、4、8、10 d的菌体和上清液进行检测。
1.2.3 RNA提取 将1 mL对数期菌液离心,将上清液移入新的离心管中,5 000 r/min离心10 min,用0.22 μm滤膜过滤后,制备好BCG无菌培养上清液。向剩余菌体中加入500 μL溶菌酶(20 mg/mL),以超声5 s、停顿 3 s、超声30个循环的程序超声裂解两次。使用TRIzol法提取总RNA,NanoDrop 2000测定RNA的浓度和纯度。
1.2.4 cDNA的合成 使用1 μg的RNA合成cDNA,采用5x All-In-One RT MasterMix(with AccuRT Genomic DNA Removal Kit)试剂盒,按试剂盒的操作说明应用随机引物合成cDNA。
1.2.5 RT-qPCR检测 使用EvaGreen 2×qPCR MasterMix荧光染料试剂盒进行RT-qPCR检测,引物详见表1。采用sigA为内参基因,以2-Δct法表示sRNA的相对表达量。

表1 RT-qPCR引物
1.2.6 sRNA启动子区域DosR结合基序的分析 DosR结合位点是其调控基因上游启动子区域一段保守的18 bp的简并回文序列[14]。使用Clustal 1.2.4在线分析软件搜索sRNA上游启动子区域中符合这一特征的序列,并分析序列的回文特征,筛选sRNA启动子区域中可能存在的DosR结合基序。
1.2.7 统计学分析 采用Graphpad 5.0软件进行统计分析,使用t检验方法分析BCG菌体和上清中sRNA的表达量,当P<0.05时认为数据具有统计学意义。
2 结果与分析
2.1 实验中所用sRNA的筛选
将BCG菌体和BCG外泌体样本全转录组测序所得的raw reads过滤后,在BCG菌体中得到18 725 670 Clean reads,在BCG外泌体中得到70 853 63 Clean reads。根据结核分枝杆菌的参考基因组(NC_000962.3)中所注释的sRNA,分析各个sRNA在菌体和外泌体中的丰度情况,结果见图1。为了进一步确认BCG菌体内外的sRNA谱,选择在BCG外泌体测序中检测到的5种sRNA,即 MTS2823、G2、Mcr7、AS1890和ASdes(图1B),同时选择BCG菌体中丰度较高的两种sRNA(Mcr3和C8),及丰度较低的两种sRNA(MTS1338和MTS0997)(图1A),共9种结核分枝杆菌的sRNA进行下一步实验。
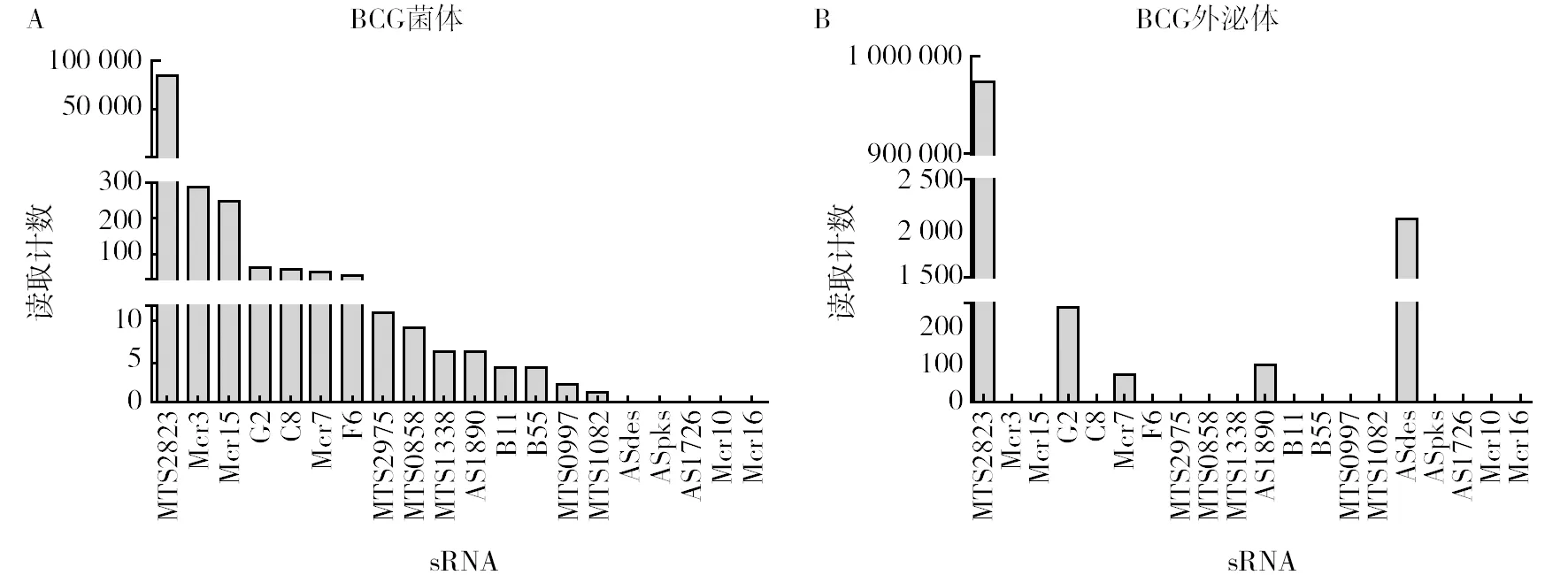
图1 RNA测序显示的20种sRNA在BCG及其外泌体中的丰度Fig.1 The abundance of sRNA in BCG and BCG extracellular vesicles revealed by RNA sequencing
2.2 随时间变化的常规培养下sRNA表达谱
通过RT-qPCR法检测不同培养时期的BCG菌体内外sRNA的相对表达量,整个培养过程中,所选择的9种sRNA在BCG菌体内和菌体外都可检测到,但菌体内外的sRNA表达谱存在明显差异(图2)。对数期之前(0~20 d),MTS2823为BCG菌体内丰度最高的sRNA,其次为MTS1338;从第20天对数期开始,ASdes的丰度逐渐升高,同时MTS2823与MTS1338仍保持较高含量;其他6种sRNA在菌体内一直呈较低的相对表达量。在BCG菌体外,对数期之前丰度最高的sRNA为Mcr3,其次为MTS2823;自第20天对数期开始,AS1890的丰度有所增加,而Mcr3在培养至30 d后,丰度几乎下降为0(图2)。
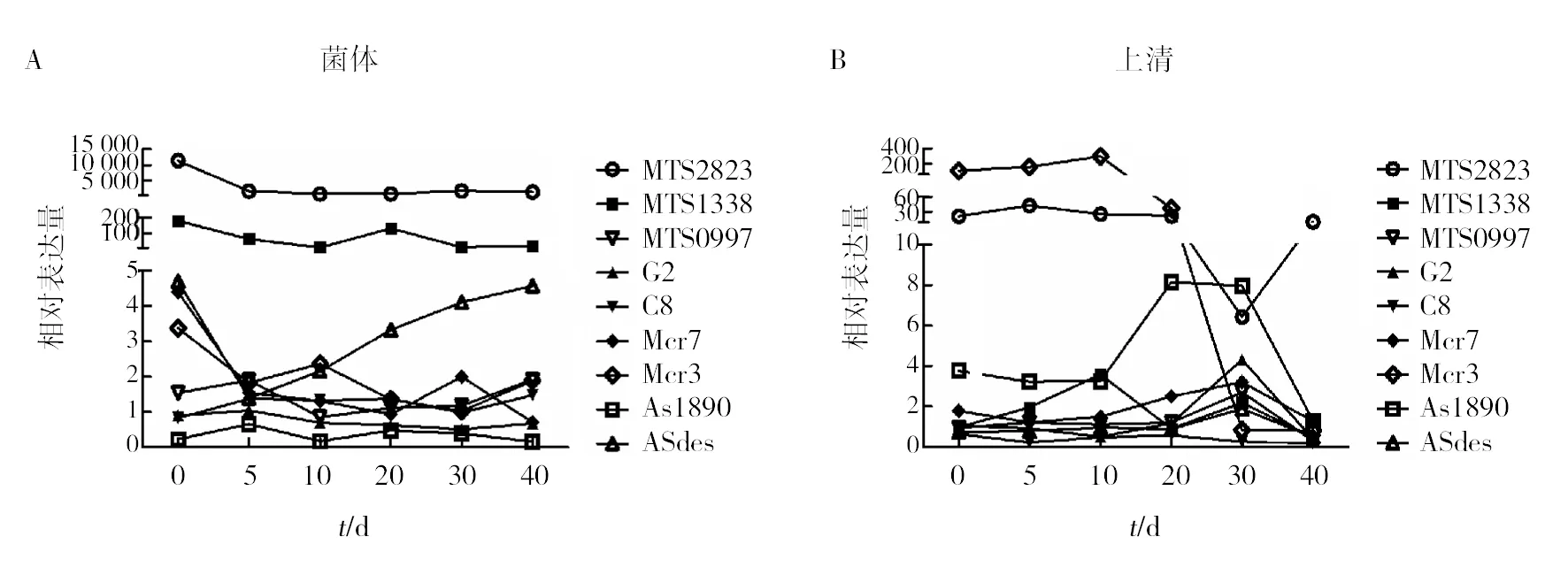
图2 常规培养时sRNA 的表达谱Fig.2 The sRNA expression profile of in routine culture
2.3 常规培养时BCG菌体内外sRNA表达量的比较
对数生长早期,细菌生长旺盛,因此无菌培养上清中的sRNA多由菌体释放或分泌,而非细菌死亡裂解所产生。测定对数生长早期(20 d)BCG菌体内外sRNA的相对表达量,将sRNA菌体外与sRNA菌体内做比值,以比较某一sRNA在菌体内外的差异。结果发现,常规培养时,MTS0997、G2、Mcr7、Mcr3和AS1890的比值大于1,说明这些sRNA在BCG菌体外的相对表达量高于菌体内(图3)。提示这些sRNA可能由细菌主动分泌至菌体外。
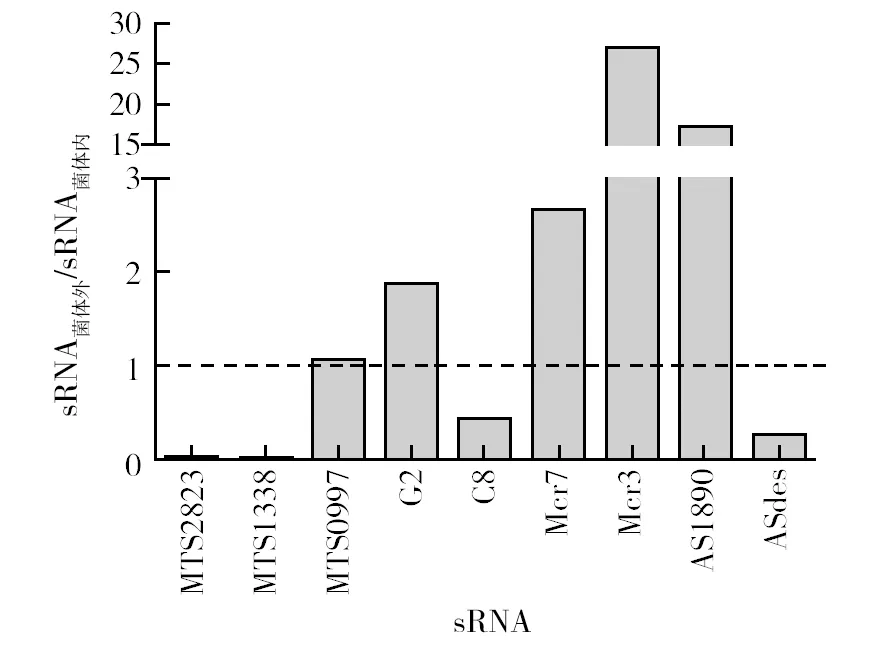
图3 常规培养时BCG菌体外与菌体内sRNA相对表达量的比值Fig.3 The ratio of extracellular to intracellular sRNA expression in conventional culture of BCG
2.4 缺氧应激对菌体内外sRNA表达的影响
已有研究发现,缺氧环境诱导结核分枝杆菌DosR基因表达上调。本研究中BCG在缺氧培养至4 d时,DosR的相对表达量由0.187升高到0.967,升高了5倍(P<0.001),表明此时缺氧环境已经形成。此时,在BCG菌体中受缺氧诱导,表达量比常规培养时增多的sRNA有4种,即MTS2823、MTS1338、MTS0997和G2(图4A);而在BCG的无菌培养上清中,仅MTS0997表达量多于常规培养,增高了2.3倍(P<0.05)(图4B)。至缺氧8 d时,菌体内表达量高于常规培养时的sRNA,且只剩下G2 一种(图4C);但菌体外表达较常规培养时增高的sRNA种类增多,除MTS0997外,G2、C8、MTS1338和MTS2823的含量也增加(图4D)。
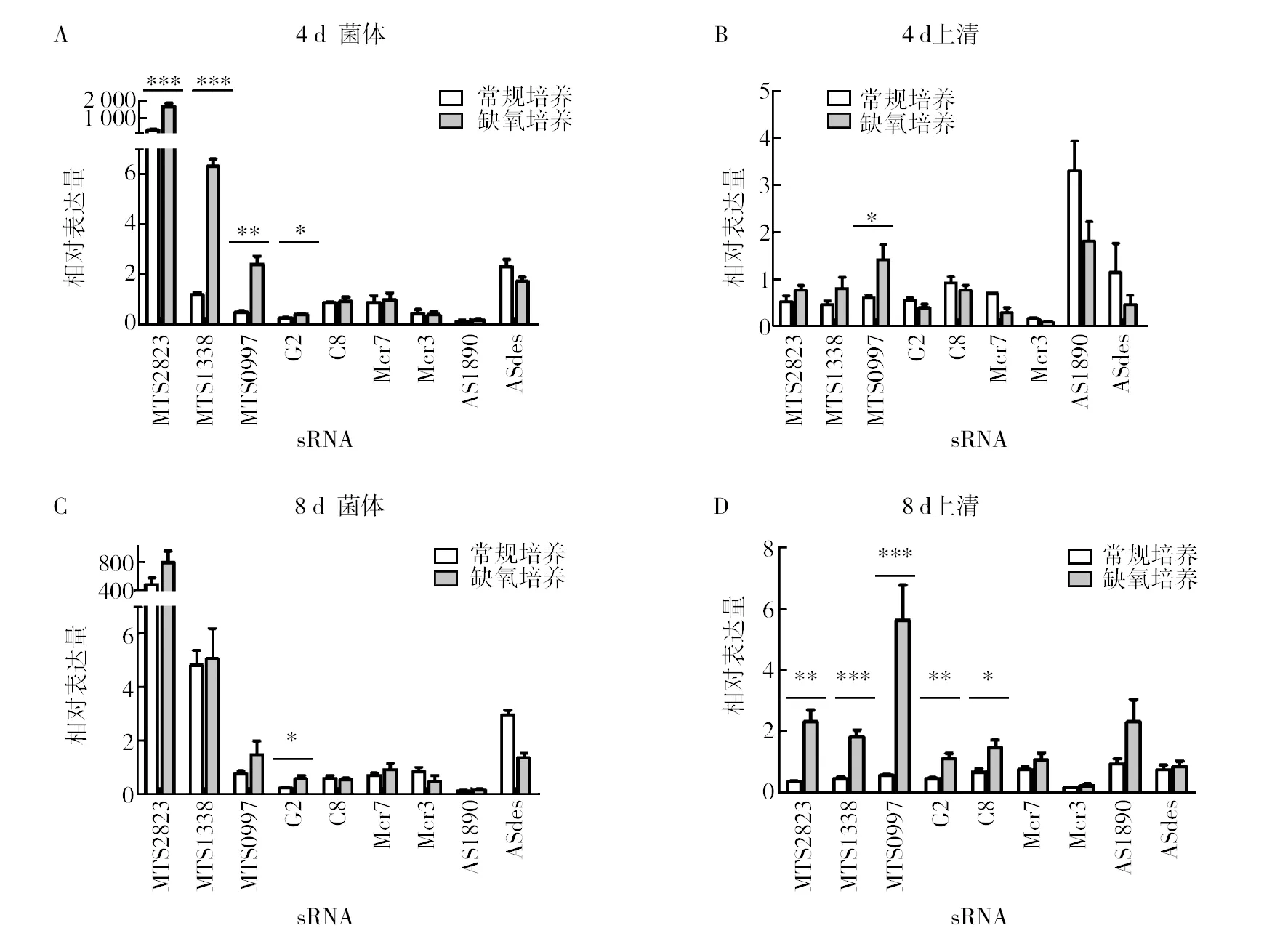
图4 受缺氧诱导的BCG菌体内外sRNA的相对表达量Fig.4 The relative expression of sRNA in the bacteria and supernatant of BCG induced by hypoxia *P<0.05 ,**P< 0.01 ,***P< 0.001
2.5 缺氧培养时BCG菌体内外sRNA表达量的比较
比较同一种sRNA在缺氧条件下菌体内外的含量差异,将sRNA菌体外与sRNA菌体内做比值。结果显示,缺氧4 d时,AS1890的比值大于1,此时在菌体外的相对表达量较高;而G2的比值接近1,表明其在菌体内外的相对表达量相近;其他7种sRNA,即MTS2823、MTS1338、MTS0997、C8、Mcr7、Mcr3和ASdes的比值小于1,说明此时这些sRNA在BCG菌体内的相对表达量高于菌体外。至缺氧8 d时,除AS1890外,MTS0997、G2、C8和Mcr7的比值均大于1;而MTS2823、MTS1338、Mcr3和ASdes的比值均小于1(图5)。由此可见,缺氧环境下AS1890在菌体外的相对表达量一直高于菌体内,而MTS0997、G2、C8、Mcr7在缺氧后期菌体外的相对表达量较高。
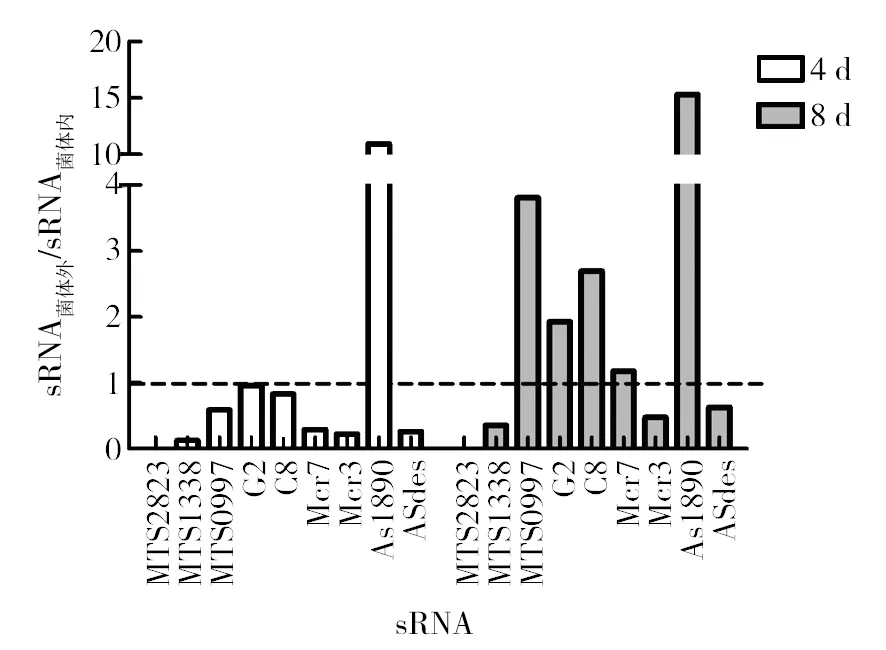
图5 缺氧培养时BCG菌体外与菌体内sRNA相对表达量的比值Fig.5 The ratio of extracellular to intracellular sRNA expression in hypoxia culture
2.6 缺氧诱导的sRNA启动子区DosR结合基序的分析
根据文献报道的DosR结合基序的简并回文序列[14],分析受缺氧诱导表达升高的sRNA 基因上游启动子区的序列特征,发现MTS1338和G2基因的上游具有符合这一序列特征的基序(图6),提示这些sRNA的转录可能直接受DosR的调节。
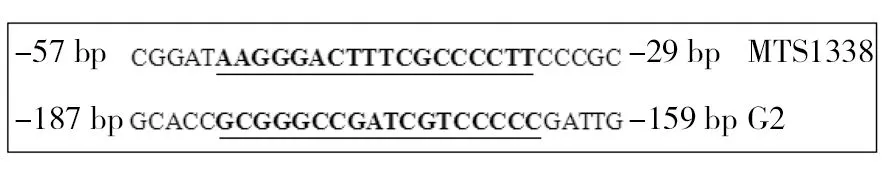
图6 MTS1338和G2启动子区与DosR的结合位点Fig.6 Analysis of binding motif with DosR in MTS1338 and G2 Promoter region横线区域为MTS1338和G2与DosR的结合区域,这两段结合区域均为简并回文序列。以MTS1338和G2的起始位点为1标记基序位置The horizontal area is the combination area of MTS1338 and G2 and DosR, and these two binding regions are degenerate palindromes. The motif position is marked with the starting site of MTS1338 and G2 as 1
3 讨 论
细菌的sRNA可经细胞外囊泡或细菌裂解的途径被分泌到菌体外,作为细胞间信号分子,参与细菌感染与免疫反应的进程[4-7,15]。同时,细菌的sRNA可分布于宿主的多种体液中[8-9],之前从结核患者的血浆中检测到结核分枝杆菌的sRNA,其检出率在患者和对照组间存在差异[16]。为筛选更多用于结核分枝杆菌感染的候选标志物,并进一步认识其在致病中的作用,本研究检测并分析了BCG菌体内外的sRNA谱。结果发现,常规培养时,BCG菌体内外能够检测到全部9种sRNA的片段,但在细菌的整个生长周期中,这些sRNA在两种组分中的表达谱不同且呈动态变化。细菌生长的前20 d,菌体内丰度最高的为MTS2823,其次为MTS1338。在菌体外丰度最高的为Mcr3,其次为MTS2823。而20 d之后,菌体外sRNA变化较大,Mcr3的丰度下降明显,MTS2823的丰度有所下降,但不明显,而AS1890的丰度升高。
为适应环境变化,细菌的sRNA受应激因素的刺激而发生差异表达。RNA测序研究发现,在铁饥饿、氧化应激、膜应激、酸性pH和营养饥饿条件下,结核分枝杆菌菌体内有82种sRNA在至少一种应激条件下具有多于6倍的差异表达[17]。为进一步探究结核分枝杆菌菌体内外sRNA的含量变化规律,建立了BCG菌株的缺氧应激模型,缺氧4 d时,在BCG菌体内,受缺氧诱导表达量比常规培养时增多的sRNA有4种,即MTS2823、MTS1338、MTS0997和G2,至缺氧8 d时,表达量高于常规培养时的sRNA只剩下G2一种。
DosR(dormancy survival regulator)是结核分枝杆菌的一种反应调节蛋白,由Rv3133c基因编码,在细菌缺氧时表达增高,DosR可以诱导结核分枝杆菌进入休眠状态,在结核分枝杆菌潜伏感染时起重要作用[18-19]。对受缺氧诱导表达增加的sRNA,进一步分析上游启动子区域的序列,发现MTS1338和G2中存在DosR的结合基序,其转录可能直接受DosR调节。在DosR敲除菌株中,菌体内MTS1338的表达会显著降低[2]。MTS1338受缺氧调控表达增加,且MTS1338的启动子区域存在与DosR的结合序列,进一步说明MTS1338的表达受DosR的调控。G2也受缺氧应激诱导,且也存在DosR的结合序列,提示G2可能与MTS1338一样,在缺氧时也直接受到DosR的调节。
对于菌体内外sRNA的相对表达量比较,常规培养时,MTS0997、G2、Mcr7、Mcr3和AS1890在菌体外的相对表达量高于菌体内。缺氧培养时,MTS0997、G2、C8、Mcr7和AS1890在菌体外的相对表达量高于菌体内。说明MTS0997、G2、Mcr7和AS1890在菌体外的含量一直较高,不受缺氧影响;Mcr3只在常规培养的菌体外含量较高;C8只有在缺氧时,菌体外水平才增高,表明其受缺氧影响向菌体外释放。
本研究发现BCG菌体内外sRNA的表达谱不同,且一部分sRNA在常规培养和缺氧应激时向菌体外释放,同时发现了细菌受缺氧诱导的sRNA种类。在菌体外高表达的sRNA,具有作为感染候选标志物的潜能,值得进一步研究其在结核病中的诊断意义。后续研究将设计相应sRNA的标记探针,应用Northern Blot实验,确认并鉴定胞外sRNA的种类和长度。同时,采用SecA、EsX等分泌系统缺失突变株,探究这些菌体外sRNA分泌的机制。

