rhFGF4在大肠杆菌中的表达、纯化及其对高糖损伤的人脐静脉内皮细胞的保护作用
张煜,吴芬芳,张梦,田海山,李校堃
温州医科大学 药学院,浙江 温州 325035
近年来糖尿病已发展成为威胁人类健康的主要重大疾病[1-2],而糖尿病性血管并发症是该病最主要的致残致死原因[3-5],内皮功能障碍是其发病的主要机制之一。持续的高血糖状况导致心血管内皮细胞代谢紊乱和氧化应激,从而引起渗透性增加、内皮舒张受损等,最终导致血管损伤[6]。因此,发现修复内皮细胞损伤的候选药物,研究其促血管修复作用的机制对糖尿病性血管并发症的治疗具有重要意义,并可能会揭示其新的潜在治疗靶点。
成纤维细胞生长因子4(fibroblast growth factor 4,FGF4)是由hst-1原癌基因编码的一种生长因子[7-8]。研究表明,FGF4蛋白在体内外均具有显著的促血管生成活性,并被证明在新生毛细血管的生长及在动脉生成过程中发挥关键作用[9]。据 此,我们在GenBank中查找到人FGF4(hFGF4)的编码基因,通过密码子优化在大肠杆菌中高效表达并纯化,对高糖诱导损伤的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)模型的修复及相关作用机制开展研究。
1 材料和方法
1.1 材料
1.1.1 菌株、载体及细胞:原核表达载体pET3d、大肠杆菌DH5α感受态细胞和大肠杆菌BL21(DE3)PlysS宿主菌均由本实验室提供,原代HUVEC及NIH3T3细胞均由实验室自备。
1.1.2 主要试剂:质粒提取试剂盒、胶回收试剂盒、限制性核酸内切酶NcoI和BamHI均购自英国BioLabs公司;Triton X-100购自北京索莱宝科技有限公司;氨苄霉素、氯霉素以及IPTG购自上海捷瑞生物工程有限公司;去氧胆酸钠购自合肥Biosharp公司;DMEM低糖培养基和MCDB131培养基购自美国Gibco公司;ECM培养基购自美国ScienCell公司;PMSF、丙二醛(methylene dioxyamphetamine,MDA)检测试剂盒以及活性氧(reactive oxygen species,ROS)检测试剂盒购自上海碧云天生物技术有限公司;p-JNK、JNK、p-p65、p65、p-p38、p38、β-actin等抗体均购自美国CST公司;rhFGF2(bFGF)蛋白由本实验室制备。
1.1.3 HUVEC的原代分离及培养:无菌条件下,将人脐带放入含预热PBS的培养皿中,剪去血肿部分并挤出脐带血。将平针头注射器从一端插入脐静脉,止血钳固定,预热的PBS冲洗血迹至完全干净。随后用0.1%胶原酶II灌注使其充盈。取出针头,止血钳夹住注入端,移入培养皿中,在细胞培养箱孵育30 min后收集脐静脉内的消化液。注入含10%胎牛血清的ECM培养液再次冲洗管腔,将消化液与冲洗液一并收集于离心管,1 000 r/min,5 min,弃上清液,加入ECM完全培养液,按1×106个/mL接种于培养瓶,使用ECM完全培养基于37 ℃,5% CO2培养。当长至80%左右,用含EDTA的胰酶消化传代。给药时使用含2% FBS和1%双抗的MCDB131饥饿培养基。
1.1.4 NIH3T3细胞培养:将冻存的NIH3T3细胞复苏后,使用DMEM低糖完全培养基培养于37 ℃,5% CO2培养箱中。长至80%左右,用含EDTA的胰酶消化传代。给药时使用含2% FBS和1%双抗的DMEM低糖饥饿培养基。
1.2 方法
1.2.1 pET3d-hFGF4重组质粒的构建:由苏州GENEWIZ公司优化并合成基因hFGF4(GenBank accession NO.NM_002007.3),将基因克隆至载体pUC57-Amp,含有NcoI和BamHI两个酶切位点。用胶回收试剂盒提取由这两种限制性核酸内切酶切割得到的目的片段和pET3d表达载体,通过DNA连接酶连接,得到pET3d-hFGF4重组质粒。将该质粒转入DH5α感受态细胞中,通过双酶切和基因测序进行验证。
1.2.2 rhFGF4蛋白的表达:提取重组质粒转入到大肠杆菌BL21(DE3)PlysS宿主菌中,用含有双抗(100 μg/mL的氨苄青霉素和34 μg/mL的氯霉素)的LB琼脂平板筛选。将阳性克隆接种到含有双抗的LB液体培养基中,37 ℃,180 r/min震荡培养至A600达到0.8~1.2,加入IPTG(终浓度0.5 mmol/L)诱导表达4 h,Western blot进行鉴别实验。SDS-PAGE检测筛选出高表达单菌落并将其制备成甘油菌,超低温冰箱保存。取制备的甘油菌以1:100(V/V)接种到含有双抗的LB液体培养基中进行种子扩增,以180 r/min、37 ℃振荡培养至A600达到3.0~4.0。再将该菌液以1:20的比例接种于新鲜培养基中进行发 酵,以180 r/min、37 ℃振荡培养至A600达到0.8~1.2,加入IPTG(终浓度0.5 mmol/L)诱导4 h,4 ℃,9 000 r/min离心10 min后收菌并冻存于-80 ℃。
1.2.3 rhFGF4菌体破碎:称取菌体悬浮于40倍量(g/mL)裂解液(10 mmol/L PB,0.1 mmol/L NaCl,2 mmol/L EDTA-2Na,0.05% Tween-80,1 mmol/L PMSF,pH 7.4)中,充分搅匀,冰浴条件下超声破碎,至镜检下可见视野范围内无完整大肠杆菌。将破菌后的液体用高速冷冻离心机在4 ℃、20 000 r/min离心30 min。取上清液和沉淀,取样进行12% SDSPAGE电泳,鉴定rhFGF4蛋白在大肠杆菌中的表达形式。
1.2.4 rhFGF4包涵体清洗及变性:可溶性分析结果示rhFGF4蛋白主要以包涵体形式表达,因此先进行多步包涵体洗涤操作去除膜蛋白、核酸及脂类等杂质,再进行变性溶解。取菌体破碎离心后的沉淀,加入40倍量(g/mL)洗涤缓冲液1(10 mmol/L PB,0.1 mmol/L NaCl,2 mmol/L EDTA-2Na,1% Triton X-100,0.2%去氧胆酸钠,pH 7.4),充分混匀后室温下磁力搅拌洗涤2 h,4 ℃、20 000 r/min离心30 min,弃上清液留沉淀;称取沉淀,加入40倍量(g/mL)洗涤缓冲液2(10 mmol/L PB,0.1 mmol/L NaCl,2 mmol/L EDTA-2Na,1% Triton X-100,pH 7.4),充分混匀后室温磁力搅拌洗涤2 h,4 ℃、 20 000 r/min离心30 min,弃上清液留沉淀。取沉淀,加入40倍量(g/mL)洗涤缓冲液3(10 mmol/L PB,0.1 mmol/L NaCl,2 mmol/L EDTA-2Na,1% Triton X-100,2 mol/L脲,pH 7.4),充分混匀后室温磁力搅拌洗涤2 h,4 ℃、20 000 r/min离心30 min,弃上清液得包涵体。以上每一步取沉淀和上清液进行12% SDS-PAGE检测。精密称取包涵体,加入20倍量(g/mL)变性液(10 mmol/L PB,0.05 mmol/L NaCl,2 mmol/L EDTA-2Na,8 mol/L脲,10 mmol/L DTT,pH 7.4),充分混匀后在磁力搅拌条件下低温溶解过夜(8~10 ℃,12 h以上),8 ℃、20 000 r/min离心30 min,取上清液得到包涵体变性溶液。
1.2.5 rhFGF4蛋白的纯化:在蛋白纯化设备(美国GE公司,AKTA pure)上,用10倍体积平衡液(10 mmol/L PB,0.05 mmol/L NaCl,2 mmol/L EDTA-2Na, 8 mol/L脲,10 mmol/L DTT,pH 7.4)平衡肝素柱,流速1 mL/min;以0.5 mL/min上变性后的蛋白样品,再用上述平衡液以流速0.5 mL/min充分平衡后开始进行梯度复性。A液:10 mmol/L PB,0.05 mmol/L NaCl,2 mmol/L EDTA-2Na,8 mol/L脲,10 mmol/L DTT,pH 7.4;B液:10 mmol/L PB,0.05 mmol/L NaCl,2 mmol/L EDTA-2Na,10 mmol/L DTT,pH 7.4,梯度设置见表1。复性完全后,用含0.1、0.3、0.6、1.2、2.0 mol/L NaCl的洗脱液(10 mmol/L PB, 2 mmol/L EDTA-2Na,pH 7.4)进行洗脱(10个柱体 积,1 mL/min),收集各阶段的穿出峰,用12% SDSPAGE检测。

表1 柱上复性梯度设置
1.2.6 MTT实验:计数实验细胞,以4 000个/孔铺于96孔板中。当细胞贴壁后,去除完全培养基,加入饥饿培养基培养6 h。为验证rhFGF4蛋白的促增殖作用,加入不同浓度梯度的rhFGF4蛋白,并以bFGF蛋白作为阳性对照组、PBS作为阴性对照组。为验证rhFGF4蛋白对高糖损伤的HUVEC有修复作用,加入葡萄糖溶液培养24 h后,加入不同浓度梯度的rhFGF4蛋白作用24 h,加入MTT避光培养4 h。去除培养基,每孔加入150 μL DMSO,测定490 nm处吸光度。
1.2.7 MDA的测定:将HUVEC细胞铺于6孔板中,用葡萄糖溶液损伤24 h后,每孔加入不同浓度的rhFGF4蛋白,24 h后获取总蛋白,用BCA试剂盒测定浓度,使用MDA检测试剂盒测定其含量。
1.2.8 Western blot分析:提取细胞总蛋白,BCA试剂盒测定浓度,12% SDS-PAGE胶的上样孔中每孔加入25 μg蛋白样品,电泳结束后采用湿法转膜系统转膜1 h,5%脱脂牛奶中封闭1 h,TBST清洗3次,每次 6 min,4 ℃摇床上过夜孵育抗体:p-JNK(1:1 000),JNK(1:1 000),p-p65(1:1 000),p65(1:1 000),p-p38(1:1 000),p38(1:1 000),β-actin(1:5 000)。TBST清洗3次,每次6 min,在室温下孵育羊抗兔或鼠IgG二抗(1:8 000)1 h,TBST清洗3次,每次 6 min,用Western blot Luminol检测条带,并用Image lab软件进行定量。
1.2.9 流式细胞仪测定ROS含量:将HUVEC铺于6孔板中,用35 mmol/L葡萄糖损伤24 h后,分别加入不同浓度梯度的rhFGF4蛋白,作用24 h,使用ROS检测试剂盒处理细胞,流式细胞仪检测ROS含量。
1.3 统计学处理方法 采用GraphPad Prism 6.0软件进行统计分析。所有实验数据均以表示。使用单因素方差分析进行多组间比较,Tukey进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的构建与鉴定 将构建于克隆载体pUC57上的hFGF4基因(542 bp)用NcoI和BamHI酶切并与pET3d表达载体(4 637 bp)连接,随机挑选阳性菌株进行双酶切鉴定。结果显示,重组质粒酶切后表达载体与目的基因大小与理论值相符,表明成功构建pET3d-hFGF4重组质粒。见图1。
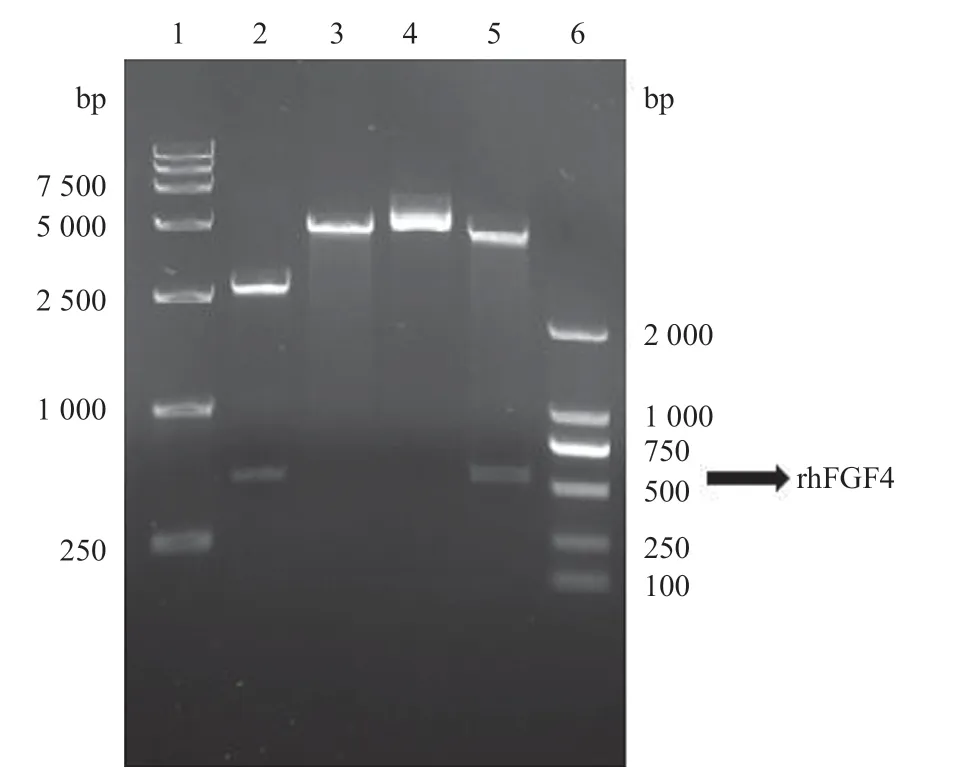
图1 pET3d-hFGF4重组质粒双酶切鉴定
2.2 rhFGF4蛋白的表达与纯化 选取不同单菌落培养诱导,通过SDS-PAGE检测筛选出高表达菌株并将其制备成甘油菌。取甘油菌培养后诱导4 h,SDSPAGE结果见图2A,Western blot鉴定结果呈阳性反应,见图2B,表明制备的重组质粒稳定表达rhFGF4蛋白。常温(37 ℃)诱导目的蛋白大部分以包涵体形式表达,低温(20 ℃)诱导亦不能促进其可溶性表达量,表明在大肠杆菌表达系统中rhFGF4蛋白主要以包涵体形式表达,见图2C和2D。将包涵体清洗后,用含8 mol/L脲的变性液溶解过夜,大部分目的蛋白可溶解于变性溶液中,见图2E。将蛋白在变性条件下进行肝素亲和柱层析,用A液平衡后与复性液B进行梯度复性。复性完全后,再利用目的蛋白、杂质与肝素的亲和力不同,通过调节NaCl浓度进行洗脱,获得纯度>95%的rhFGF4蛋白,见图2F。

图2 rhFGF4蛋白的表达与纯化
2.3 rhFGF4蛋白促进NIH3T3细胞及HUVEC增殖 MTT法检测rhFGF4蛋白对NIH3T3细胞和HUVEC的促增殖作用,以bFGF蛋白作为阳性对照。图3A显示,不同浓度下的rhFGF4蛋白均能促进NIH3T3细胞的增殖,并在0~320.0 ng/mL内呈剂量依赖性,表明纯化的蛋白具有良好的生物学活性。图3B显示,rhFGF4蛋白能促进HUVEC的增殖,以浓度为80 ng/mL 及以上的促增殖作用最为显著。

图3 rhFGF4蛋白对NIH3T3细胞和HUVEC的促增殖活性
2.4 rhFGF4对高糖损伤的HUVEC具有修复作用 HUVEC铺于6孔板中,用不同浓度葡萄糖溶液损伤24 h,MTT法测量吸光度值。结果显示,葡萄糖溶液浓度为35 mmol/L时细胞死亡率约为50%,选择该浓度建立HUVEC损伤模型,见图4。HUVEC损伤24 h后,更换含有不同rhFGF4蛋白浓度的饥饿培养基作用24 h,并以bFGF蛋白作为阳性对照,MTT法测量吸光度值。结果显示,rhFGF4蛋白对葡萄糖溶液损伤的HUVEC具有显著的保护作用,并呈现剂量依赖性,见图5。

图4 不同浓度葡萄糖对HUVEC活力的影响

图5 不同浓度rhFGF4蛋白对高糖损伤的HUVEC的促增殖作用
2.5 rhFGF4蛋白减少高糖损伤的HUVEC的MDA含量 高糖损伤HUVEC 24 h后,加入不同浓度rhFGF4蛋白作用24 h,收集蛋白测定MDA含量,结果显示,与高糖损伤组(HG组)相比,不同浓度的rhFGF4蛋白均能显著降低细胞内MDA含量,并呈现剂量依赖性,见图6。

图6 不同浓度rhFGF4蛋白对HUVEC中MDA含量的影响
2.6 rhFGF4蛋白减少高糖诱导的JNK、p38 MAPK以及NF-κB磷酸化的表达 结果显示,高糖诱导增加p-JNK、p-p38以及p-NF-κB的磷酸化水平,而rhFGF4蛋白可以显著抑制高糖诱导下的上述蛋白的过表达,见图7。

图7 rhFGF4蛋白对高糖诱导的JNK、NF-κB以及p38 MAPK磷酸化的影响
2.7 rhFGF4减少高糖损伤的HUVEC中ROS含量 流式细胞仪检测结果显示,高糖损伤HUVEC导致ROS含量增加(P<0.05),见图8A。高糖损伤24 h后,加入rhFGF4培养24 h,结果显示,不同浓度的rhFGF4蛋白均能显著降低细胞内ROS含量(P<0.05),见图8B。

图8 rhFGF4对高糖损伤的HUVEC中ROS含量的影响
3 讨论
血管内皮细胞是衬于血管内表面的单层扁平上皮细胞,是血液与组织之间的重要屏障[10]。糖尿病患者长期且持续的高血糖可降低血管内皮细胞DNA含量,影响血管内皮细胞的更新,进而加速内皮细胞的损伤,最终导致血管损伤,引发心脑血管、下肢血管等的病变[11]。因此,研究高糖条件下对血管损伤的保护和修复,具有重要的临床意义。
已有文献报道,FGF4蛋白作为重要的血管生长因子,通过MAPK途径参与调控细胞分化[12],并以自分泌的方式诱导VEGF分泌,间接促进血管内皮细胞的增殖和迁移,从而加速新生血管的形成[13]。由拜耳先灵制药公司开发的Alferminogene tadenovec是一种可编码人FGF4基因进而促进血管形成的基因治疗药物,主要用于心脏微血管缺陷导致的心肌缺血和慢性心绞痛患者[14-15]。但是,在高糖条件下FGF4蛋白是否仍对血管损伤具有保护和修复作用,目前尚未见相关研究报道。
为探讨rhFGF4蛋白对血管的作用,本研究提取原代HUVEC作为检测细胞株,阳性对照选择FGFs中具有强促血管生成作用的bFGF蛋白[16-17],结果表明,HUVEC活力下降是由高糖而非高渗引起,实验组rhFGF4蛋白显著促进HUVEC增殖,并在一定范围内呈剂量依赖性,与bFGF蛋白促增殖作用相仿。建立高糖诱导损伤HUVEC模型,进一步探究rhFGF4蛋白对其保护作用,结果表明,rhFGF4蛋白显著促进受损的HUVEC细胞增殖,并呈剂量依赖性,其中80 ng/mL 为最适宜浓度,其作用效果优于对照组bFGF蛋白。
研究表明,氧化应激是导致糖尿病性血管病变的重要机制[18]。本研究通过检测高糖诱导损伤HUVEC模型检测细胞中的ROS、MDA指标的变化,探讨rhFGF4蛋白改善血管内皮细胞损伤的可能作用机制,结果显示,与正常葡萄糖的环境相比,在高葡萄糖环境中HUVEC ROS、MDA含量显著增加,而给予rhFGF4蛋白可以显著降低高糖诱导产生的ROS、MDA含量。此外,p-38和JNK调节MAPK信号通路,参与氧化应激和细胞凋亡,氧自由基的形成会导致NF-κB的激活从而引起细胞凋亡[19-21]。通过检测与氧化应激相关的信号转导通路中的关键蛋白p-38、JNK以及NF-κB发现,rhFGF4蛋白在高糖损伤的HUVEC中可以抑制以上三个蛋白的磷酸化,从而保护HUVEC。实验中原代HUVEC过于脆弱,在饥饿过程中会产生些许损伤,所以Western blot结果示意图中,空白对照组的磷酸化程度也略有提高。
综上,本研究提示rhFGF4蛋白可能通过改善氧化应激水平从而对高糖诱导的HUVEC起保护作用。后续需要进一步通过体内实验证实,rhFGF4蛋白在高糖条件下对血管的保护和生成作用及机制,为临床药物的开发提供依据。

