腺苷-3’, 5’-环磷酸-氧蒽酮希夫碱的合成及其与LC3B的绑定结合
周超群,汤石鹏,钱亮亮,甄政安,程如梅
温州医科大学 眼视光学院(生物医学工程学院) 纳米生物材料研究所,浙江 温州 325027
正确的蛋白折叠形态是维持细胞与组织稳定生化过程的基础[1]。基因突变、应激以及不良的翻译后修饰常常导致蛋白错误折叠[2]。错误折叠蛋白的堆积易引发一系列疾病,例如阿尔茨海默病、亨廷顿病、白内障等[3]。最近,科学家尝试利用自噬标志物微管相关蛋白1轻链3(LC3)作为靶标,设计引导型药物分子,识别并诱导致病的错误折叠蛋白定位到自噬体膜上,利用自噬降解相关致病蛋白,保留结构相近的功能性蛋白,达到治疗目的,取得了理想的结果[4]。
本研究将氧蒽酮与腺苷-3’,5’-环磷酸反应,得到腺苷-3’,5’-环磷酸-氧蒽酮希夫碱(S1),研究其与自噬标志物LC3B的作用,得到二者的结合模式和稳定常数,从分子水平上揭示如何通过LC3B的作用来开发诱导自噬的潜在药物。
1 材料和方法
1.1 主要试剂 氧蒽酮、腺苷-3’,5’-环磷酸、三乙胺、磷酸系PBS缓冲溶液、乙醇,均由国药集团上海试剂公司提供。重组人LC3B蛋白(ab103506)购自艾博抗(上海)贸易有限公司。LC3B溶液使用时新鲜配制。所有溶液均用去离子水配制。
1.2 实验仪器 紫外可见分光光度计(Lamda 35,美国Perkin Elmer公司),荧光光谱仪(AB-series 2 luminescence spectrometer,日本Hitachi High-Technologies公司),元素分析仪(Vario EL III型,德国Elmentar公司)。
1.3 S1的合成 将0.1961 g(1 mmol)氧蒽酮溶解于20 mL无水乙醇中,加入0.3292 g(1 mmol)腺苷-3’,5’-环磷酸和0.3 mL冰醋酸,加热回流450 min,冷到室温,过滤,收集浅黄色沉淀,分别用水、乙醇、无水乙醚洗涤多次。真空干燥。产率:73%。元素分析:计算值C22H18N5O7P,C 53.34%,H 3.66%,N 14.14%,O 22.61%;测试值:C 53.32%,H 3.86%,N 14.11%,O 22.63%。
1.4 光谱测试 所有测试均在pH 7.4的PBS缓冲溶液中进行,使用时将LC3B新鲜配成浓度为1× 10-4mol/L工作溶液;测试前将LC3B溶液和S1溶液混合后放置160 s,再进行紫外-可见光谱或者荧光光谱测定。反应动力学测定,将LC3B溶液和S1溶液调成所需要的浓度,混合后,间隔一定时间测定 352 nm附近的紫外-可见光谱变化。
2 结果
2.1 LC3B与S1作用的动力学 图1为浓度 2.0×10-5mol/L的S1与LC3B作用160 s后的紫外-可见光谱图。由图1可见,S1有三个典型的谱峰,分别在239、260、341 nm处。位于大约270 nm处的一个弱而宽的峰,归属于LC3B芳基氨基酸残基的弱的n-π*吸收峰。将浓度相同的S1和LC3B溶液混合,每隔一段时间对体系进行扫描,所得的紫外-可见光谱图见图2。从图可知,在刚开始时S1的紫外-可见光谱处于最上端,加入LC3B后吸光度下降。在160 s之内,随时间的推移,光谱逐步从341 nm红移,最后稳定在350 nm,吸收强度缓慢下降。
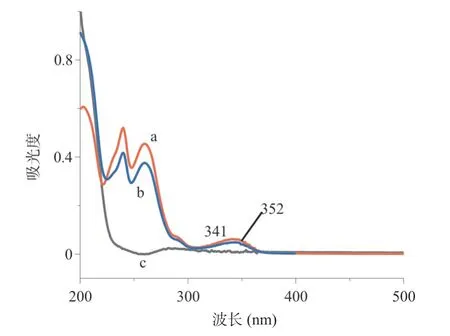
图1 S1和LC3B相互作用的紫外-可见光谱图

图2 S1和LC3B随时间变化的紫外-可见光谱图(S1和LC3B浓度均为1.0× 10-5 mol/L)
由一级反应动力学方程和朗伯比尔定律[5],得

式中A0、A分别为S1全部处于自由状态下的吸光度和S1与LC3B完全结合后的吸光度(这里取波长为352 nm处的吸光度),At为时刻t时的吸光度,k是反应速率常数。通过ln(A-A0)对t作图,可以得到S1与LC3B结合后的反应速率常数(见图3、表1)。

表1 LC3B与S1不同比例的反应动力学参数

图3 不同[LC3B]/[S1]比例的反应动力学关系图
2.2 LC3B与S1作用的热力学研究 图4显示在239 nm 激发下,LC3B在278 nm处有一个很宽的荧光峰,而S1在315 nm发出较强的荧光,覆盖了大部分的LC3B谱峰。S1荧光峰随着LC3B浓度变化(见图5)的测定结果表明随着LC3B浓度的增大,S1在315 nm处的荧光峰并没有成比例提高,反而呈现出下降趋势。

图4 S1和LC3B溶液的荧光光谱
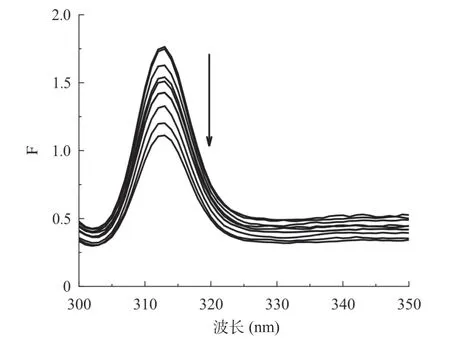
图5 LC3B对S1的荧光滴定图
从分子相互碰撞能量转移的角度研究,当荧光体与猝灭剂由于热运动发生碰撞时,可引起荧光体的荧光猝灭。这种碰撞猝灭服从Stern-Volmer方 程[6]:

其中F0是自由的S1的荧光强度,F是加入LC3B后的荧光强度,C为LC3B的浓度,Ksv为Stern-Volmer荧光猝灭常数。从图6和表2看,S1和LC3B作用符合Stern-Volmer方程。在这样的情况下,碰撞分子形成复合物的结合常数K和位点数n与荧光强度存在以下关系:

图6 不同温度下的Stern-Volmer线性图

综合Stern-Volmer方程关系,得到表2的Stern-Volmer方程和分子复合物参数。

表2 LC3B滴定S1的荧光特征参数
由表2所得到的S1和LC3B结合常数K可以进一步计算出S1和LC3B结合的热力学参数ΔH、ΔS和ΔG:

式中ΔG、ΔH、ΔS分别为吉布斯自由能、焓变及熵变。其结果列于表3。

表3 S1结合到LC3B上的热力学参数
3 讨论
药物分子与蛋白质分子的相互作用包括静电力、氢键、疏水作用力和范德华力。不同类别的作用力将会影响药物分子与蛋白质结合、药物代谢、转运等过程。为此,本研究从分子动力学和热力学角度去探讨与自噬相关的LC3B靶向化合物的作用模式。由图1紫外-可见光谱可知,S1在239和260 nm处显示出两处典型的共轭环π-π*跃迁峰,290 nm的宽的肩峰为杂环的n-π*吸收峰,而希夫碱的C=N强烈的n-π*则出现在341 nm处。LC3B只显示很弱的芳基氨基酸残基的n-π*吸收峰。通过时间变化观察LC3B与S1的变化过程,发现随着时间的增加S1的C=N吸收峰下降,并逐步红移,最后平衡在352 nm。说明S1与LC3B作用有一个缓慢的滞后期,时间为 4 min,希夫碱就与LC3B发生了强烈的作用。且当S1作用于LC3B时,LC3B在反映蛋白质螺旋结构的210 nm处吸光度有所下降,显示出S1有嵌插进入LC3B主链的情况,螺旋结构稍微变松散[7]。改变S1和LC3B浓度比,可以发现所得的反应速率常数基 本维持不变,符合准一级反应和药物的定比转运规律[8]。
荧光光谱表明随着LC3B的加入,S1位于315 nm的荧光发射峰缓慢下降,而该峰与S1分子中的C=N双键和几乎共平面的氧蒽酮三环共轭结构相关[9], 表明S1和LC3B的相互作用的确发生在希夫碱的碳氮双键上,与紫外-可见光谱的结果一致。S1和LC3B作用符合Stern-Volmer方程,随着温度的升高,斜率下降,表明温度的升高,分子运动增强,并没有引起荧光猝灭的增强,体系不是动态猝灭,为静态猝灭,二者形成了复合物。且在不同实验温度下,Stern-Volmer方程具有良好的线性关系,说明复合物只有一种结合模式。通过方程(3)计算得到S1和LC3B的结合位点数为1。热力学结果表明,吉布斯自由能ΔG<0,S1和LC3B的结合为一个自发的过程。而研究[10]表明,当ΔH<0、ΔS>0,药物分子与蛋白质之间主要是疏水作用,当ΔH<0、ΔS<0时为典型的氢键和范德华力结合,而当ΔH接近0、ΔS>0或者当ΔH<0,忽略ΔS的情况下,主要为静电作用。结合前述光谱研究和表3,可以发现S1和LC3B的作用力主要为静电作用,这种静电力,影响了C=N上的电子共轭,从而导致荧光猝灭。
综上所述,本研究合成得到了一种具有LC3B结合绑定功能的腺苷-3’,5’-环磷酸-氧蒽酮希夫碱,其与LC3B的结合满足准一级动力学方程和药物分子的定比转运规律。分子热力学研究表明二者的结合为静电作用的结果,S1与LC3B以一种复合物的结合模式存在,结合位点数为1。

