凡纳滨对虾养殖水中藻毒素和环境因子间的相关性
成婕 沈辉 万夕和 乔毅 蒋葛 王李宝 黎慧 史文军

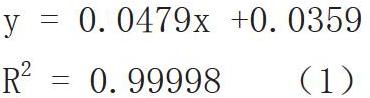

摘要:调查了凡纳滨对虾养殖池塘水体中微囊藻毒素的含量及其与环境因子间的关系,为凡纳滨对虾健康养殖提供理论依据。本实验室采用固相萃取(SPE)和高效液相色谱(HPLC)测定其微囊藻毒素MC-LR的含量;研究了MC-LR浓度与氨氮(NH3-N)、总氮(TN)、总磷(TP)和水温等环境因子间的关系。结果发现其水样检测出微囊藻毒素MC-LR的最高浓度为23.15 μg/L,氨氮、TN、TP与MC-LR 均呈显著性正相关,氨氮、TN、TP、MC-LR与水温均呈显著性负相关。该实验结果验证了在发病的凡纳滨对虾养殖池塘中检出微囊藻毒素MC-LR的现象,初步推论凡纳滨对虾养殖池塘中微囊藻毒素MC-LR的含量与相关环境因子有关。
关键词:凡纳滨对虾;微囊藻毒素MC-LR;肝胰腺坏死症;环境因子;相关性
中图分类号:S941.44 文献标识码:A
文章编号:1006-3188(2021)02-008-04
凡纳滨对虾(litopenaeus vannamei)具有生长速度快且营养价值高等优点,深受养殖户及消费者的喜爱,是世界上产量最大的三大养殖虾之一。我国对虾养殖业发展迅猛,养殖产量逐年提高[1]。蓝藻毒素因作用位置被分为不同类型。其中最为常见的是微囊藻毒素,具有生物活性的单环七肽化合物[2]。本实验拟调查分析凡纳滨对虾养殖过程中微囊藻毒素含量,了解藻毒素与水环境因子的相关性,为凡纳滨对虾健康养殖和疾病控制提供理论依据[3]。
1 试验方法与步骤
1.1 水样的采集和保存
取2000 mL水样放在-20℃的冰箱中保存,测定之前在4℃,5000 rpm,离心10 min取上清液。水温、pH和溶解氧在采样时直接测定。
1.2 TP、TN和氨氮常规指标的分析测定
TN采用过硫酸钾氧化显色分光光度法,TP采用过硫酸钾-钼酸盐-抗坏血酸显色光度法,氨氮采用水杨酸显色光度法。
1.3 微囊藻毒素的分析測定
连接SPE固相萃取装置将1000 mL水样进行富集浓缩,注入高效液相色谱仪检测。
1.4 数据处理
用SPSS 17.0 对水质数据进行统计分析,采用 Excel软件作图。
2 结果
2.1 标准曲线
MCs易溶于水、甲醇等极性溶剂,由于环状结构和间隔双键,MCs具有相当高的化学稳定性,普通的蛋白质水解酶对其也起不了作用,但是在有色素存在或有微生物作用下,紫外线照射可以使MCs可迅速降解、失活。
由标准品藻毒素配制9个浓度梯度进行标准曲线的制作(如图1)。并由标准曲线获得藻毒素MC-LR的浓度与响应峰面积的线性回归方程:
y = 0.0479x +0.0359
R2 = 0.99998 (1)
其中x为响应峰面积,y为相应的藻毒素MC-LR的浓度。
2.2 水样中藻毒素MC-LR的浓度
本实验所测定的水样,均来自江苏省沿海地区凡纳滨对虾发病的养殖池。这些养殖池的凡纳滨对虾所表现出的主要症状是肝胰腺损伤或坏死,同时还有与“白便”症相似的伴随症状。
所有样品以及标准品的出峰时间均在4.5 min左右(图2)。通过标准曲线获得藻毒素MC-LR的浓度最低为10.03 μg/L。而一般水源地和娱乐用水检测出微囊藻毒素浓度为0.022~0.738 μg/L[4]。
2.3 虾塘水质结果
从表1中可以看出,氨氮含量为0.1~2.46 mg/L,TN含量为3.44~9.8 mg/L,TP含量为0.21~2.52 mg/L,水体处于严重的富营养化阶段。
2.4 池塘水温和氨氮、TN、TP的关系
从图3中可以看出,氨氮、TN和TP在检测期间随水温的下降而有所升高。统计结果也显示,NH3-N 与水温呈显著性负相关 (P<0.05,r=-0.867),TN 与水温呈极显著性负相关(P<0.01,r=-0.927),TP与水温呈显著性负相关(P<0.01,r=-0.916)。S6号样的水温最低为27℃,而氨氮、TN和TP均达到检测最高值。
2.5 池塘水中MCs和氨氮、TN、TP的关系
对数据的分析表明:氨氮与MC-LR 呈显著性正相关(P<0.01,r=0.949);TN与MC-LR 呈显著性正相关(P<0.05,r=0.913);TP与MC-LR也呈显著性正相关(P<0.01,r=0.976)。从图4也可看出体氨氮、TN和TP 分别与MC-LR的波动趋势在整体上呈现出一定程度上的一致性。
3 结论与讨论
3.1 MC形成的原因及影响
水体富营养化是对虾养殖水环境受到污染的主要现象[5]。蓝藻具有能吸收较宽的光波段和接受较强的光照,与氮磷等营养盐的结合能力较强等生理特性,逐步会成为优势藻种。MC会迅速与细胞内的蛋白磷酸酶结合,抑制蛋白磷酸化,干扰细胞信号传导。另一方面,MC还能导致细胞产生过量的活性氧簇,导致脂质过氧化,引起DNA损伤[6] 。
动物试验表明不同浓度梯度的MC-LR对尼罗罗非鱼原代肝细胞体外诱导,能够观察到明显的肝细胞凋亡现象,并且呈明显的时间、剂量依赖性[7]。克氏原螯虾仔虾在细胞浓度为107 cells/mL的铜绿微囊藻中生活30 d后的存活率不足50%。微囊藻毒素MC-LR对凡纳宾对虾的半致死浓度为100 μg/kg(时间为24 h),该浓度为实验室注射浓度[8]。本实验中检测到水体环境中最高浓度23.15 μg/L,远低于该半致死浓度,但已伴随明显的肝胰腺发病症状,推测水环境中弧菌等或环境因子本身等其他因素可与其产生互作关系,使MC-LR可在低浓度下诱导虾体肝胰腺坏死,出现明显症状。单纯的回感实验不足已模拟出自然环境下水环境中藻毒素对虾体的感染能力。
3.2 营养盐的变化和影响
从测定的数据来看,水温对氨氮和TN、TP有相关性。随着水温的下降,氨氮和TN、TP都有显著的上升。随着水温的降低,沉积物中的有机氮也会更利于被转化为无机氮释放到水环境中。氮不但是藻类生长的必需营养元素,而且也是合成MCs分子的必需元素,水体氮元素含量缺乏会抑制藻类的生长繁殖。反之水环境中TN含量的增加会导致蓝藻的过快生长,MCs的浓度随之升高。本实验中看出在自然水体中,MC浓度随TP的增加而上升。
参考文献
[1]相建海. 海水养殖生物病害发生与控制= Disease Occurrence and Control Strategies of Mariculture Organisms[M]. 海洋出版社,2001.
[2] Sharma V K, Triantis T M, Antoniou M G, et al. Destruction of microcystins by conventional and advanced oxidation processes: A review ☆[J]. Separation & Purification Technology,2012,91:3-17.
[3]俞順章,赵宁,资晓林,等. 饮水中微囊藻毒素与我国原发性肝癌关系的研究[J]. 中华肿瘤杂志,2001,23(2):96-99.
[4]张立将,尹立红,浦跃朴,等. 水中微囊藻毒素高效液相色谱检测与前处理条件优化[J]. 东南大学学报(自然科学版),2005,35(3):446-451.
[5]黄翔鹄. 对虾高位池水环境养殖污染和浮游微藻生态调控机制研究[D]. 东华大学,2013.
[6] R. Dawson, The toxicology of microcystins, Toxicon, 36(1998)953-962.
[7]刘秀霞,梁旭方,丁雪芬,等. 微囊藻毒素对尼罗罗非鱼原代肝细胞致毒机理的探讨[J]. 动物学杂志,2008,43(5):25-30.
[8]傅一鸣. 微囊藻毒素对凡纳滨对虾细胞免疫相关基因表达水平的影响[D]. 上海海洋大学。2014.

