紫金蜜桑叶活性成分的提取工艺优化及其抗氧化能力评价
黄雪娇,吴元辉,吴娟,迟原龙,何强,任尧
(1.四川大学轻工科学与工程学院,四川成都 610065)(2.泸州源辉农业有限公司,四川泸州 646000)
桑叶是桑科植物桑的叶子,是一种药食同源的原料,其药用价值在我国源远流长[1]。桑叶中富含多种生物活性成分,如多酚、黄酮、多糖、γ-氨基丁酸和生物碱等[2],具有抗氧化[3,4]、辅助降血糖[5,6]和降血脂[7]等功效。研究发现,桑叶中多酚、黄酮和多糖类物质具有良好的抗氧化作用。桑叶多酚和黄酮具有较强的DPPH自由基、羟自由基和超氧阴离子自由基清除能力,且与抗坏血酸较为接近[8,9]。而桑叶多糖抗氧化活性相对较弱,但其对多酚和黄酮物质的抗氧化活性具有明显增强作用[10],三者是桑叶中起到抗氧化作用的主要物质。我国桑叶资源丰富,在传统蚕桑业中,桑叶主要用来饲养家蚕或作为畜禽、鱼类的饲料,整体上用途单一,每年都有大量桑叶被废弃。开发桑叶新用途,对提高经济和社会效益、拓宽桑叶资源利用方式都具有重要意义。桑叶提取物作为一种天然功能性原料,将桑叶通过水提或醇提后干燥而成,保留了桑叶中大量的生物活性成分,可添加到普通食品或保健食品中,具有良好的应用前景[11]。
紫金蜜桑,又名台湾长果桑,其果实较长、成熟期早,是一种通过大果桑和野生长果桑授粉后改良而成的优良品种,叶片较大。目前,针对紫金蜜桑的研究相对较少,且大多集中在桑树的种植要求和栽培技术以及桑果的形态特征、营养成分和产品加工上,而对于紫金蜜桑叶的相关研究未见报道[12]。
桑叶提取物的制备采用超声波辅助乙醇提取法,可高效提取桑叶中的抗氧化活性成分。但在提取过程中,由于料液比、乙醇浓度、提取温度和提取时间的差异,桑叶提取物中活性成分含量及其抗氧化能力都会受到影响[13]。本文通过单因素和正交试验研究紫金蜜桑叶活性成分的最佳提取工艺条件,进一步对桑叶提取物的抗氧化能力进行分析,为紫金蜜桑叶在食品领域的开发和应用提供试验和理论基础。
1 材料与方法
1.1 原料
桑叶产于四川泸州,品种为紫金蜜桑,采摘于2020年7月,选取嫩度均匀、无污染、无病虫害的桑叶供试。
1.2 主要试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、Folin- Ciocalteu试剂,Sigma公司;没食子酸、芦丁,阿拉丁公司;无水乙醇、碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠、葡萄糖、苯酚、硫酸、硫酸亚铁、过氧化氢、水杨酸、邻苯三酚、Tris-HCl缓冲液、盐酸等试剂均为分析纯。
1.3 主要仪器
KQ-300VDE三频数控超声波清洗器,昆山市超声仪器有限公司;UV-1800PC紫外-可见分光光度计,上海美普达仪器有限公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;SCIENTZ-10N真空冷冻干燥机,宁波新芝生物科技股份有限公司。
1.4 方法
1.4.1 桑叶预处理
桑叶洗净沥水后去柄切条,烘干粉碎后过40目筛,得到干燥桑叶粉,备用。
1.4.2 提取方法
准确称取桑叶粉1.0 g,在一定乙醇浓度、料液比、提取温度和提取时间下进行超声波辅助乙醇提取。
1.4.3 桑叶提取物中活性成分含量测定
多酚测定参考T/AHFIA 005-2018《植物提取物及其制品中总多酚含量的测定 分光光度法》[14];黄酮测定参考DB34/T 2743-2016《槐米及其制品中总黄酮含量的测定 分光光度法》[15];多糖测定参考SN/T 4260-2015《出口植物源食品中粗多糖的测定 苯酚-硫酸法》[16]。
1.4.4 单因素试验
1.4.4.1 乙醇浓度对桑叶提取效果的影响
准确称取桑叶粉1.0 g,料液比为1:30 g/mL,提取时间为60 min,提取温度为40 ℃,乙醇浓度分别为40%、50%、60%、70%、80%和90%,在此条件下提取,测定活性成分的含量。
1.4.4.2 料液比对桑叶提取效果的影响
准确称取桑叶粉1.0 g,乙醇浓度为60%,提取时间为60 min,提取温度为40 ℃,料液比分别为1:20、1:25、1:30、1:35、1:40和1:45,在此条件下提取,测定活性成分的含量。
1.4.4.3 提取温度对桑叶提取效果的影响
准确称取桑叶粉1 g,料液比为1:30,乙醇浓度为60%,提取时间为60 min,提取温度分别为30 ℃、35 ℃、40 ℃、45 ℃、50 ℃和55 ℃,在此条件下提取,测定活性成分的含量。
1.4.4.4 提取时间对桑叶提取效果的影响
准确称取桑叶粉1.0 g,料液比为1:30,乙醇浓度为60%,提取温度为40 ℃,提取时间分别为30 min、40 min、50 min、60 min、70 min和80 min,在此条件下提取,测定活性成分的含量[17]。
1.4.5 正交试验
根据单因素试验结果,在乙醇浓度、料液比、提取温度和提取时间4因素下分别设置3水平,以多酚、黄酮和多糖含量为考察指标进行L9(34)正交试验,确定最佳提取工艺条件。因素水平设计见表1。

表1 正交试验因素水平Table 1 The design for orthogonal test of four factors at three different levels
1.4.6 提取工艺验证试验
为验证正交试验所得条件的合理性和正确性,进行3次验证试验。
1.4.7 桑叶提取物冻干粉的制备
将提取得到的桑叶提取液经旋蒸后预冻,随即放入真空冷冻干燥机中干燥48 h,取出粉碎过60目筛,得到桑叶提取物冻干粉。存于-20 ℃冰箱中,备用。
1.4.8 抗氧化实验
1.4.8.1 DPPH自由基清除实验
测定参考文献(韦献雅等,2014)所述方法[18]。
1.4.8.2 羟自由基清除实验
测定参考文献(李冠楠等,2015)所述方法[19]。
1.4.8.3 超氧阴离子自由基清除实验
测定参考文献(任尧,2011)所述方法[20]。
1.5 数据统计分析
每组试验均设置3个重复。采用Origin 8.0、SPSS v23软件进行数据分析。
2 结果与讨论
2.1 单因素试验
2.1.1 乙醇浓度对桑叶提取效果的影响
不同乙醇浓度对桑叶中多酚、黄酮和多糖的提取结果见图1。
由图1可知,随着乙醇浓度的增大,活性成分含量呈先上升后下降的趋势。当乙醇浓度为60%时,多酚和多糖含量达到最大值,分别为12.03 mg/g和55.43 mg/g;乙醇浓度为70%时,黄酮含量呈最大值,为1.60 mg/g。当乙醇浓度从60%到70%,多酚得率降低8.41%,黄酮得率提高2.56%,多糖得率降低13.42%,综合考虑浓缩干燥的成本,选择乙醇浓度为60%。

图1 乙醇浓度对桑叶提取效果的影响Fig.1 Effect of ethanol concentration on the extraction of mulberry leaf
2.1.2 料液比对桑叶提取效果的影响
不同料液比对桑叶中多酚、黄酮和多糖的提取结果见图2。
由图2可知,随着溶剂体积的增加,活性成分含量先上升后下降或基本趋于不变。当料液比为1:30 g/mL时,多酚、黄酮和多糖含量都达到最大值,分别为10.96 mg/g、1.63 mg/g和49.02 mg/g,故选择料液比为1:30 g/mL。
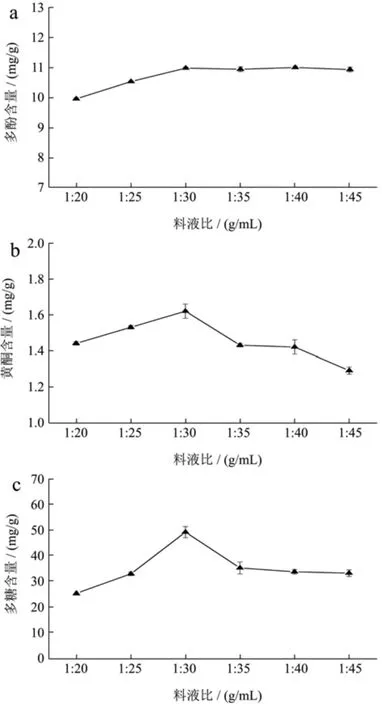
图2 料液比对桑叶提取效果的影响Fig.2 Effect of solid-liquid ratio on the extraction of mulberry leaf
2.1.3 提取温度对桑叶提取效果的影响
不同提取温度对桑叶中多酚、黄酮和多糖的提取结果见图3。


图3 提取温度对桑叶提取效果的影响Fig.3 Effect of extraction temperature on the extraction of mulberry leaf
由图3可知,随着提取温度的提高,多酚含量持续上升;黄酮和多糖含量先上升后下降,在40 ℃时达到最大值,分别为1.67和51.18 mg/g。考虑到温度上升会破坏黄酮和多糖,故选择提取温度为40 ℃。
2.1.4 提取时间对桑叶提取效果的影响
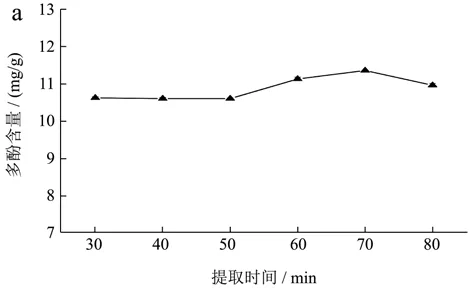
不同提取时间对桑叶中多酚、黄酮和多糖的提取结果见图4。
由图4可知,多酚含量在提取时间为70 min时达到最大值,为11.36 mg/g;黄酮含量在30~60 min基本保持不变,当时间大于60 min时,黄酮含量逐渐下降;随着时间的增加,多糖含量先升高后降低,在60 min时达最大值,为60.75 mg/g。故选择提取时间为60 min。
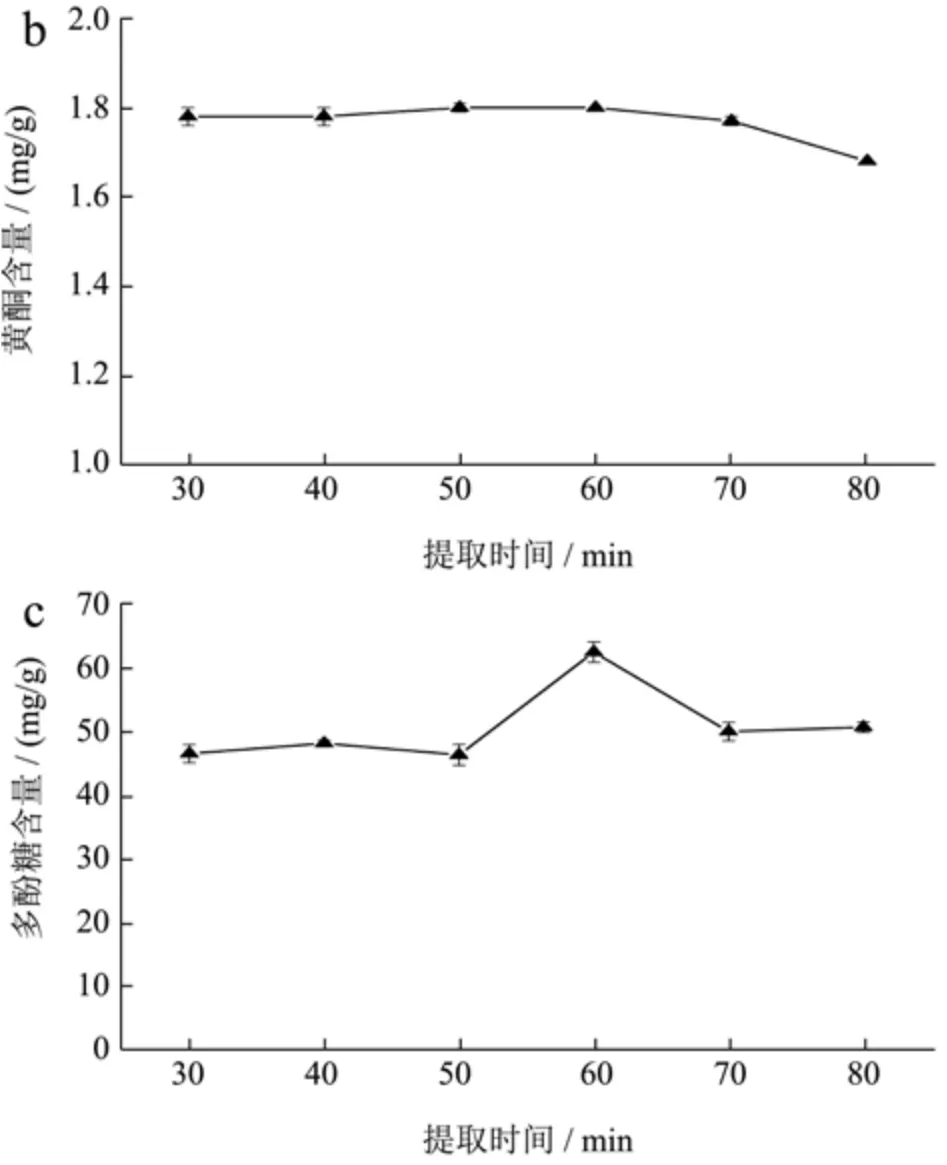
图4 提取时间对桑叶提取效果的影响Fig.4 Effect of extraction time on the extraction of mulberry leaf
2.2 正交试验
根据单因素试验结果,按照表1进行L9(34)正交试验,试验安排及结果见表4。按照多指标无空列重复试验的方差分析方法对结果进行分析,方差分析结果见表5。

表5 正交试验结果方差分析Table 5 Variance analysis of orthogonal test
由表4、5可知,影响桑叶提取物中多酚含量的主次因素为B>C>A>D,料液比对多酚含量有极显著影响,乙醇浓度和提取温度有显著影响,提取多酚的最佳工艺条件为A1B3C3D3;影响黄酮含量的主次因素为D>C>A>B,提取时间对黄酮含量有极显著影响,乙醇浓度和提取温度有显著影响,提取黄酮的最佳工艺条件为A1B3C3D3;影响多糖含量的主次因素为A>C>B>D,乙醇浓度、料液比和提取温度对多糖含量有极显著影响,提取时间有显著影响,提取多糖的最佳工艺条件为A2B2C3D3。综上,从正交优化试验可以得出紫金蜜桑叶超声波辅助乙醇提取的最佳工艺条件为A2B3C3D3,即乙醇浓度60%、料液比1:35 g/mL、提取温度45 ℃、提取时间70 min。

表4 桑叶提取工艺正交试验结果Table 4 Results of orthogonal test on extraction process of mulberry leaf
2.3 提取工艺验证试验
按最佳提取工艺条件进行3次平行试验。结果显示桑叶提取物平均得率为20.49%,多酚、黄酮和多糖的平均含量分别为12.13 mg/g、1.79 mg/g和58.74 mg/g,3组试验数据相差较小,证明正交试验优选得出的工艺条件可靠且稳定。
王瑞娴[21]研究15种桑叶的3种活性成分发现,多酚含量介于0.36 mg/g~4.26 mg/g之间,黄酮为14.39 mg/g~32.20 mg/g,多糖为10.40 mg/g~101.90 mg/g。紫金蜜桑叶在本试验优化的最佳工艺下提取的多酚含量远高于15种桑叶的最大值,多糖含量比15种桑叶平均多糖含量高28.39%。而黄酮含量较低,这可能与桑叶的生长季节有关,于小凤[22]研究发现温度对桑叶黄酮的积累有较大影响,桑叶黄酮在5月份含量较高,6月份随着气温升高开始下降,8月份含量最低;而本试验供试桑叶采自7月,此时桑叶黄酮含量下降至较低值。
2.4 抗氧化能力的测定
2.4.1 桑叶提取物对DPPH自由基清除能力的测定
桑叶提取物对DPPH自由基清除能力见图5。

图5 桑叶提取物对DPPH自由基的清除能力Fig.5 The DPPH scavenging ability of mulberry leaf extract
由图5可知,桑叶提取物浓度在0~0.2 mg/mL范围内,其DPPH自由基清除能力随浓度的增加而上升,具有明显的量效关系。当浓度为0.6 mg/mL时,清除率达到93.38%,同浓度抗坏血酸的DPPH自由基清除率为97.88%,两者相当相近。结果显示,桑叶提取物对DPPH自由基清除率的IC50为0.06 mg/mL,具有很强的DPPH自由基清除能力。
2.4.2 桑叶提取物对羟自由基清除能力的测定
桑叶提取物对羟自由基清除能力见图6。
由图6可知,桑叶提取物浓度在0~0.1 mg/mL范围内,其羟自由基清除能力随浓度的增加而上升,具有明显的量效关系。结果显示,桑叶提取物对羟自由基的IC50为3.13 mg/mL,在较高浓度时具有一定羟自由基清除能力,但弱于抗坏血酸。

图6 桑叶提取物对羟自由基的清除能力Fig.6 The ·OH scavenging ability of mulberry leaf extract
2.4.3 桑叶提取物对超氧阴离子清除能力的测定
桑叶提取物对超氧阴离子清除能力见图7。
由图7可知,桑叶提取物浓度在0~1.0 mg/mL范围内,其超氧阴离子清除能力随浓度的增加而上升,具有明显的量效关系。当浓度为1.0 mg/mL时,桑叶提取物对超氧阴离子清除率达到55.56%,此后其清除能力上升速度减缓。结果显示,桑叶提取物对超氧阴离子自由基的IC50为1.15 mg/mL,具有较高的超氧阴离子清除能力。

图7 桑叶提取物对超氧阴离子的清除能力Fig.7 The superoxide anion free radical scavenging ability of mulberry leaf extract
紫金蜜桑叶提取物对DPPH自由基、羟自由基以及超氧阴离子自由基的半数清除率(IC50)分别为0.06 mg/mL、3.13 mg/mL和1.15 mg/mL,王吉成[23]等人发现,桑叶乙醇提取物对DPPH自由基清除率的IC50为4.69 mg/ml,而其对羟自由基的清除能力较低,在实验浓度为20 mg/mL时,清除能力只有达到20%左右,远低于本试验结果。紫金蜜桑叶提取物对DPPH自由基和超氧阴离子自由基的清除能力较强,清除率接近抗坏血酸,其中多酚、黄酮和多糖对DPPH自由基和超氧阴离子自由基都有一定的清除作用;而桑叶提取物对羟自由基的清除能力相对较弱。杨世园[24]等人研究发现,多酚和黄酮类物质具有改变氧化态或烯醇式与酮式官能团互变异构的化学特性,是桑叶提取物中起到清除羟自由基作用的主要物质,而多糖类物质清除羟自由基的能力远比多酚和黄酮类物质弱[25]。这可能是造成本研究中多糖含量较多、多酚和黄酮含量较少的桑叶提取物对羟自由基的清除能力较弱的重要因素。
3 结论
本文以紫金蜜桑叶为研究对象,采用超声波辅助乙醇提取法提取桑叶抗氧化活性成分,通过单因素和正交试验优化得到最佳提取工艺条件为乙醇浓度60%、料液比1:35 g/mL、提取温度45 ℃、提取时间70 min,此条件下,紫金蜜桑叶活性成分提取率高达20.49%。在最佳提取工艺条件上制得的桑叶提取物对DPPH自由基、羟自由基以及超氧阴离子自由基的半数清除率(IC50)分别为0.06 mg/mL、3.13 mg/mL和1.15 mg/mL。超声波辅助乙醇提取制得的紫金蜜桑叶提取物含有丰富的多酚、黄酮和多糖类物质,具有较强的抗氧化能力,在功能性食品领域有着非常好的应用前景。

