夏枯草粗多糖对镉诱导肾小管上皮细胞炎症反应的调节作用
池慧钦,黎姿茵,宋佳,赖月妃,王延,杨佳妮,万宇,何志妮,卫秦芝,吴炜亮,杨杏芬
(1.南方医科大学公共卫生学院,食物安全与健康研究中心,国家药监局化妆品安全评价重点实验室,广东省热带病研究重点实验室,广东广州 510515)(2.暨南大学基础医学院公共卫生与预防医学系,广东广州 510632)
有毒重金属镉(Cadmium,Cd)是一种已知的环境污染物,能通过污染空气、食品和水等,带来许多健康风险。流行病学研究表明,镉能对许多器官产生毒性作用,引起肾脏损伤[1]、骨质疏松[2,3]、颈动脉斑块[4,5]以及癌症[6]。进入机体的镉主要在肾脏蓄积,半衰期约为10~30年[6,7],肾小管损伤是镉暴露敏感的毒性终点[8]。研究表明,氧化应激和炎症反应是镉致肾脏及其它器官损伤的重要机制[9,10]。
夏枯草(Prunella vulgarisL.,PV)属于唇形科(Labiate)夏枯草种属植物,是一种重要的药食同源草本植物,广泛分布在韩国、日本、中国、欧洲等各个地区。夏枯草具有清火明目、散结消肿等功效[11]。作为一种传统中药,夏枯草已经被用于治疗咽喉痛、甲状腺肿胀、乳腺疾病等[12]。对夏枯草的活性成分和药理作用的研究表明,夏枯草具有抗肿瘤、抗病毒、抗氧化、抗炎抗菌和免疫调节等作用[13,14]。
近年来,越来越多的人对夏枯草多糖的结构及功效进行研究。研究表明,夏枯草粗多糖不仅具有抗炎、抗氧化等作用,还具有金属螯合作用[15]。与传统的金属螯合剂相比,天然多糖因其特有的生理活性及无毒副作用而更具优势。结构方面,尹震花[16]等对夏枯草多糖的提取、结构及生理活性进行综述,发现夏枯草多糖组分主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其中木糖和阿拉伯糖含量较高。然而,目前对夏枯草多糖的结构研究较少,主要还集中在初级结构方面。
到目前为止,对于镉引起的肾毒性还未有较好的治疗方法,也未有文献报道将夏枯草用于探讨对镉诱导肾小管上皮细胞的毒性影响。因此,本研究采用肾小管上皮细胞RPTEC/TERT1来评估夏枯草粗多糖抗镉诱导肾毒性的可能潜力,探讨夏枯草粗多糖对染镉细胞炎症反应是否具有抑制作用及可能介导的通路,为夏枯草的临床应用提供一定的依据。
1 材料与方法
1.1 实验材料
夏枯草购买于广东省药材公司中药饮片厂(产品编号:X2419412)。人肾近端小管上皮细胞系RPTEC/TERT1细胞购自美国菌种保藏中心(ATCC)细胞库。
试剂:DMEM/F12培养基、胎牛血清FBS、青/链霉素、0.05% EDTA-胰酶,美国GIBCO;二甲亚砜DMSO,美国sigma;三碘-L-甲状腺素、重组人EGF、抗坏血酸、人转铁蛋白、胰岛素、前列腺素E1、氢化可的松、亚硒酸钠、碳酸氢钠,美国sigma;氯仿、无水乙醇、正丁醇,广州化学试剂厂;Cell Counting Kit-8日本DOJINDO;BCA蛋白定量试剂盒,中国碧云天;抗氧化酶SOD、CAT试剂盒购于南京建成生物工程研究所;IL-1β、IL-18、TNF-α、IL-6的ELISA试剂盒,中国联科生物。GAPDH、iκB及p65等抗体购于Cell Signaling Technology公司。
仪器:荧光倒置显微镜,德国Zeiss;全波长酶标仪,美国BioTek;超低温冰箱,美国Thermo;电子天平,德国,Sartorius;恒温水浴锅,中国上海一恒科技有限公司;全自动化学发光成像分析仪,中国上海天能科技有限公司;EVOM2跨膜电阻仪,美国世界精密仪器公司。
1.2 实验方法
1.2.1 夏枯草粗多糖提取及含糖量测定
夏枯草多糖采用水提醇沉法及Sevage法去除蛋白进行提取,具体步骤如下所述。夏枯草干穗用组织捣碎器捣成粉末。将夏枯草粉末150 g加入蒸馏水,加热煮沸2 h。将夏枯草粉末和蒸馏水以1:30的料液比加热煮沸提取2 h。4000×g离心15 min,收集上清液。滤渣再加入30倍体积的蒸馏水,再次煮沸提取2 h,离心,收集上清液,滤渣弃去。合并两次的上清液,于60 ℃减压浓缩至100 mL得到夏枯草多糖水提液。浓缩后的夏枯草水提液采用Sevage法去除蛋白杂质。水提液与去蛋白有机溶剂(氯仿及正丁醇按4:1比例混合)按1:1体积比混合,室温下摇床震荡2 h,离心取上清,重复5次后,水相和有机相间没有明显蛋白层,再次离心收集上清,得去蛋白糖液。去除蛋白质后的夏枯草溶液用蒸馏水室温下透析48 h,透析完成后,将透析液进行真空浓缩。往浓缩后的夏枯草溶液中加入3倍体积的无水乙醇混合均匀后置于4 ℃冰箱中静置24 h。60 ℃鼓风干燥去除多余的乙醇和有机物,然后经真空冷冻干燥得到夏枯草粗多糖干品。采用苯酚-硫酸法测定夏枯草粗多糖的糖含量[17],绘制葡萄糖标准曲线,得回归方程为Y=8.171X-0.009,如图1所示。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.2.2 夏枯草粗多糖样品中蛋白质、糖醛酸及总多酚含量测定
采用BCA(bicinchoninic acid,BCA)法测定夏枯草粗多糖样品中蛋白质含量[18],采用间羟基联苯法测定糖醛酸含量[19],采用福林酚法测定总多酚含量[20]。得到三个实验的标准曲线和R2分别为:Y=13.396x-0.9101,R2=0.9963;Y=0.3202x-0.0158,R2=0.9980;Y=0.5104x-0.0344,R2=0.9973。
1.2.3 细胞培养
RPTEC/TERT1细胞培养于DMEM/F12培养基中(含5 pmol/L三碘-L-甲状腺素、10 ng/mL重组人EGF、3.5 µg/mL抗坏血酸、5.0 µg/mL人转铁蛋白、5.0 µg/mL胰岛素、25 ng/mL前列腺素E1、25 ng/mL氢化可的松、8.65 ng/mL亚硒酸钠、1.2 mg/mL碳酸氢钠、0.1 mg/mL G418、100 U/mL青链霉素),置37℃、5% CO2培养箱中培养。70%~80%融合时用0.25%EDTA-胰酶消化,传代至6孔板,每孔细胞含量为106个。
1.2.4 CCK-8法测细胞存活率
在预实验的基础上,氯化镉设置剂量组0、0.625、1.25、2.5、5、10、20、40、80 µmol/L。夏枯草粗多糖提取物设计剂量组12.5、25、50、100、200、400、600、800、1000 μg/mL。RPTEC/TERT1细胞以密度4×105个/mL接种于96孔板培养至细胞分化,加入不同浓度的氯化镉或夏枯草孵育24 h。按照CCK-8试剂盒说明书测定细胞存活率。存活率/%=(处理组OD450-空白组OD450)/(对照组OD450-空白组OD450)
×100%。
1.2.5 跨膜电阻值(TEER)测定
将RPTEC/TERT1细胞以5×105/mL的密度接种于24孔Transwell小室(型号3407,美国Corning公司)中,上室加入200 μL细胞悬液,下室中加入500 μL的培养基[21]。接种后,每2 d换液,1周后改为每天换液。采用EVOM2细胞电阻仪测量TEER。
1.2.6 抗氧化酶SOD、CAT测定
收集处理后的RPTEC/TERTl细胞裂解液,根据BCA试剂盒说明书测定蛋白浓度。参照试剂盒说明书采用黄嘌呤氧化酶还原法(450 nm)检测SOD活性,钼酸铵终止法(520 nm)检测CAT活性。
1.2.7 炎症指标测定
收集夏枯草及镉处理后的细胞上清液,采用酶联免疫吸附试验法(ELISA)检测细胞上清液中IL-1β、IL-18、TNF-α、IL-6的水平。
1.2.8 Western blot检测各蛋白的表达
提取处理后的细胞蛋白根据BCA试剂盒说明书测定蛋白浓度。进行SDS-PAGE电泳,各组蛋白样品调整至等浓度(30 μL)上样,电泳条件为110 V恒压电泳。电泳结束将蛋白转移至PVDF膜上,浸润于5%脱脂牛奶中,室温封闭2 h。加入一抗(GAPDH稀释比1:3000,p-iκB及p-p65稀释比1:1000)4 ℃孵育过夜后,TBST洗膜。二抗(羊抗鼠IgG抗体,体积稀释比1:1000)室温孵育2 h,TBST洗膜。于全自动化学发光成像分析仪中进行显影。使用 Image J 软件完成条带的灰度分析各蛋白的相对表达量。
1.2.9 统计学方法
统计学分析:采用SPSS 20.0进行统计分析,图表绘制采用GraphPad Prism 7软件,用四参数回归法计算氯化镉暴露对RPTEC/TERT1细胞的IC50值,用t检验或方差分析进行差异性分析,组间差异的两两比较采用Dunnett-t法,以p<0.05为差异有统计学意义。
2 结果与讨论
2.1 夏枯草粗多糖提取结果
热水浸提法是目前夏枯草多糖提取的主要方法[22]。本研究经热水浸提、Sevage法去蛋白及乙醇沉淀后得到夏枯草粗多糖提取物,经计算提取率为3.33%。本研究采用苯酚硫酸法测定多糖含量,根据回归方程Y=8.171X-0.009,计算得夏枯草粗多糖样品中的含糖率为65.00%。因此,本研究的夏枯草多糖提取率为2.14%。孔思远[23]等对夏枯草多糖提取工艺进行优化,以多糖含量和浸膏得率为指标,得到最优水提工艺下(第1次加水14倍,第2、3次加水12倍,提取3次,每次提取时间1.5 h)夏枯草多糖提取率为1.87%,略低于本研究结果。熊双丽等[24]采用热水浸提法提取夏枯草多糖,探索出最优工艺条件为提取温度90 ℃,时间4 h,料液比1:35,在此条件下提取率达到5.39%,高于本研究结果。由此可见,夏枯草的多糖提取率可因提取工艺不同而呈现较大的差异。
本研究对夏枯草粗多糖样品中的蛋白质、糖醛酸、总多酚含量进行测定,计算得该样品中的蛋白质含量为24.30%,糖醛酸含量为3.59%,总多酚含量为2.21%。张霞[25]等利用分级醇沉法得到夏枯草多糖的六个多糖组分,并测定了各组分的糖含量、糖醛酸含量及蛋白质含量。结果显示,六个组分的含糖量在21.02%~65.04%之间,糖醛酸含量在13.02%~30.90%之间,蛋白质含量在15.40%~22.25%之间。该研究结果与本研究结果较为相似,但本研究结果的糖醛酸含量明显低于张霞等的研究结果。在另一篇文献中[26],该课题组测定了上述六种组分中其中四种组分的体外抗氧化性,结果表明,上述组分对二苯代苦味肼基自由基(DPPH∙)的清除效率全部在87.71%以上。本研究中的夏枯草粗多糖样品中含糖量较高,而多酚含量仅占2.21%,表明提取的粗多糖样品可用于体外抗氧化性及抗炎活性的研究。
2.2 RPTEC/TERT1细胞具有良好的肾小管上皮细胞的结构和功能
多项研究表明[27-29],RPTEC/TERT1 细胞保留了人体内肾小管上皮细胞的形态和功能特点,具有丰富的转运蛋白和代谢酶,是药理学和生理学体外研究的有力工具。如图2所示,RPTEC/TERT1细胞能够形成特有的圆顶结构(图2a),分化良好。细胞于第8 d左右达到150~200 Ω*cm2之间,并稳定在该范围,说明该细胞的屏障功能及紧密性良好。以上结果表明,RPTEC/TERT1细胞具有良好的肾近端小管上皮细胞的结构和功能,可用于后续实验。

图2 RPTEC/TERT1细胞的形态及功能指标Fig.2 Characterization of morphology and function markers of RPTEC/TERT1
2.3 镉暴露及夏枯草粗多糖对RPTEC/TERT1细胞活力的影响
将0、0.625、1.25、2.5、5、10、20、40、80 μmol/L的氯化镉处理RPTEC/TERT1细胞24 h后,RPTEC/TERT1细胞活力如图2所示。结果显示,自10 μmol/L剂量组开始,氯化镉能够显著抑制RPTEC/TERT1细胞活性,且呈剂量依赖性。三次重复实验得到其IC50值为15.2 μmol/L。Tomasz等人对镉的促炎作用进行综述,结果显示微摩尔浓度范围(1~10 μmol/L)的镉即能表现出促炎特性[30]。因此,结合本研究的结果,后续实验选择8 μmol/L剂量的氯化镉(约二分之一的IC50值)作为镉诱导RPTEC/TERT1炎症模型组。
将12.5、25、50、100、200、400、600、800、1000 μg/mL的夏枯草粗多糖处理RPTEC/TERT1细胞24 h后,RPTEC/TERT1细胞活力如图3所示。结果显示,夏枯草粗多糖剂量为400 μg/mL时,RPTEC/TERT1细胞的活力出现下降的趋势(p<0.01)。因此,选择50、100、200 μg/mL的夏枯草粗多糖进行后续研究。

图3 不同浓度的氯化镉及夏枯草粗多糖对RPTEC/TERT1细胞活力的影响Fig.3 Effects of the different concentrations of cadmiumchloride and PVCP on RPTEC/TERT1 cell viability (±s, n=3)
2.4 夏枯草粗多糖对镉暴露致RPTEC/TERT1细胞形态的影响
将50、100、200 μg/mL夏枯草粗多糖作用于细胞2 h后使用8 μmol/L氯化镉继续处理细胞24 h,结果如图4所示,氯化镉处理组的细胞明显皱缩、变圆。通过100、200 μg/mL夏枯草粗多糖预处理的细胞形态与对照组接近。由此可见,夏枯草粗多糖能有效减轻镉对RPTEC/TERT1细胞的损伤作用。

图4 夏枯草粗多糖对镉暴露致RPTEC/TERT1细胞形态的影响Fig.4 Effects of PVCP on morphology of RPTEC/TERT1 cells induced by cadmium (×100, n=3)
2.5 夏枯草粗多糖拮抗镉对RPTEC/TERT1细胞CAT及SOD酶活性的抑制作用
多项研究表明,镉能促进自由基产生,引起肾脏氧化应激,该机制是镉介导毒性的重要机制之一[10,31]。本研究结果显示(图5),模型组(8 μmol/L)细胞内SOD及CAT酶活性显著低于对照组(p<0.01),表明镉引起RPTEC/TERT1细胞内的氧化损伤。Abdullah等人[32]的研究发现镉作用的大鼠体内SOD、CAT活力显著下降,总抗氧化水平降低导致全身氧化应激,且血浆中IL-6、TNF-α浓度显著升高。该作者还指出,镉诱导的氧化应激与其促炎活性密切相关。

图5 夏枯草粗多糖对镉暴露致RPTEC/TERT1细胞CAT及SOD的影响Fig.5 Effects of PVCP on activities of CAT and SOD of RPTEC/TERT1 cells induced by cadmium (±s, n=3)
研究显示,夏枯草茎叶和果穗水提物均表现出一定的抗氧化及抗炎作用[33]。本研究细胞经50 μg/mL及以上浓度的夏枯草粗多糖处理后,细胞内SOD及CAT酶活性较镉处理组升高(p<0.01),说明夏枯草多糖可以提高RPTEC/TERT1细胞中SOD及CAT的酶活性,提高细胞的抗氧化能力。熊双丽[24]等对夏枯草多糖的自由基清除能力及抗氧化活性进行研究,结果表明,夏枯草多糖对羟自由基(∙OH)和二苯代苦味肼基自由基(DPPH∙)具有直接清除作用。其中,当夏枯草多糖浓度为0.8 mg/mL时,羟基自由基清除率高达96.25%。张淼[34]的研究表明,夏枯草多糖含量与∙OH、O2-∙、DPPH∙及金属螯合能力成正相关关系,相关系数在0.55~0.71之间,说明夏枯草多糖在夏枯草抗氧化功能中发挥较大作用。近年来国内外研究表明,植物多糖的清除自由基机制类似于SOD酶的作用[35]。结合本研究结果,夏枯草多糖可能通过提高RPTEC/ TERT1细胞内的SOD及CAT的酶活性,从而抑制自由基的产生,达到抗氧化的目的;或直接发挥类抗氧化物酶的作用而降低细胞内的自由基,从而发挥抗氧化的作用。
2.6 夏枯草粗多糖拮抗镉对RPTEC/TERT1细胞炎症因子分泌的促进作用
白细胞介素(interleukin,IL)是免疫调节、炎症反应中的重要介质。TNF-α主要来源于巨噬细胞,因细菌感染或其它免疫源反应而产生。研究表明,TNF-α、IL-1β、IL-6可作为与镉相关的促炎症细胞因子[36]。近期多项研究表明,IL-18作为一种促炎症细胞因子,可作为急性肾损伤,尤其是肾小管损伤的早期生物标志物[37,38]。本研究结果如图6所示,镉处理组(8 μmol/L)引起RPTEC/TERT1细胞炎症因子IL-6、IL-1β、IL-18及TNF-α表达水平分别升高了9.53倍、8.80倍、10.86倍和1.17倍(p<0.01),说明镉可引起RPTEC/TERT1细胞炎症反应。
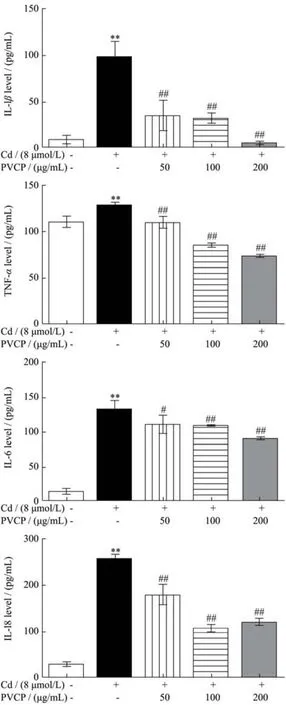
图6 夏枯草粗多糖对镉暴露致RPTEC/TERT1细胞炎症因子的影响Fig.6 Effects of PVCP on the expression of inflammatory factors of RPTEC/TERT1 cells induced by cadmium (±s,n=3)
与模型组相比,夏枯草粗多糖预处理组(50、100、200 μg/mL)RPTEC/TERT1细胞炎症因子IL-1β、IL-18、TNF-α、IL-6分泌量明显降低(p<0.01),说明夏枯草粗多糖预处理具有拮抗镉诱导的RPTEC/ TERT1细胞炎症的作用。Seung等人[39]在肾损伤大鼠模型中观察到夏枯草水提物能显著抑制炎症反应且对肾纤维化具有重要的保护作用。李超的研究[15]通过热水浸提法并经离子交换柱层析分离得到一种中性多糖PV-P1、两种酸性多糖,PV-P2及PV-P3。构效研究表明三种成分均具有抗氧化和免疫活性。其中,PV-P2及PV-P3的抗氧化能力最强,能清除DPPH∙、HOO自由基等,而PV-P1的免疫活性最强,能够抑制小鼠巨噬细胞分泌TNF-α、IL-6等炎症因子,发挥抗炎作用。然而,还未有文献报道夏枯草多糖在体外拮抗镉诱导的肾脏细胞炎症反应。本文结果已经提示夏枯草粗多糖对镉诱导的RPTEC/TERT1细胞炎症反应具有保护作用,后续需进一步探讨夏枯草多糖中何种成分发挥效应。
2.7 夏枯草粗多糖拮抗镉对NF-κB信号通路关键蛋白的激活作用

图7 夏枯草粗多糖对RPTEC/TERT1细胞NF-κB信号通路中相关蛋白的影响Fig.7 Effects of PVCP on the related proteins of NF-κB signaling pathway of RPTEC/TERT1 cells induced by cadmium (±s, n=3)
研究表明,夏枯草的变种紫丁香在体外即具有抗炎活性,能通过NF-κB信号通路抑制脂多糖诱导巨噬细胞的炎症反应[12]。NF-κB是一种作用广泛的转录调节因子,在机体免疫、炎症反应、细胞凋亡、细胞周期调控等方面发挥重要的作用[40]。NF-κB的信号传导始于诱导物的活化作用,随后NF-κB与其抑制蛋白IκB解离,p65-p50异二聚体转移入核,与DNA上的特定位点结合,进而调控细胞因子、趋化因子、转录因子以及氧化应激相关酶等基因的转录和表达[41]。本研究结果显示,镉处理组(8 μmol/L)RPTEC/TERT1细胞内NF-κB信号通路关键蛋白p-iκB及p-p65的表达均显著高于对照组(p<0.05)。但经100及200 μg/mL夏枯草粗多糖预处理后,p-iκB及p-p65的蛋白表达均显著低于镉染毒组(p<0.05),200 μg/mL作用最为明显。结果表明,镉暴露能显著激活RPTEC/TERT1细胞胞质内iκB及p65的表达,而夏枯草粗多糖则可抑制该效果。研究显示,抗氧化剂及抗氧化物酶的过表达可以抑制NF-κB信号通路的激活[42]。结合本研究结果,夏枯草粗多糖可能通过下调SOD、CAT酶活力抑制NF-κB信号通路激活,继而削弱镉诱导的RPTEC/TERT1细胞炎症反应,相关内容有待进一步验证。
3 结论
本研究以镉染毒RPTEC/TERT1细胞作为研究对象,探讨夏枯草粗多糖对镉染毒的RPTEC/TERT1细胞的影响,结果显示夏枯草粗多糖对镉染毒RPTEC/TERT1细胞有明显的保护作用,可拮抗镉抑制RPTEC/TERT1细胞CAT及SOD酶活性以发挥抗氧化功能,且能够有效抑制RPTEC/TERT1细胞炎症因子IL-1β、IL-6、TNF-α及IL-18的释放。夏枯草粗多糖能改善镉诱导的 RPTEC/TERT1细胞炎症反应,该效应可能与其抗氧化能力及通过NF-κB信号通路抑制细胞因子的分泌有关。作为一种药食同源的中草药,夏枯草具有深远的研究价值。由于夏枯草多糖具有的抗炎抗氧活性以及金属螯合性,其可能成为治疗镉致肾毒性的潜在药物。

