SFRP1/Wnt/β-catenin通路在宫颈癌干细胞中的作用
吴琳 张科 祖珍玉 陈洁 毛聿华 罗敏
1南方医科大学第一临床医学院(广州510515);2中国人民解放军南部战区总医院妇产科(广州510000)
宫颈癌是全球第四大最常见女性恶性肿瘤[1],其常规治疗为手术结合放化疗,但部分患者对治疗存在抵抗能力,治疗后仍出现复发转移的情况。肿瘤干细胞被认为是恶性肿瘤转移及复发的种子细胞[2-3]。针对宫颈癌干细胞的研究能更精准靶向肿瘤转移复发的种子细胞,从而改善难治性宫颈癌患者的预后情况。
分泌型卷曲相关蛋白1(secreted frizzled related protein l,SFRPl)在结构上与FZ 受体极为相似,可通过竞争性结合Wnt 分子或Fz 受体而直接抑制Wnt 通路[4-5],SFRP1 在多种肿瘤组织(乳腺癌[6]、肾细胞癌[7]、结肠癌[8]、膀胱癌[9]等)中低表达,可抑制肿瘤的发生发展。Wnt 通路下游目的基因(如C-myc、CyclinD1 等)参与细胞生存、增殖和分化[10-11],Wnt/β-catenin 通路在肿瘤中发挥维持肿瘤干细胞干性、诱导肿瘤细胞上皮间质转化,促进肿瘤细胞增殖、迁移等作用[12-13]。因此,SFRP1 可抑制Wnt/β-catenin 通路的激活,阻断Wnt/β-catenin通路促进肿瘤干细胞发挥功能的作用。
有研究[14-15]发现SFRP1 在正常宫颈组织中表达明显高于宫颈癌组织,敲除SFRP1 后,宫颈癌细胞具有更强的肿瘤恶性表型。但SFRP1 在宫颈癌干细胞中的表达情况及其如何调控Wnt 信号影响宫颈癌干细胞的功能尚不明确。故本研究通过体内外功能实验验证侧群干细胞(side population cell,SP)具有肿瘤干细胞的能力;同时检测SFRP1及Wnt 通路关键蛋白的表达及SFRP1 的表达水平,初步探讨宫颈癌干细胞中SFRP1 对Wnt 通路的调控作用,为确定宫颈癌干细胞的治疗靶点提供实验基础。
1 材料与方法
1.1 材料来源人宫颈癌SiHa 细胞系,由中国科学院上海生命科学研究院细胞资源中心提供。无特定病原体(SPF)级BALB/c 裸鼠由广东省医学实验动物中心提供,共10 只,4 ~5 周龄,雌性,体重为18 ~20 g。
1.2 主要试剂CCK8 试剂盒、Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基;EdU-594细胞增殖检测试剂盒购自上海碧云天;顺铂、紫杉醇为美国Abmole 公司产品;维拉帕米盐酸盐为美国Sigma Aldrich 公司产品;抗体SFRP1、β-catenin、C-myc、CyclinD1、β-actin 均购自美国proteintech 公司,二抗购自弗德生物。
1.3 细胞分组及处理将SP细胞及非侧群干细胞(non side population cell,NSP)接种于培养板内,待细胞处于对数生长期时,弃去旧培养基后PBS 洗涤后,加入无血清肿瘤干细胞培养基刺激24 h,分为空白对照组、紫杉醇组、顺铂组、放疗组。其中空白对照组为后续不予处理;紫杉醇组为加入紫杉醇(2.5 nmol/L)处理48 h;顺铂组为加入顺铂(50 mol/L)处理48 h;放疗组为经直线加速放射线照射相应剂量射线后48 h。
1.4 流式分选侧群干细胞制备SiHa 细胞的单细胞悬液,将细胞浓度调整为1 × 106/mL,预热细胞至37 ℃后分为两组。实验组及对照组均加入Hoechst33342 5 g/mL,37 ℃水浴中避光标记90 min。同时对照组中加入维拉帕米50 mol/mL。标记后于冰浴中终止染色,预冷PBS 洗涤2 次。再向两组中加入PI,随后上机分选。
1.5 EDU 法检测细胞增殖水平将各组细胞接种于96 孔板中,1 000/孔,处理后,10 mol/L EDU 染色孵育2 h;取出进行洗涤、固定、通透,按照说明书配制Click 反应溶液进行Click 点击反应,再次洗涤后用hoechst33342 染细胞核,倒置荧光显微镜下观察拍照。
1.6 平板克隆实验检测细胞的克隆形成能力将各组细胞接种于6 孔板中,接种细胞数目为50 ~3 000/孔,处理后,继续培养,4 d 更换一次培养基,接种14 d 后,洗涤、固定、染色,随后用数码照相机拍照。
1.7 动物实验将10 只裸鼠随机分为两组,每组5 只,在裸鼠5 周龄时,将SP 及NSP 细胞的密度调整至1 × 107/mL,每只裸鼠腹股沟皮下接种肿瘤细胞0.1 mL,接种后定期观察裸鼠,待触摸到实体瘤形成后,每7 天测量1 次,并记录移植瘤的最长径(L)和最短径(W),计算肿瘤体积,肿瘤体积=L×W2/2,绘制裸鼠移植瘤生长曲线,在接种第35 天处死裸鼠,剥除移植瘤,测量移植瘤大小并称重。
1.8 蛋白印迹法(WB)检测细胞蛋白的表达提取各组细胞的蛋白并测定蛋白浓度;按照30 g 蛋白上样,电泳转膜后,5%脱脂奶粉室温封闭1 h,相应抗体4 ℃孵育过夜;次日洗涤后二抗室温孵育1 h 后再次洗涤;运用增强化学发光法的发光液显影,以β-actin 作为内参照,凝胶成像系统拍照。
1.9 酶联免疫吸附实验(ELISA)检测细胞分泌SFRP1 水平加入标准品或样品后37 ℃孵育2 h;弃去液体,加生物素标记抗体工作液,37 ℃孵育1 h;洗板后加HRP 标记亲和素工作液,37 ℃孵育1 h;洗板后加底物溶液,37 ℃孵育15 min;加终止液,终止反应5 min 内用酶标仪检测450 nm 波长处的光密度值。
1.10 免疫荧光检测β-catenin的表达及细胞亚定位情况取出样品,洗涤后4%多聚甲醛固定15 min;洗涤后0.3%TritonX-100通透10 min,洗涤后山羊血清封闭液封闭60 min;加入一抗4 ℃孵育过夜。次日洗涤后加入荧光染料标记的二抗避光孵育90 min;洗涤后DAPI 核染色剂避光孵育10 min,洗涤后加入防荧光淬灭剂。荧光显微镜下观察拍照。
1.11 统计学方法采用SPSS 22.0 软件进行统计学分析。计量资料经正态性检验符合正态分布,以均数±标准差表示,比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 流式分选SP 细胞和NSP 细胞在Hoechst Red-Hoechst Blue 散点图中,标记Hoechst33342 后,细胞呈现“鹰头”形状,鹰头的“鹰嘴”部分代表SP细胞(图1)。

图1 流式分选SiHa 细胞中的SP 细胞和NSP 细胞Fig.1 Flow cytometric separation of SP cells and NSP cells in SiHa cells
2.2 SP及NSP细胞体内外功能比较EDU实验证实SP 细胞的增殖率高于NSP 细胞[(22 ± 1)%vs.(13±3)%,P=0.017 1,图2A、B];克隆形成实验发现SP 细胞的克隆形成率高于NSP 细胞[(51±7)%vs.(9±6)%,P=0.010 1,图2C、D];无血清成球实验在第2 天可见细胞分裂,有成球的趋势,随后细胞球逐渐长大,至第10 天可见折光度好、中间密度高的致密球,发现SP 细胞的成球能力强于NSP细胞(图2E)。SP 细胞的裸鼠皮下肿瘤生长速度明显快于NSP,剥离肿瘤组织后测量其肿瘤重量,发现SP 细胞的肿瘤重量明显重于NSP 细胞所形成的肿瘤[(913.6 ± 137.3)mgvs.(307.2 ± 36.5)mg,P=0.002 7,图3]。

图3 SP 细胞的裸鼠皮下成瘤能力明显强于NSP 细胞Fig.3 The ability of SP cells to form subcutaneous tumors in nude mice in vivo is significantly stronger than that of NSP cells
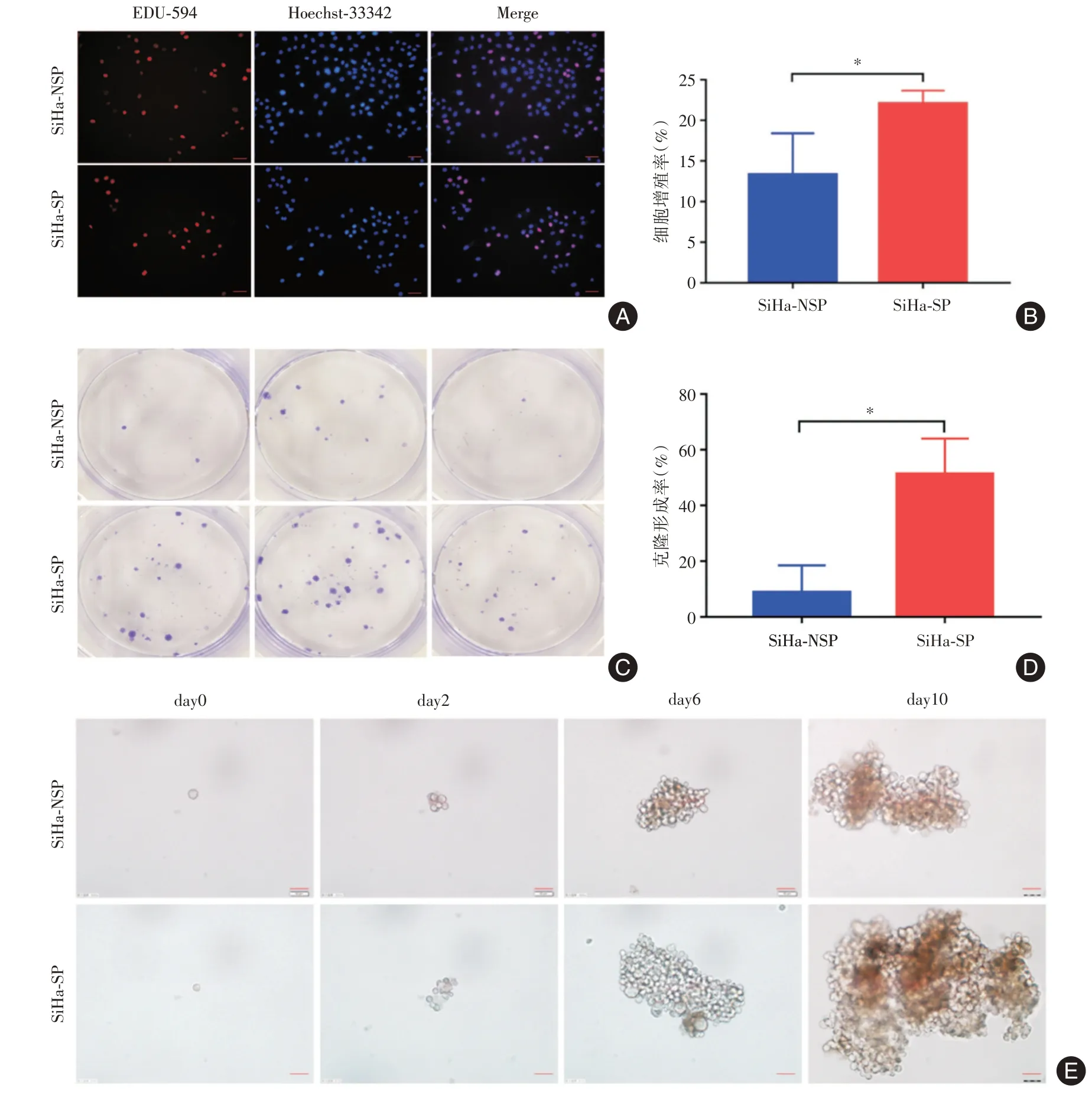
图2 SP 细胞增殖、克隆及成球能力强于NSP 细胞Fig.2 SP cells have stronger proliferation,cloning and spheronization ability than NSP cells
2.3 SP 和NSP 细胞的干性标志物表达比较WB发现在运用条件培养基刺激24 h 之后的SP 细胞中CD133、CD44、Nanog 的表达均强于NSP 细胞,而使用完全培养基培养时,SP 细胞与NSP 细胞在三个分子表达量上无明显差异(图4)。
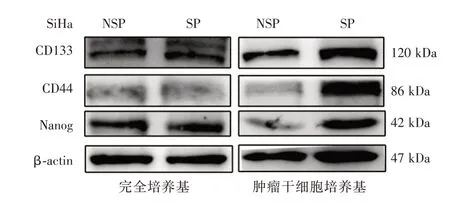
图4 SP 细胞及NSP 细胞的干性标志物表达情况Fig.4 The expression of stemness markers in SP cells and NSP cells
2.4 放化疗条件下SP 和NSP 细胞的增殖及克隆形成能力比较根据EDU 实验结果,用紫杉醇(2.5 nmol/L)、顺铂(50 μmol/L)、放射剂量8 Gy 处理时,SP 细胞的增殖率分别为(22±1)%、(62±2)%、(20±4)%,NSP 细胞增殖率分别为(13±3)%、(17± 9)%、(5 ± 1)%,经过统计分析后,不同处理组SP 细胞及NSP 细胞的增殖率差异均有统计学意义(均P<0.001)。见图5。平板克隆形成实验提示在经过2、4、6、8 Gy放射剂量照射后,SP细胞的克隆形成率分别为(20 ± 3)%、(7 ± 1)%、(19.7 ± 1.9)‰、(5.2 ± 0.1)‰,而NSP 细胞的克隆形成率分别为(10±1)%、(2±0.3)%、(5.8±0.5)‰、(1.9±0.3)‰,经过统计分析后,发现在不同放射剂量照射后,SP细胞的克隆形成能力均明显强于NSP 细胞(均P<0.005)。见图6。

图6 放疗时宫颈癌干细胞的克隆形成能力明显强于非宫颈癌干细胞Fig.6 During radiotherapy,the cloning ability of cervical cancer stem cells is significantly stronger than that of non-cervical cancer stem cells

图5 放化疗条件下SP 细胞与NSP 细胞增殖能力变化Fig.5 Changes in the proliferation ability of SP cells and NSP cells under radiotherapy and chemotherapy
2.5 SFRP1 在细胞内外的水平WB 提示SFRP1在SP 细胞明显高于NSP 细胞(图7);ELISA 发现SiHa-NSP 细胞的SFRP1 蛋白分泌水平明显高于SiHa-SP 细胞[(66.47±3.60)pg/mLvs.(6.75±0.45)pg/mL,P<0.000 1),说明细胞内的SFRP1表达水平与SFRP1 的分泌并不呈现正相关的关系。
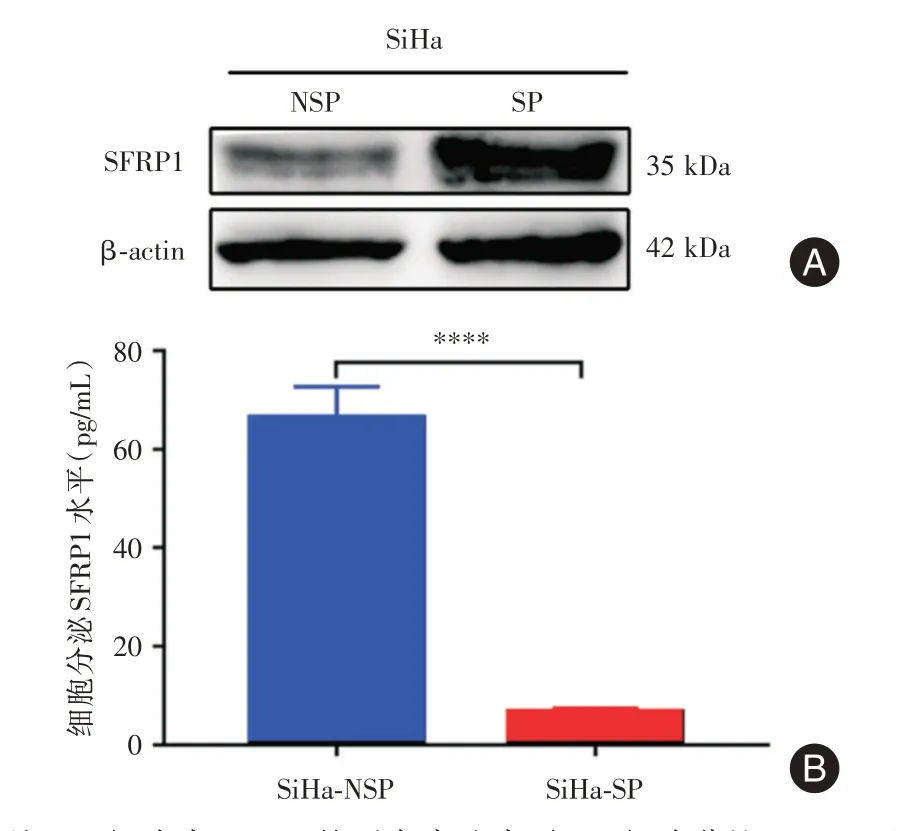
图7 SP 细胞及NSP 细胞SFRP1 在细胞内外的水平Fig.7 The levels of SFRP1 in SP cells and NSP cells inside and outside the cell
2.6 Wnt/β-catenin 通路激活情况WB 结果显示β-catenin、C-myc、Cyclin D1 在SP 细胞中的表达水平均高于NSP 细胞;免疫荧光发现Wnt 通路发挥关键作用的β-catenin 在SP 细胞中主要表达于细胞质及细胞核内,而在NSP 细胞的β-catenin 主要表达在细胞质(图8)。

图8 SP 细胞中Wnt/β-catenin 通路明显激活Fig.8 Wnt/β-catenin signaling pathway is obviously activated in SP cells
3 讨论
难治性宫颈癌在经过常规治疗后仍易出现转移及复发等预后不良的情形,完成同步放化疗后,局部晚期宫颈癌妇女的5年总存活率约为70%,而仅限于子宫颈或上阴道的复发性宫颈癌是可能治愈的[2]。肿瘤干细胞学说认为宫颈癌干细胞是肿瘤转移及复发的种子细胞[2]。根据运用流式分选从细胞株中分离出SP 细胞的方法[16],本研究从宫颈癌细胞中分选出的SP 细胞经过无血清培养基刺激后,从体内外功能、分子生物学多角度验证了其干细胞特性。
本研究对SP 细胞及NSP 细胞在经过放射或化疗药物的处理后,SP 细胞具有更明显的恶性表型,说明宫颈癌干细胞对放化疗的抵抗能力强于非宫颈癌干细胞,与前人研究结果一致[17-18]。宫颈癌干细胞不能被常规治疗完全消灭,继而导致肿瘤转移复发,因此,进一步研究其具体机制对于改善难治性宫颈癌患者预后具有重要意义。
SFRP1 在宫颈癌组织中的表达明显低于正常宫颈组织[14],敲低SFRP1 的表达后,Wnt 通路促进宫颈癌的进展[15]。但本研究却发现SP 细胞中Wnt/β-catenin 通路与SFRP1 的表达趋势具有一致性。为了明确其中的原因,结合细胞分泌SFRP1阻碍Wnt与FZ受体结合,从而阻断Wnt/β-catenin通路激活这一现象[19],本研究发现SP 细胞的SFRP1分泌水平明显低于NSP 细胞,由此得出SP 细胞的SFRP1 分泌水平下降,可能解除其对Wnt/β-catenin通路的抑制作用,促进Wnt/β-catenin 通路激活。
综上所述,宫颈癌干细胞可能通过抑制SFRP1分泌来促进Wnt/β-catenin 通路激活宫颈癌干细胞的功能,使其具有更强的增殖、克隆形成、放化疗抵抗及皮下成瘤能力。因此,进一步探讨SFRP1对于宫颈癌干细胞的具体作用,需观察SFRP1 基因过表达或沉默后,宫颈癌干细胞的体内外生物学行为变化;阐明宫颈癌干细胞中抑制SFRP1 分泌至细胞外的具体机制,由此设计相关靶向药物达到抑制宫颈癌干细胞的作用。

