注射用小牛血去蛋白提取物联合胞二磷胆碱治疗急性脑出血的效果
苏俊花
(宁陵县人民医院 神经内科,河南 商丘 476700)
脑出血为临床常见的脑血管疾病,其发病率占全部脑卒中的20%~30%,急性期病死率达30%~40%,严重威胁人类生命健康[1]。胞二磷胆碱(citicoline,CC)为临床治疗急性脑出血(acute intracerebral hemorrhage,AICH)的常用药物,但整体治疗效果有待提升。近年来,注射用小牛血去蛋白提取物(deproteinized calf blood extratives for injection,DCBEI)逐渐应用于脑血管疾病治疗中,在改善脑部血液循环、促进神经功能修复方面具有良好效果。基于此,本研究选取86例AICH患者,旨在探究DCBEI联合CC的治疗效果。报告如下。
1 资料与方法
1.1 一般资料选取2017年8月至2019年5月宁陵县人民医院收治的86例AICH患者,根据治疗方案分为对照组(n=43)和研究组(n=43)。对照组女17例,男26例;年龄53~76岁,平均(61.38±4.18)岁;合并症高血压38例,糖尿病12例,高脂血症16例;出血部位基底节区29例,丘脑区10例,脑叶部4例。研究组女19例,男24例;年龄55~78岁,平均(62.51±3.75)岁;合并症高血压39例,糖尿病15例,高脂血症18例;出血部位基底节区31例,丘脑区9例,脑叶部3例。两组一般资料比较,差异无统计学意义(P>0.05)。本研究经宁陵县人民医院医学伦理委员会审批通过。
1.2 选取标准
1.2.1纳入标准 (1)符合AICH诊断标准[2];(2)首次发病;(3)发病至入院时间<24 h;(4)对本研究药物无过敏;(5)患者及家属对本研究知情,签署同意书。
1.2.2排除标准 (1)有精神疾病史;(2)合并严重心、肺、肝、肾功能障碍;(3)合并全身感染性疾病;(4)不能配合完成研究。
1.3 治疗方法
1.3.1对照组 接受CC(大理药业股份有限公司,国药准字H53020287)治疗,1.0 g CC与250 mL生理盐水,静脉滴注,每天1次。
1.3.2研究组 接受DCBEI(哈尔滨圣泰生物制药有限公司,国药准字H20051009)联合CC治疗。CC用法用量同对照组。1.2 g DCBEI与250 mL生理盐水静脉滴注,每天1次。两组均持续治疗2周。
1.4 观察指标
1.4.1治疗效果 治疗2周后评估两组治疗效果,评估标准如下。临床治愈,即运动、语言障碍等临床体征基本消失,美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分降低>90%;显效,即临床体征明显改善,NIHSS评分降低46%~90%;有效,即临床体征减轻,NIHSS评分降低18%~45%;无效,即未达以上标准。总有效率为显效率、临床治愈率与有效率之和。NIHSS总分42分,对应分值越高,神经功能缺损越严重。
1.4.2意识障碍严重程度 采用格拉斯哥昏迷量表评分(Glasgow coma scale,GCS)评估患者意识障碍程度,总分15分,对应分值越低,意识障碍越严重。
1.4.3相对脑水肿体积及SOD、IL-1β水平 采用西门子Magnetom Symphony 1.5 T磁共振成像系统进行头颅MR检查,测量患者各时间段相对脑水肿体积;采集患者各时间段外周静脉血3 mL,离心处理取血清,选取血清超氧化物歧化酶(superoxide dismutase,SOD)以黄嘌呤氧化酶法检测,血清白细胞介素(interleukin,IL)-1β水平以酶联免疫吸附试验检测。SOD、IL-1β检测试剂盒分别购自上海纪宁生物科技有限公司、上海华美生物工程公司。
1.4.4记录两组不良反应发生情况。

2 结果
2.1 疗效研究组治疗总有效率(95.35%)较对照组(76.74%)高,差异具有统计学意义(P<0.05)。见表1。
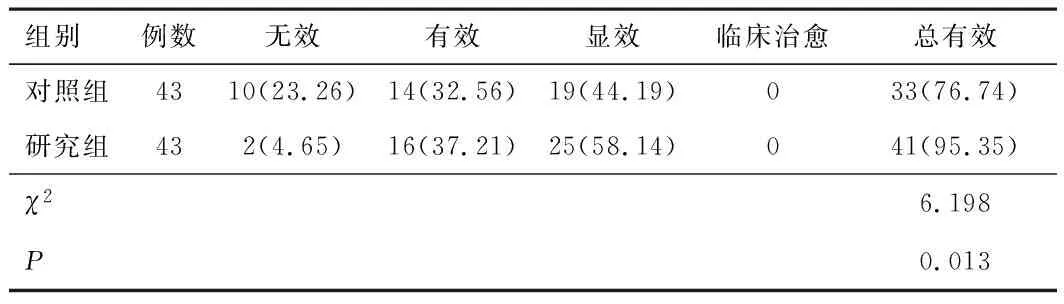
表1 两组疗效对比[n(%)]
2.2 NIHSS、GCS评分及相对脑水肿体积治疗前,两组NIHSS、GCS评分及相对脑水肿体积比较,差异无统计学意义(P>0.05);治疗2周后,两组NIHSS评分、相对脑水肿体积均较治疗前降低,且研究组较对照组低,GCS评分均较治疗前升高,且研究组较对照组高,差异具有统计学意义(P<0.05)。见表2。
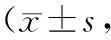
表2 治疗前后两组NIHSS、GCS评分及相对脑水肿体积比较分)
2.3 血清SOD、IL-1β水平治疗前,两组血清SOD、IL-1β水平比较,差异无统计学意义(P>0.05);治疗2周后,两组血清SOD水平均升高,且研究组高于对照组,血清IL-1β水平均降低,且研究组低于对照组,差异具有统计学意义(P<0.05)。见表3。
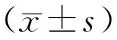
表3 治疗前后两组血清SOD、IL-1β水平比较
2.4 不良反应发生情况两组均无恶心、呕吐、皮疹及肝、肾功能损伤等不良反应的发生。
3 讨论
脑出血发病与高脂血症、糖尿病、高血压、血管老化等具有密切关系,随着医疗技术水平的提高,脑出血病死率得到一定控制,但致残率仍居高不下[3]。CC作为脑血管疾病治疗的常用药物,可有效减轻血脑屏障损伤,维护脑细胞膜功能,在保护脑细胞、改善神经功能方面具有良好效果[4]。但单独使用CC治疗AICH的效果仍不尽理想。DCBEI为脑代谢改善及促智药,主要成分为小分子激活肽、磷酸肌醇寡糖等。其中磷酸肌醇寡糖可提高脑代谢储备能力,保护脑细胞,小分子激活肽则能促进神经细胞的再生、修复[5]。本研究将DCBEI与CC联合应用于AICH患者,治疗2周后发现,研究组治疗总有效率高达95.35%,高于对照组76.74%,且研究组NIHSS评分、相对脑水肿体积低于对照组,GCS评分高于对照组。两种药物联合治疗AICH患者,能提高疗效,改善神经功能缺损,减轻意识障碍。DCBEI可改善脑部血液循环、促进神经功能修复,与CC联合互为补充,增强疗效,可改善患者预后。本研究中联合治疗在调节血清SOD、IL-1β水平方面具有优势。SOD是反映氧化应激程度的标志物,作为一种抗氧化酶,SOD具有高效清除机体内氧自由基的作用,其表达水平升高提示机体氧化应激反应减轻[6]。有研究指出,AICH患者存在氧化应激反应,血清SOD水平降低,治疗后随着病情改善SOD水平升高,因此可作为评估疗效的生物学指标[7]。而IL-1β则是反映炎症反应的标志物,研究显示,脑出血患者血清IL-1β水平升高,可作为评估疗效的炎症相关因子[8]。王安平等[9]研究显示,脑出血患者血清IL-1β水平升高,与患者出血量、神经损伤程度密切相关。由此可见,DCBEI与CC联合应用在减轻AICH患者氧化应激及炎症反应方面具有一定作用,可更好地发挥保护脑组织的作用。本研究中两组均无皮疹、恶心、呕吐以及肝、肾功能损伤等不良反应的发生,可见DCBEI联合CC治疗AICH的安全性较高。
综上可知,使用DCBEI与CC联合治疗AICH患者,能降低氧化应激及炎症反应,促进神经功能缺损修复,减轻患者意识障碍,且安全性高,具有较高推广价值。

