水溶性近红外Ⅱ区荧光Ag2Te量子点的合成
周洁琼,黄 艳,张志凌,庞代文,田智全
(武汉大学化学与分子科学学院,武汉 430072)
量子点(QDs)由于其一元激发多元发射、耐光漂和量子产率高等特点,被广泛应用于生物医学领域[1~3].近红外窗口荧光,特别是近红外Ⅱ区(NIR-Ⅱ区,1000~1700 nm[4])窗口荧光,在生物组织及血液中的散射和衰减系数明显降低,且受生物组织自发荧光的干扰显著减弱,因此近红外Ⅱ区量子点在活体成像时具有更深的穿透深度,能极大提高成像信号的信噪比,在活体成像应用方面具有明显的优势[5~7].
Ⅰ-Ⅵ族量子点作为近红外量子点家族中的一员,具有带隙窄和不含有毒重金属元素等优势,引起了研究者的广泛关注.已有研究[8~14]表明,Ⅰ-Ⅵ族量子点生物毒性小,应用前景大.Ⅰ-Ⅵ族量子点带隙分别为:Ag2Te(0.06 eV),Ag2S(0.93 eV),Ag2Se(0.15 eV)[15,16],其中Ag2Te带隙最窄,说明其荧光发射波长理论上能调节至更长的波段.当温度较低时,Ag2Te 半导体材料表现为单斜相(β-Ag2Te);当温度升高至150 ℃时,则会转化为面心立方相(α-Ag2Te)[17].
目前,Ag2Te量子点的合成主要有油相合成[18]和水相合成[19]2类方法.油相合成法可以将波长调至NIR-Ⅱb 区[20],但是要求严格的无氧条件,需要用到三正辛基膦(TOP)等有毒、价格昂贵的试剂[8,21,22],且必须经过水溶性修饰才能进一步应用.目前,水溶性Ag2Te量子点的研究较少.Yang等[23]采用多齿巯基为配体,制得发射波长为995~1068 nm的Ag2Te量子点.Jin等[24]以十二烷胺为配体制备Ag2Te量子点,所得产物发射波长的调节范围为930~1084 nm.Dong等[25]通过牛血清白蛋白生物矿化策略制备了荧光发射波长为1080 nm的多功能Ag2Te量子点,用于CT成像引导的肿瘤光热治疗.Chen等[26]利用阳离子交换法制备了水溶性Ag2Te量子点,但这是一种间接的合成方法,其过程较为复杂.然而,以上研究都是通过包覆壳层的方法来提高量子产率,不可避免地会增加其粒径,从而限制其在生物体系中的进一步应用.综上所述,水溶性Ag2Te 量子点的直接合成还处于萌芽阶段,且发射波长在1100 nm 以下.因此,开展直接合成荧光发射波长更长的水溶性Ag2Te量子点的研究具有重要的理论和实际应用价值.本文在25 ℃及大气氛围条件下,以硝酸银为银源,N-乙酰-L-半胱氨酸为配体,利用硼氢化钠还原亚碲酸钠得到碲源,结合阳离子处理策略,简单、便捷地制备了发射波长为1160 nm的水溶性Ag2Te量子点(Scheme 1),其量子产率高达8.0%(以IR26染料为参比),且该量子点具有良好的生物相容性,可用于生物体内活体成像.

Scheme 1 Strategy for preparing Ag2Te QDs with high quantum yield by cation handled
1 实验部分
1.1 试剂与仪器
硝酸银(AgNO3,纯度99.8%)、N-乙酰-L-半胱氨酸(NAC,纯度99%)和亚碲酸钠(Na2TeO3,纯度99.9%)购自Aladdin公司;硼氢化钠(NaBH4)、氢氧化钠(NaOH)、浓硝酸(HNO3)、1,2-二氯乙烷(DCE)和双氧水(H2O2)均为分析纯,购自中国医药集团公司;IR26染料(C40H30Cl2O4S2)购自Extion 公司;吲哚菁绿(ICG,C43H47N2NaO6S2,纯度90%)购自Sigma Aldrich公司.以上试剂均直接使用,未经过进一步纯化;实验用水为超纯水(电阻率18 MΩ·cm).
透射电子显微照片和高分辨透射电子显微照片通过JEOL 公司JEM2100-JEOL 型透射电子显微镜(TEM,200 kV)得到;采用Nano ZS ZEN3600型纳米粒度及表面电位分析仪(Malvern公司)测量材料的水合粒径;利用D8型X射线衍射仪(XRD,Bruker AXS公司)获得元素的X射线衍射图谱;XPS图谱通过ESCALAB250Xi 型X 射线光电子能谱仪(XPS,Thermo Fisher Scientific 公司)表征得到;通过IRIS Intrepid II XSP型电感耦合等离子体发射光谱仪(ICP-AES,Thermo Elemental公司)对元素含量进行定量分析;采用UV-3600型紫外-可见-近红外分光光度计(日本Shimadzu 公司)和Fluorolog-3型荧光分光光度计(HORIBA Jobin Yvon 公司)分别测量紫外-可见-近红外吸收光谱和荧光发射光谱;利用配备了OMA-V 型近红外检测器(InGaAs,Princeton 公司)的10×Mitutoyo Plan Apo 型近红外Ⅱ区小动物活体成像仪(Edmund Optics 公司)对小鼠或者材料进行近红外荧光成像;iS50 型傅里叶变换红外光谱仪(FTIR),美国Nicolet公司.
1.2 实验部分
1.2.1 水溶性NIR-Ⅱ区Ag2Te量子点的合成 在10.0 mL反应体系中,先加入100 μL 0.624 mol/L 硝酸银溶液和500 μL 0.150 mol/LN-乙酰-L-半胱氨酸溶液,搅拌后加入150 μL 1.00 mol/L 氢氧化钠溶液调节pH,得到澄清透明溶液,再依次加入500 μL 0.0620 mol/L 亚碲酸钠溶液和0.0013 g硼氢化钠,搅拌后得到棕黑色的溶液.
1.2.2 阳离子处理 按摩尔比为1∶1.25 将硝酸银溶液与N-乙酰-L-半胱氨酸溶液混合,调节pH 至7~8,得到澄清透明溶液.将上述溶液滴入量子点溶液中,振荡.
1.2.3 量子点的洗涤与保存 先使用220 nm 尼龙水系滤头过滤除去灰尘等杂质,再用10 kDa 超滤管超滤洗涤量子点,并将纯化的量子点保存在4 ℃低温环境中,待用.
2 结果与讨论
2.1 Ag2Te QDs的形貌及结构
对最终产物进行了一系列表征实验.TEM和HRTEM照片如图1所示,从TEM照片[图1(A)]可以看出,产物形状为球形,粒径分布均匀;由HRTEM照片[图1(B)]可观察到材料明显的晶格,晶格间距为0.196 nm,与单斜相Ag2Te(2ˉ21)晶面吻合.

Fig.1 TEM(A)and HRTEM(B)images of Ag2Te QDs
图2为产物的粒径统计图,通过统计250个颗粒的粒径,得出其平均粒径为(1.6±0.4)nm.利用纳米粒度分析仪测得产物的水合粒径为4.3 nm(图3),结合统计得出的产物的平均粒径,说明产物具有超小粒径.量子点的X 射线衍射谱图如图4 所示,虽然未观察到明显的衍射峰信号,但仍可看出其衍射谱图与单斜相β-Ag2Te晶体(JCPDS 81-1820)基本吻合,与已报道的银系(Ag2X,X=S,Se,Te)量子点的X 射线衍射表征结果一致[27].

Fig.2 Size distribution of Ag2Te QDs

Fig.3 Hydrodynamic diameter characterization of QDs

Fig.4 Powder XRD pattern of QDs
利用电感耦合等离子体发射光谱仪和X 射线光电子能谱仪分析了产物的元素组成.图5为量子点的XPS谱图,以C1s的结合能(284.8 eV)为基准,对各元素的结合能进行校准.通过对样品进行全扫描可得到全谱图,根据图5(A)所示结合能的数值可以判断产物中含有Ag,Te,S,C,O和N元素.再对样品进行窄区扫描,得到XPS高分辨谱图,如图5(B)~(E)所示,通过对比结合能数值,并结合自旋轨道偶合分裂谱线的特点来判断元素的价态和化学环境.其中,373.9和367.8 eV处的能谱峰分别归属于+1价Ag元素3d3/2和3d5/2的特征谱线[图5(B)],582.6和572.3 eV处的能谱峰分别归属于-2价Te元素3d3/2和3d5/2的特征谱线[图5(C)],说明Ag和Te分别以+1价和-2价的形式存在[8,21].由于游离巯基的结合能约为164 eV[28~30],因此162.1和161.2 eV处的能谱峰可分别归属于硫与金属键合后S2p1/2和S2p3/2的特征谱线[图5(D)],这说明产物是以NAC为配体,并且NAC中的巯基是与银进行配位的.C1s的结合能可拟合成2 个峰,分别为284.8 和287.9 eV[图5(E)].其中,284.8 eV 处的峰归属于亚甲基中的碳元素,287.9 eV处的峰归属为C=O中的碳元素[13,31],这说明NAC中的羧基是裸露的,因此产物可以稳定地分散于水溶液中.此外,利用ICP-AES对元素含量进行了定量分析,结果表明,经阳离子处理前后,Ag/Te物质的量之比分别为2.7∶1和5.4∶1,说明经阳离子处理后Ag含量显著增加,符合预期的实验结果.需要指出的是,经阳离子处理前后Ag/Te比均高于其化学计量数之比,这可能是由于Ag2Te量子点的粒径太小,因此比表面积大,其表面大量的银原子与巯基结合导致的[32,33].

Fig.5 XPS survey(A),high-resolution XPS spectra of Ag3d(B),Te3d(C),S2p(D)and C1s(E)of Ag2Te QDs
图6给出N-乙酰-L-半胱氨酸配体和产物的红外光谱.可见二者的红外光谱存在显著差别.其中,N-乙酰-L-半胱氨酸在2552 cm-1处有明显的吸收峰,归属为游离巯基的特征吸收峰;而在Ag2Te 量子点中并未出现游离巯基的特征吸收峰,且在1640和1400 cm-1处可观察到明显的吸收峰,归属于羧酸根的特征吸收峰[11].上述实验结果说明,Ag2Te量子点以N-乙酰-L-半胱氨酸为配体,且配体中的巯基与银发生了配位,配体中的羧基是裸露的.这与X射线光电子能谱仪表征结果相吻合.

Fig.6 FTIR spectra of NAC(a)and Ag2Te QDs(b)
2.2 Ag2Te QDs的光学性质

Fig.7 Normalized fluorescence emission spectra(A),absorption spectra(B) and fluorescence emission spectra(C)of QDs
对阳离子处理前后产物的荧光发射光谱与紫外-可见-近红外吸收光谱进行了测定.图7(A)为产物的归一化荧光发射光谱,图7(B)为产物的紫外-可见-近红外吸收光谱,图7(C)为产物的荧光发射光谱.图7(A)中,阳离子处理前产物的发射峰位于1289 nm,经阳离子处理后,产物的荧光发射波长为1160 nm.图7(B)中,经阳离子处理前后,产物的吸收峰分别位于1026和1013 nm.图7(C)中,经阳离子处理后,产物荧光强度显著增加,约为处理前的6.2倍.与处理前相比,经阳离子处理后产物的吸收峰和发射峰均出现蓝移,这是因为阳离子的加入钝化了产物的表面缺陷,抑制了缺陷发光,从而使光谱发生蓝移且荧光增强[32,34].图8(A)为利用近红外Ⅱ区小动物活体成像仪获得的产物近红外成像图,图8(B)是用手机拍摄的数码照片.样品Ⅰ指阳离子处理前的产物,样品Ⅱ指阳离子处理后的产物,二者浓度相同.从图8可以看出,样品Ⅱ的荧光性能显著优于样品Ⅰ,与其荧光光谱图结果相吻合,说明阳离子处理可增强产物的荧光强度.以分散在1,2-二氯乙烷中的IR26染料(量子产率为0.5%[20,26])为参照,测得经阳离子处理后产物的量子产率高达8.0%,高于之前的部分报道[20,21,26].综上,所合成产物为粒径均一且分散性好的超小粒径Ag2Te量子点,具有进一步生物应用的潜能.

Fig.8 NIR-ⅡFL image(A)and digital photograph(B)of QDs samples
2.3 Ag2Te QDs的稳定性

Fig.9 Photostability of Ag2Te QDs(A),stabilities of Ag2Te QDs in PBS and FBS(B),at different temperatures(4 ℃,25 ℃and 37 ℃)(C,D)and in BR buffers with different pH values(pH=2,5,7,9,12)(E,F)
以50 W汞灯为光源,将Ag2Te量子点和ICG染料共同置于汞灯下照射不同时间后,分别测定其荧光光谱,重复3 次,得到Ag2Te 量子点的光照稳定性结果.如图9(A)所示,相比于ICG 染料,制备的Ag2Te量子点具有良好的光稳定性,当汞灯照射100 min时,ICG染料的荧光降为原来的约30%,而量子点的荧光则保持原来的86%,说明量子点具有较好的光稳定性,与之前报道的油相合成的Ag2Te 量子点稳定性相当[8].此外,还考察了制备的Ag2Te量子点在不同介质、不同温度及不同pH值下的稳定性.将Ag2Te 量子点分别分散在1×PBS 缓冲液和未稀释的胎牛血清(FBS)中,结果如图9(B)所示,可见Ag2Te 量子点在PBS 缓冲液中有较好的稳定性;在未稀释的胎牛血清中,Ag2Te 量子点的荧光强度为PBS缓冲液中荧光强度的60%,且具有较好的稳定性.由于未稀释的胎牛血清中含有大量的蛋白质等物质,量子点容易被吸附[35],导致量子点团聚,荧光强度下降.图9(C)为将Ag2Te 量子点分别保存于4,25 和37 ℃时获得的量子点的初始荧光强度对比图;图9(D)为分别将Ag2Te 量子点在4,25 和37 ℃下保存不同时间获得的量子点荧光强度变化图.可见,将Ag2Te量子点保存于不同温度时,其初始荧光强度几乎不变;在不同温度保存时间长达60 h时,Ag2Te量子点的荧光强度均无明显变化,说明量子点在不同温度下具有良好的稳定性.图9(E)为分别将Ag2Te量子点保存在不同pH值(pH=2,5,7,9,12)的BR缓冲溶液中获得的量子点初始荧光强度对比图;图9(F)为分别将Ag2Te量子点在不同pH值的BR缓冲溶液中保存不同时间获得的量子点荧光强度变化图.可见,量子点在不同pH值下也具有良好的稳定性.将Ag2Te量子点保存在不同pH值的环境中,初始时其荧光强度无明显变化,但是随着时间的延长,在酸性较强(pH=2)的环境中保存60 h时,其荧光强度下降至之前的约80%,这可能是因为酸性较强时,量子点易发生团聚,使其荧光强度降低[36].在弱酸性、中性及碱性环境中保存时,量子点均能较好地保持其荧光.综上,制备的Ag2Te量子点具有良好的稳定性,有利于其进一步应用.
2.4 Ag2Te QDs的毒性
研究表明,不含Cd等重金属元素的量子点具有较低的生物毒性[37].采用细胞计数试剂盒(CCK-8)检测了Ag2Te量子点的细胞毒性.由图10可见,在5 个不同Ag2Te 量子点浓度(0,27,53,110 和220 nmol/L)下,将MDCK 细胞与Ag2Te 量子点共孵育48 h 后,细胞仍具有较好的活性.即使孵育时间长达48 h(含Pb量子点孵育时间通常为12 h[38]),浓度高达220 nmol/L 时,细胞仍能维持94%的活性,与其它Ag 系材料细胞毒性实验结果相近[11],说明合成的Ag2Te 量子点具有良好的生物相容性,有望在生物体系中进一步应用.
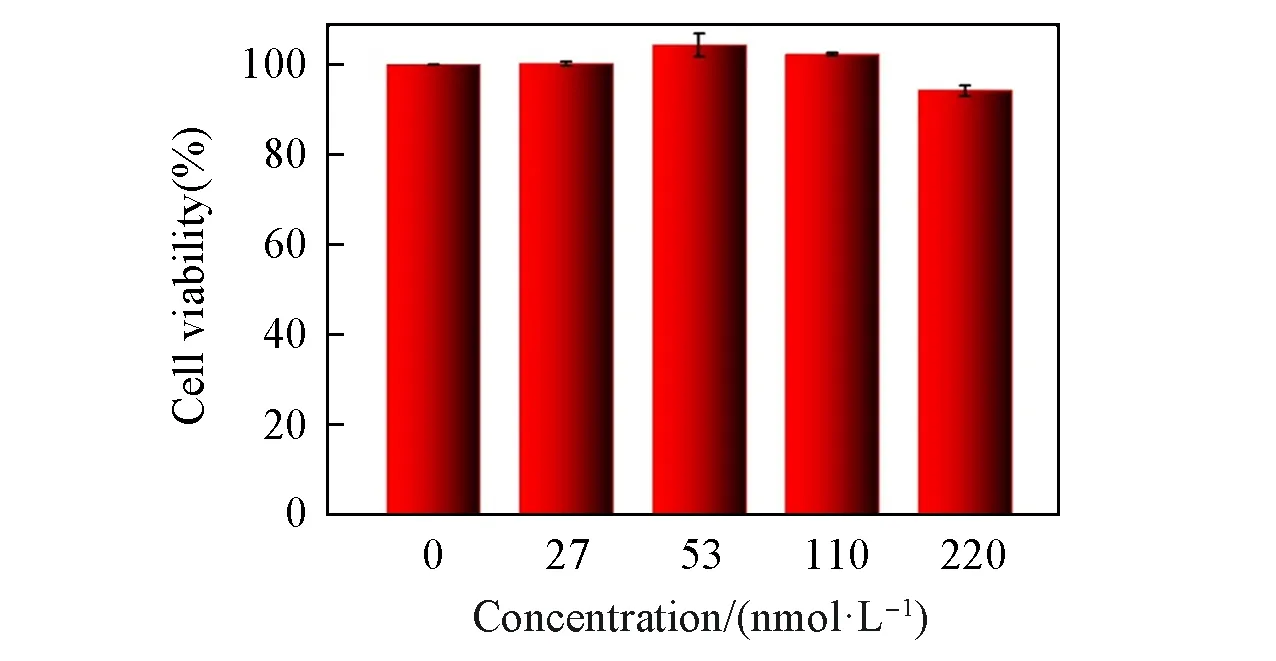
Fig.10 Cell viabilities of MDCK cells incubated with Ag2Te QDs after cation handled for 48 h at various concentrations(0,27,53,110 and 220 nmol/L)
2.5 Ag2Te QDs的体内近红外荧光成像

Fig.11 In vivo NIR-Ⅱfluorescence images after tail vein injection of Ag2Te QDs
基于水溶性Ag2Te量子点优越的荧光性能,考察了其用于活体内近红外荧光成像的可行性.所用老鼠为6周龄的balb/c雌鼠,通过尾静脉注射将200 μL 0.069 mmol/L Ag2Te量子点注入小鼠体内,利用近红外Ⅱ区小动物活体成像仪对小鼠成像.图11(A)为未注射量子点的小鼠成像图;图11(B)~(D)为注射量子点后不同方位的小鼠成像图.可见,小鼠的肝脏[图11(B)-1和(D)-1]、膀胱[图11(B)-2]及脾脏[图11(C)-3 和(D)-3]有明显的近红外荧光,并且从背部[图11(C)]也可观察到明显的近红外荧光,说明Ag2Te量子点的近红外荧光可以穿透小鼠的整个身体,具有较深的成像深度,能提高成像信噪比[12],有望用于高分辨活体成像.
3 结 论
在室温下制备了荧光发射波长为1160 nm 的水溶性Ag2Te 量子点,采用的阳离子处理策略可以钝化量子点的表面缺陷并提高其量子产率;以分散在1,2-二氯乙烷的IR26染料为参照,测得其量子产率为8.0%.CCK-8法和活体成像实验结果表明,Ag2Te量子点的细胞毒性低、生物相容性好,可用于活体荧光成像.该合成方法条件温和、易于操作、不涉及有毒有机试剂,为量子点的合成提供了新思路.在活体成像及纳米生物医学研究中具有广阔的应用前景.

