钴掺杂锰酸镧光催化剂的第一性原理与可见光响应光催化性能研究
李义山,郭 亮,彭思凡,张庆茂,张瑜皓,徐诗淇
(1.华南师范大学广东省微纳光子功能材料与器件重点实验室,2.光学信息物理与技术国家重点实验室,广州 510006)
每年我国重工业工厂会排放大量的有机污染物,造成大面积的水污染.由于光催化剂可以有效处理工业废水中的有机污染物,人们开始逐渐关注和研究光催化剂,TiO2,ZnO等多种光催化剂逐渐被开发并应用于环境治理[1~5].其中,半导体光催化剂作为一种高效、低成本的有机污染物降解材料备受关注[6,7].但TiO2等半导体光催化剂有较宽的带隙[8],决定了其光响应波长阈值只能位于紫外区,所以无法高效利用太阳光有效地降解有机污染物.相比之下,LaMnO3,LaCoO3等A位为La 系金属的ABO3型钙钛矿具有较窄的带隙以及较高的稳定性,是一种比较理想的可见光催化材料[9].目前在对ABO3型钙钛矿的研究中,B位为Mn的复合氧化物在催化氧化性能和结构稳定性上均表现出很强的优越性[10],相较于同类型的金属原子,Mn比Co等元素在制备合成的过程中具有更高的稳定性,不易产生其它杂质,而且Mn 比Fe 等金属离子具有更强的氧化活性,制备出来的钙钛矿氧化物有着更好的催化性能.Hyodo 等[11]研究表明,相较于其它类型的钙钛矿氧化物,A 位为La 元素的AMnO3光催化活性较高,且在所有合成的镧系钙钛矿型氧化物LnMnO3中,LaMnO3表现出了最优的电学和光学性能.李元元等[12]研究发现LaMnO3的带隙较窄,对于可见光响应波长范围更广,对太阳光的利用效率更高,所以LaMnO3是一种理想的研究对象.但LaMnO3在可见光下的催化效果依然有限,需进一步提高其光催化性能.
LaMnO3是通式为ABO3的钙钛矿(Perovskite)[13]氧化物中的一种.理想的ABO3型钙钛矿氧化物呈立方结构,空间群为Pm3m.如图1 所示,理想ABO3型钙钛矿中,A 位离子一般为稀土元素或碱金属元素,位于立方体的顶点,主要起稳定结构的作用.B位离子一般为过渡金属元素,位于立方体的面心,是主要的活性中心.O位于立方体的体心.要形成钙钛矿结构,A,B位离子半径需满足一定的条件.Goldschmidt提出了容忍因子这个概念,用容忍因子来表示不同A,B元素组合的ABO3结构与钙钛矿理想结构的偏离程度[14],Goldschmidt总结出,当容忍因子t满足条件0.75≤t≤1时,均能形成钙钛矿结构.而在LaMnO3的实际合成过程中晶体会发生一定程度的畸变,Mn—O—Mn键会发生弯曲甚至变形,使LaMnO3钙钛矿晶体结构从对称性较高的立方结构转变为对称性较低的正交结构(空间群Pnma)或者菱方结构(空间群R3c).

Fig.1 Model diagram of ABO3 perovskite
当光催化剂吸收的光子能量(hv)大于带隙时,价带上的电子(e-)会被激发跃迁至导带,而在价带的对应位置会产生等量的空穴(h+).空穴带一个正电荷,其易于捕获电子表现出很强的氧化性.电子则相反,具有很强的还原性.转移至催化剂表面未复合的空穴或电子与受体接触时,能发生氧化或还原反应.其中,产h+,·OH等氧化性物质能将污水中的有机污染物分解为CO2和H2O.h+的量子产率较高,起主要的氧化分解作用.·OH虽然具有超强的氧化性但量子产率较低,起辅助氧化作用.因此,为了提高半导体光催化剂的活性,可以通过调节能带结构,缩小光催化剂带隙,以此拓宽光响应范围,提高h+等氧化性物质的产率或者抑制电子与空穴的复合,使氧化性物质尽可能地参与光催化反应.
为了能提高材料的光催化性能,可通过掺杂来改善材料的光催化活性.掺杂能够减小催化剂的带隙,使其能吸收较低能量的光子进行激发,从而提高光催化效果.除此之外,掺杂会使半导体的表面产生氧空位缺陷,氧缺陷能俘获电子,因而提高了电子-空穴的分离率,使得掺杂后LaMnO3的可见光催化效果明显加强.但是,过多的氧缺陷产生的杂质能级又可能成为电子-空穴对的复合中心,会降低量子效率,使载流子的寿命缩短.所以,存在一个最佳的掺杂比例[15]使得催化剂更高效.在多种金属离子中,Co2+与Mn3+有着相似的离子半径,更容易制备出稳定的掺杂样品.在掺杂适量Co 后,由于B 位Mn3+处于一种不稳定化合价形式,容易升价为Mn4+使材料氧化性得到提升[16~19],所以选择Co离子对于LaMnO3进行掺杂改性是一种合适的方案.溶胶-凝胶法一般是将2种或多种金属元素的硝酸盐溶于水中,加入络合剂使其发生水解、缩聚反应形成均一稳定的透明溶胶.对溶胶进行脱水、干燥、煅烧、研磨等过程即可获得所需光催化剂.溶胶-凝胶法制备工艺较为简单,制备出的粉体粒径小、均匀性好、纯度高,是一种比较理想的光催化剂制备方法.
本文采用Co2+掺杂的方式来提高LaMnO3的可见光催化效果.首先对LaMnO3进行了第一性原理模拟计算,结合第一性原理分析了Co2+掺杂前后LaMnO3的电子性质与光学性质的改变,随后采用溶胶-凝胶法合成了LaMnO3粉末,研究了不同溶胶pH 值对于合成物的尺寸形貌及催化效果的影响,获得了LaMnO3的最佳制备环境.最后采用Co2+离子掺杂合成了LaMn1-xCoxO3粉体,研究了不同Co2+掺杂浓度对LaMnO3光催化活性的影响,证实了第一性原理模拟中的结果.
1 实验部分
1.1 试剂与仪器
六水合硝酸镧[La(NO3)3·6H2O]、硝酸钴[Co(NO3)2]和柠檬酸(C6H8O7)均为分析纯,甲基橙纯度为98%,均购于上海麦克林生化科技有限公司;乙酸锰[Mn(CH3COO)2]为分析纯,购于天津市福晨化学试剂厂;氨水(NH3·H2O)为分析纯,购于天津市致远化学试剂厂;盐酸(HCl)为分析纯,购于珠海市华成达化工有限公司.
SXL-1030型程控箱式电炉(上海精宏实验设备有限公司);KQ-5200DE型数控超声波清洗器(昆山市超声仪器有限公司);D2F-5050S型电热真空干燥箱(康恒仪器有限公司);UV-3101PC型紫外-可见分光光度计(UV-Vis,日本岛津公司);Bruker D8 Advance 型X 射线衍射仪(XRD,德国Bruker 公司);ZEISS Ultra 55 型场发射扫描电子显微镜(SEM,德国Carl Zeiss 公司);ASAP 2460 型孔径分析仪(美国Micromeritics公司).
1.2 实验过程
1.2.1 样品的制备 选用溶胶-凝胶法作为LaMnO3的制备方法.为了确定LaMnO3的最佳pH环境,在不同pH条件下制备出了LaMnO3粉体并对其进行了甲基橙催化氧化实验.实验中,以La(NO3)3·6H2O,Mn(CH3COO)2作为所需的镧源,锰源.以去离子水为溶剂,柠檬酸为稳定络合剂.按照0.3 mol/L的浓度称量金属离子摩尔比为1∶1的硝酸镧、乙酸锰,并溶于100 mL去离子水中.搅拌直至溶解后,加入0.09 mol络合剂柠檬酸进行络合反应.使用氨水或盐酸调节溶液的pH值,配置不同梯度的溶液(pH=1,2,3,4,5,6,7,8,9).然后将溶液转移至80 ℃水浴锅中搅拌蒸发水分,使溶液逐渐变成黏稠状凝胶.将得到的锰酸镧湿凝胶置于100 ℃电热干燥箱中干燥蒸发水分后,放置于箱式程控电阻炉中快速升温至450 ℃保温30 min 后升温至700 ℃退火析晶6 h.重复上述过程直至获得不同pH 下的LaMnO3粉体.
LaMn1-xCoxO3的制备与上述过程相似.采用溶胶-凝胶法制备LaMn1-xCoxO3粉体,按照La,Mn,Co 摩尔比为1∶1-x∶x的比例分别称量相应的硝酸镧、乙酸锰、硝酸钴试剂并溶于去离子水中配制浓度为0.3 mol/L 的LaMn1-xCoxO3溶液.待原料完全溶解后,加入适量的稳定络合剂柠檬酸进行络合反应.调节溶液pH 至8 后继续搅拌5 h,然后将溶液移至80 ℃水浴锅中进行搅拌,使混合溶液逐渐变成黏稠状凝胶.随后将前驱体凝胶置于100 ℃干燥箱内干燥12 h直至水分蒸发完全.最后,将干凝胶研磨成粉后再置于箱式程控电阻炉中快速升温至450 ℃保温30 min后,升温至750 ℃退火析晶6 h,即可得蓬松状样品,继续研磨后即可得LaMn1-xCoxO3(x=0,0.1,0.2,0.3)黑色粉体.
1.2.2 光催化性能的测定 配制500 mL 10 mg/L的甲基橙溶液作为光催化降解溶液.将0.05 g的光催化剂(LaMnO3或LaMn1-xCoxO3)放入恒温(30 ℃)的甲基橙溶液中并匀速搅拌20 min,使催化剂与染料达到吸附-脱附平衡状态,取样(A0).将氙灯放置在距离烧杯25 cm的位置,打开氙灯.每隔30 min从光催化降解液中提取适量的甲基橙悬浊液并进行高速离心机处理,离心机转速为16000 r/min,离心结束后取上层清液作为测试样本(A1).离心是为了防止粉末残留继续在溶液中进行光催化反应.通过分光光度计测量所取样品的吸光度.由朗博比尔公式可知,溶液浓度的变化与吸光度的变化呈正比,所以通过甲基橙吸光度的变化可以表征LaMnO3的光催化效果.采用吸光度计算公式可以计算LaMnO3的光催化效果.
2 结果与讨论
2.1 第一性原理模拟的实验结果
使用Accelrys 公司开发的Materials Studio 软件中的CASTEP[20]模块进行模拟.目前LaMnO3第一性原理模拟计算中,大多数采用空间群为Pm3m(221)的理想型立方模型进行计算.但是在本文后续实验中,制备出的锰酸镧粉末经XRD 表征分析显示其为空间群为R3c的菱方相结构.晶胞参数的实验值为a=b=5.531,c=13.3630.为了保证模拟模型与实际模型的贴合性,在后续模拟过程中选用实验测得的数据进行计算.所建模型如图2所示,为LaMnO3的晶胞原胞模型,1 个LaMnO3原胞含有30 个原子,其中,La,Mn,O 离子的价电子组态分别为5d16s2,3d54s2和2s22p4.
在实际的模拟计算中,为了结果更贴近实际采用不同的平面波截断能(Cut-off energy)、K点(K-point)、自洽场收敛标准和不同的交换相关函数都会对实验结果产生影响.为了保证理论计算的正确性,首先对相关参数进行测试.自洽场采用BFGS算法设置如下参数:内应力收敛标准为0.02 GPa;单个原子的能量收敛标准为5×10-6eV/atom;原子的最大位移标准为5×10-5nm,相互作用力的收敛标准为0.1 eV/nm,使用PAW 赝势.如图3所示,通过对LaMnO3的收敛性测试得出适合的最优参数为Cutoff energy设置为340 eV,K-point取3×3×2.

Fig.2 Schematic diagram of LaMnO3 cell structure

Fig.3 Cut-off energy convergence curve and K-point convergence curve of LaMnO3 cell structure optimization
通过对相关-交换函数进行测试,通过比较测试结果中不同泛函数计算晶胞优化后的结构参数与实际参数,计算出两者的误差.计算结果表明,经过GGA-RPBE 计算后的晶胞,晶胞尺寸以及体积误差较大,其中体积误差达到了17.02%.而经过LDA 计算后各项参数的误差均不小于3%,这达到了晶胞参数变化要求,说明后续计算中采用交换关联函数为LDA是可行且可靠的.用上述测试参数(R3c结构、K-point取3×3×2、Ecut=340 eV)对LaMnO3进行能带结构计算.根据LaMnO3能带图(图4)可知,LaMnO3的价带顶以及导带底位于同一波矢方向上,材料为直接半导体,带隙为2.0 eV.

Fig.4 Band structure of LaMnO3
通过掺杂Co2+改变原始晶胞结构中的B位Mn离子的比例,计算出不同掺杂浓度下LaMn1-xCoxO3的能带结构.计算结果表明,随着Co2+掺杂浓度(x=0.1,0.2,0.3)的增加,LaMnO3半导体的禁带宽度也从原始的2.0 eV逐渐降为1.40,0.80和0.75 eV(图5).

Fig.5 Band structure of LaMnO3 with 0.1(A),0.2(B)and 0.3(C)Co2+substitution
通过计算材料晶体的有效质量以及载流子浓度对材料的性能进行评价,可以更好地分析能带结构变化后导致电子-空穴对的变化[21].为了计算出电子以及空穴的有效质量,绘出不同Co2+掺杂浓度时LaMnO3的价带顶以及导带底的E(k)-k关系图,并用Origin软件计算价带顶、导带低的二阶导数,所有的电子空穴质量均以电子质量m0为基准.由结果可知,当Co2+掺杂浓度(x=0,0.1,0.2,0.3)逐渐升高时,计算出的电子有效质量分别为0.1089m0,1.0857m0,0.9483m0和0.4724m0;空穴的有效质量分别为0.2344m0,0.9796m0,0.8222m0和0.7212m0.分析发现,随着Co2+掺杂浓度的升高,电子以及空穴有效质量均有先升高然后逐渐降低的趋势,这可能是由于Co2+掺杂后改变了价带顶和导带底的结构所致.设定默认温度为300 K,将带隙、有效质量等参数带入载流子浓度公式计算可得:当Co2+掺杂浓度(x=0,0.1,0.2,0.3)升高时,LaMn1-xCoxO3的载流子的浓度分别为:n1=1.6×1018,n2=2.6×1019,n3=2.1×1019,n4=1.1×1019.Co2+掺杂后,LaMn1-xCoxO3的载流子的浓度体系的载流子浓度均比LaMnO3高,所以掺杂Co2+可以提高LaMnO3光催化剂性能.当Co2+掺杂浓度为x=0.1时,计算出的载流子浓度最高,随着掺杂浓度继续提高,载流子浓度又会降低.所以对LaMnO3光催化剂而言,带隙越窄并不意味着就能达到良好的催化效率,其带隙存在最优值(当载流子浓度最高时对应的带隙为1.5 eV).图6 为LaMn1-xCoxO3体系吸收系数随波长变化的关系,可见,未掺杂时,LaMnO3的主要吸收波长处于紫外区,在400 nm附近的光吸收仅为20000 cm-1.Co2+掺杂后,LaMn1-xCoxO3对波长在400~760 nm 的可见光吸收有了明显提高,在红外区也有一定的增强.并且Co2+的掺杂浓度存在最优值,当Co2+掺杂浓度未到最优值时,随着Co2+掺杂浓度的逐渐升高光催化剂的可见光响应能力会逐渐提高,但是当Co2+掺杂浓度超过最优值时,LaMn1-xCoxO3对可见光区响应能力逐渐减弱.结合计算结果分析,造成该现象是因为Co2+掺杂后光催化剂的带隙减小,电子跃迁所需要的能量降低,价带电子可以吸收能量较低的光子进行跃迁.并且由于杂质能级的存在,低能量的电子可以先跃迁至杂带,再跃迁至导带,从而吸收较低能量的光子就可以进行激发,提高了光催化剂的可见光响应能力.由于材料是直接半导体,通过紫外-可见光谱与禁带宽度的公式可求得,LaMn1-xCoxO3(x=0.1,0.2,0.3)的禁带宽度分别为2.121,1.632,1.122 和1.016 eV,与第一性原理模拟结果的趋势相同,因此,掺杂钴的确可以减少LaMnO3的禁带宽度,从而增强材料的光催化性能.

Fig.6 UV-Vis spectra of LaMnO3 with differnt Co2+concentrations
2.2 LaMnO3的制备结果和光催化性能
2.2.1 LaMnO3的制备结果 利用溶胶-凝胶法制备LaMnO3光催化剂时,pH 值对溶胶稳定性有较大影响,其不仅影响缩聚反应的进行,而且影响LaMnO3的团聚.本文观察了不同pH 环境下(pH=1,2,3,4,5,6,7,8,9)LaMnO3溶胶在反应过程中出现的现象(见表1).

Table 1 Phenomenon of different pH value
如表1所示,不同pH环境下成胶差异性较大,LaMnO3酸性溶胶不稳定,在静置的过程中容易产生白色沉淀物,而在碱性条件下溶胶较为稳定,放置60 d 未发生变质现象且丁达尔现象明显.实验中,调节pH时,出现了沉淀产生再消失以及溶液颜色加深现象.在pH从1增加到5的过程中,白色沉淀逐渐增多,pH>5之后沉淀又逐渐消失.在pH=6时,虽然溶液较为稳定但是在水浴过程后得到了白色沉淀加凝胶的混合物,其为溶胶稳定的过渡状态.当pH>7时,白色沉淀没有再次析出但是溶液的颜色逐渐加深.为了弄清造成白色沉淀产生以及溶液变色现象的主要阳离子种类,设置了两组对比实验,用柠檬酸分别络合La3+和Mn2+,金属阳离子与柠檬酸摩尔比依然为1∶1.5.现象表明,白色沉淀出现再消失的现象只与La3+有关,溶液颜色加深只与Mn2+有关.根据现象分析其原因,是因为柠檬酸含有4个配位基团,3 个羧基(—COOH),1 个羟基(—OH),不同pH 下柠檬酸的电离常数不同.在酸性条件下,HCit3-与La3+会络合产生白色不溶物[LaHCit(NH3)a·6H2O].随着pH 的升高,溶液中OH-和NH3的含量逐渐提高,由于OH-和NH3有着更好的络合作用,它们会置换白色不溶物[LaHCit(NH3)a·6H2O]中的H2O和COO-使其逐渐转化为可溶性的[LaHCit(NH3)a(OH)b]b-.溶液颜色逐渐加深的现象是因为Mn2+的多元配合所致,配合的单元越多,溶液的颜色越深,但是溶液颜色加深不影响溶胶的稳定性,所以LaMnO3需在中性或者碱性的条件下制备.
2.2.2 LaMnO3样品的表征 为了判断不同溶胶pH 制备出的样品经过退火析晶后得到的粉体是否为LaMnO3,pH 的变化是否会对LaMnO3晶型、纯度及结晶度产生影响,需借助表征手段进一步表征.图7 为不同溶胶pH 下制备出的LaMnO3粉末样品的XRD 谱图.如图7 所示,在中性及碱性环境下得到的LaMnO3样品均为单相结构.pH=6 时制备出的LaMnO3样品有杂质峰出现,杂质衍射峰主要由La2O3,Mn3O4的特征峰构成,这是由于在酸性条件下,络合剂柠檬酸电离不完全导致.溶液中2种金属离子没有完全络合一直存在于前驱体中,在最后750 ℃退火过程中被氧化.所以LaMnO3不宜在酸性条件下制备,下面只对pH=7,8,9时制备的LaMnO3样品进行研究.

Fig.7 XRD patterns of LaMnO3 with different pH
利用Jade软件精修后将各个衍射曲线与标准JCPDS卡进行对比分析,结果表明,制备的LaMnO3对应的JCPDS卡片号为88-0126.其中晶胞参数为a=5.531,b=5.531,c=13.363对应空间群为R3c的菱方相结构.为了计算当pH值变化时LaMnO3粉末样品的结晶度变化,引入3个强峰的面积比来表示样品的结晶度.根据上述数据计算3 个强峰的占比分别为60.6%,54%和54.7%,表明pH=7 时获得的LaMnO3粉体有着良好的结晶度.经过谢乐公式计算,pH从7到9变化时,粒径尺寸分别为37.0,38.2和49.0 nm,随着pH值的增加,纳米粒子粒径有变大的趋势.
为研究不同pH 值下所制LaMnO3的形貌变化,对样品进行了SEM 测试.由图8 的SEM 照片可见,在pH=7,8条件下,得到的LaMnO3样品颗粒粒径较小,分布比较均匀且边界较清晰;在pH=9条件下获得的LaMnO3样品颗粒间有一定的黏连和团聚.利用NanoMeasurer1.2软件对颗粒大小进行统计分析,可知pH=7,8时粒子的粒径分布在57~120 nm之间;pH=9时,粒子之间的团聚比较严重,单个粒子之间会堆积团聚成一个粒子,所以粒径分布在117~256 nm之间.在纳米材料的制备过程中,粒子尺寸越小、比表面积越高,与污染物接触的概率就越高,越容易降解污染物,所以从SEM 结果可知,溶胶的pH不能过高,中性或者弱碱性会有助于污染物的催化降解.

Fig.8 SEM images of LaMnO3 perovskite catalysts
光催化反应过程中,催化的过程通常包括反应物吸附、催化反应、脱附3个过程.反应物的吸附量则与催化剂的比表面积有关.由图9 可知,不同pH 制备出来的LaMnO3样品均出现了吸附-脱附滞回环,符合Ⅳ型吸附-脱附曲线,因此在750 ℃煅烧后制成的LaMnO3存在孔状结构,孔状的结构有利于提高LaMnO3的比表面积.较大的比表面积会在光催化过程中让LaMnO3吸附更多的有机物污染物,拥有更多的活性位点,使催化剂对有机物光催化降解效率提高.通过测量得出,在pH=8的环境下制备出的LaMnO3拥有最大的比表面积18.3332 m2/g,在碱性(pH=9)的环境下比表面积达到5.9561 m2/g.所以在光催化的过程中,弱碱性环境下制备出的LaMnO3更容易吸附有机污染物分子,有望表现出最优的光催化效果.
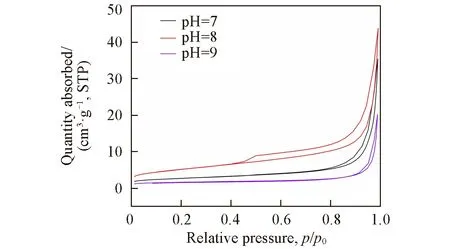
Fig.9 N2 adsorption-desorption isotherms of LaMnO3 with different pH
2.2.3 LaMnO3的光催化性能 对确定模拟污染物甲基橙(MO)的最大吸收波长,利用紫外-可见分光光度计在紫外和可见光区域对甲基橙溶液进行全段扫描,结果如图10(A)所示,甲基橙对波长为464 nm 的吸收最为明显,所以均以464 nm 时甲基橙溶液透过率的变化来衡量LaMnO3的光催化效果.图10(B)为不同溶胶pH 下制备的LaMnO3粉体的光催化效果图.实验中设计了一组甲基橙空白实验(MO曲线),是为了研究无光催化剂时光照能否使甲基橙自然降解,避免光照对实验结果产生干扰.由图10(B)中MO降解效率曲线可知,未加光催化剂时,光照对MO分解无影响.加入光催化剂后,经过20 min搅拌,LaMnO3与甲基橙基本达到吸附-脱附平衡状态.不同溶胶pH下制备的LaMnO3粉体的光催化效果不同,其中溶胶pH=8时制备的LaMnO3粉体具有最优的催化效果,在氙灯照射2 h后对甲基橙溶液的降解率达37%.

Fig.10 MO transmittance curve of different wavelength(A) and catalytic efficiency curve of LaMnO3(B)
2.3 LaMn1-xCoxO3的表征及光催化性能
2.3.1 LaMn1-xCoxO3的表征 首先对LaMn1-xCoxO3的稳定性进行分析.在LaMn1-xCoxO3结构中,La3+的6配位离子半径为0.136 nm,Mn3+的6 配位离子半径为0.0785 nm,Co2+的6 配位离子半径为0.072 nm,O2-的6配位离子半径为0.140 nm.根据容忍因子公式计算了LaMn1-xCoxO3的容忍因子t值.其中B位Mn3+由于被掺杂,其离子半径会发生改变.为解决这个问题,本文利用掺杂后的平均离子半径来近似B位的离子半径进行计算.在计算容忍因子的同时B位离子半径(-rB)和O位离子半径(rO)的比值-rB/rO也是一个重要参数,当B/rO≤0.425时,八面体BO6比较稳定,表2计算了不同掺杂量下容忍因子t的变化.如表2所示,不同Co2+掺杂浓度下的LaMn1-xCoxO3材料的容忍因子t均在0.75到1之内,表明掺杂后每种材料均为钙钛矿结构.并且,随着Co2+掺杂量的提高,t值逐渐增大,表明材料稳定性提高.同时,每种材料离子半径相似,掺杂后的结构均是稳定的.所以,在理论上Co2+掺杂是可行的.图11为采用溶胶-凝胶法制备的LaMn1-xCoxO3(x=0.1,0.2,0.3)粉体的XRD 谱图.由图11 和图7 对比可见,掺杂Co2+后的LaMnO3与纯相LaMnO3样品相比,未产生新的衍射峰,原有的衍射峰也没有消失,衍射峰具有较强的峰强以及较窄的峰宽,说明其具有良好的结晶度.在2θ=22.96°,32.83°,40.22°,46.91°,52.67°,58.27°和68.21°附近出现的衍射峰分别对应锰酸镧的(012),(104),(202),(024),(122),(214)和(220)晶面.每种样品对应的JCPDS 卡片号均为82-1152.Co2+掺杂后虽然对LaMnO3的整体结构没有影响,但是由于Co离子的半径比Mn离子半径小,在掺杂后,为了保持电中性,Mn3+会被氧化为半径更小的Mn4+.同时由于Mn4+比Mn3+的离子半径更小,所以在Co2+掺杂后LaMnO3晶体的体积会收缩,导致晶面间距减小,如图12所示,在衍射图中,衍射角有向高角度方向移动的现象产生.

Table 2 Tolerance factor of different CO2+substitution concentration

Fig.11 XRD patterns of LaMnO3 with different Co2+substitution concentrations

Fig.12 XRD peaks of LaMnO3 with different Co2+substitution concentrations
2.3.2 LaMn1-xCoxO3光催化性能 不同Co2+的掺杂浓度有着不同的光催化效果,催化效果可以通过对模拟有机污染物甲基橙的浓度变化来描述.图13(A)为不同Co2+掺杂浓度时的甲基橙降解速率曲线.由图10(A)的甲基橙降解速率曲线可知,搅拌(未光照)20 min后,不同掺杂浓度的LaMn1-xCoxO3与甲基橙染料之间达到了吸附-脱附平衡状态.LaMnO3,LaMn0.9Co0.1O3,LaMn0.8Co0.2O3,LaMn0.7Co0.3O34种光催化剂对甲基橙溶液的吸附率基本为10%左右.打开氙灯后,不同掺杂浓度的样品表现出了不同的光催化活性,光照120 min 后4 种催化剂对甲基橙溶液的降解率分别为37%,54%,47%和43%.实验结果表明,LaMn0.9Co0.1O3表现出最佳的光催化活性.与纯相LaMnO3相比,光催化降解效率提高了17%.但是掺杂浓度不是越高越好,当Co2+掺杂浓度过高时,会出现氧空位的局部有序排列的现象,使得氧空位沿着某个方向规则排序,加速了光生电子-空穴的复合,减少了氧空位,降低了样品的光催化活性[22].当光催化剂吸收的光子能量(hv)大于带隙时,价带上的电子(e-)会被激发跃迁至导带,而在价带的对应位置会产生等量的空穴(h+).空穴带一个正电荷,由于空穴易于捕获电子表示出很强的氧化性[23,24],有利于通过氧化还原反应降解污染物,生成CO2和H2O.氧空位的过快减少降低了样品的氧化性能,导致LaMn1-xCoxO3的光催化性能降低.

Fig.13 MO degradation rate of LaMnO3 with different Co2+ substitution concentrations(A)and relationship between times of LaMn0.9Co0.1O3 cycle experiments and catalytic efficiency(B)
为了研究LaMn1-xCoxO3光催化剂的可重复性,对使用过的LaMn0.9Co0.1O3样品进行重复性实验,将样品离心洗涤后继续进行了3次光催化降解甲基橙溶液的测试实验.结果如图13(B)所示,经过3 次光催化降解实验以后,降解率没有明显降低,仍保持类似的降解效率.
将光催化实验后的溶液通过滤纸过滤3遍,收集滤纸上的粉末加入去离子水中,通过去离子水冲洗干净后再用滤纸过滤,放入干燥箱中干燥后获得LaMnO3粉末.通过XRD 表征进行光催化实验后的LaMnO3粉末,如图14 所示,通过光催化实验后的LaMnO3粉末并没有发生相变,证明了LaMnO3在光催化过程中是作为催化剂参与了反应.

Fig.14 XRD pattern of LaMnO3 after photocatalytic experiment
3 结 论
首先利用Materials Studio 软件对LaMnO3进行了第一性原理计算,分析了掺杂前及掺杂后LaMnO3的电子与光学性质的改变.第一性原理结果表明,纯相LaMnO3的带隙为2.0 eV,其能带主要由O的2p轨道以及金属离子的d轨道构成.掺杂Co2+后会使LaMnO3的带隙逐渐变窄,对可见光的吸收逐渐增强.当Co2+掺杂浓度为1/6时,计算可得,在此掺杂浓度下催化剂具有最优的量子产率(载流子浓度为2.6×1019),表明Co2+存在一个最佳的掺杂浓度.其次,采用溶胶-凝胶法合成了LaMnO3光催化剂,研究了不同pH 对LaMnO3的尺寸、形貌及催化活性的影响,从而获得了LaMnO3最佳的制备环境.结果表明,LaMnO3应该在中性及碱性环境下进行制备.因为在酸性环境下制备出的LaMnO3中存在La2O3,Mn3O42种氧化物,它们的存在会降低光催化剂的纯度从而使光催化效果降低.经过比表面积测试以及光催化降解甲基橙实验可知,pH=8的条件下制备的LaMnO3具有最大的比表面积,表现出最优的催化活性,确定了LaMnO3在中性及碱性环境下制备的最佳pH值为8.最后,采用掺杂Co2+对LaMnO3进行改性,合成了LaMn1-xCoxO3纳米粉体,研究了不同Co2+掺杂浓度对光催化活性的影响.通过掺杂不同浓度(x=0.1,0.2,0.3)的Co2+对LaMnO3进行改性后,XRD表征表明,Co2+掺杂到LaMnO3的晶格中并没有改变LaMnO3的晶体结构.通过光催化降解甲基橙的实验结果可知,x为0.1时制备出的LaMn0.9Co0.1O3降解效率最高,证明了模拟实验中Co2+存在最佳掺杂浓度的结论.

