颈椎原发性脊索瘤的PET/CT征象
宋乐,陈志波,张卫方*
1.北京大学第三医院核医学科,北京 100191;2.潍坊医学院附属平度市人民医院医学影像科,山东 青岛 266700;*通信作者 张卫方 tsy1997@126.com
脊索瘤是一种罕见的恶性骨肿瘤,源自胚胎时期残留脊索组织,好发于中轴骨两端(骶骨、颅底)[1]。颈椎脊索瘤少见,难以与转移瘤及其他原发性骨病变相鉴别。大部分脊索瘤恶性程度不高,但具有局部侵袭性,手术切除后局部复发率>50%,并可以发生转移[2-3]。氟脱氧葡萄糖(18F-FDG)PET/CT对于转移瘤的诊断有重要价值,亦有助于诊断部分骨肿瘤或瘤样病变[4];但该方法用于脊索瘤诊治的研究鲜有报道,且病变大多位于颅底或骶骨,FDG代谢情况不一[5-9]。关于颈椎脊索瘤的FDG PET/CT表现既往鲜有报道。本研究拟总结颈椎原发性脊索瘤的形态学及FDG代谢特点,为提高本病的认知及诊断提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2012年5月-2019年12月北京大学第三医院行18F-FDG PET/CT检查的脊索瘤患者的影像学及临床资料。纳入标准:①病变位于颈椎;②CT引导下穿刺活检或手术病理诊断为脊索瘤;③PET/CT检查前患者未接受针对脊索瘤的任何治疗。记录纳入患者的性别、年龄、症状、脊索瘤病理类型、治疗及随访情况等。本研究共纳入脊索瘤11例,其中男4例、女7例,年龄29~66岁,平均(52.6±3.8)岁。11例病理均为经典型脊索瘤。
1.2 仪器与方法 患者空腹6 h以上,检查前空腹血糖低于11.1 mmol/L。按照3.7~5.5 MBq/kg静脉注射18F-FDG(北京原子高科股份有限公司,放化纯度>95%)。约注射后60 min,采用Siemens Biograph 64 PET/CT扫描仪,扫描范围由颅底至L1(颈胸段)或股骨近段(躯干)。扫描参数:管电压120 kV,管电流100 mAs,螺距0.9。PET采集3~6床位,每个床位采集2 min,True X方法重建,迭代3次,子集21,高斯滤波,半峰宽5.0,放大倍数1.4。
1.3 图像分析 由2名主治及以上职称的核医学医师共同阅片。应用北京麦迪克斯影像工作站进行PET/CT图像分析及数据测量。观察病变的CT特点,包括部位、骨质破坏、骨质硬化、密度(是否均匀,有无钙化或骨样密度影)、椎管或椎旁侵犯。测量病变最大标准化摄取值(SUVmax)及最大径线。总结病变FDG代谢特点,包括摄取是否均匀、内部有无放射性减低或缺损区。分别与邻近脊椎、椎旁软组织及颈髓对比,观察椎骨内、椎旁、椎管内病变代谢情况。对比PET(PET/CT融合)与CT图像,分析病变FDG摄取与CT征象的关系。记录PET/CT其他部位病变情况。
1.4 统计学方法 应用SPSS 18.0软件进行分析。患者年龄、病变大小及SUVmax等符合正态分布的计量资料以±s表示。病灶大小与SUVmax的相关性采用Pearson相关分析。P<0.05表示有统计学意义。
2 结果
2.1 CT表现 11例患者中:PET/CT颈胸段显像5例,躯干显像6例。11例脊索瘤均为单发,未见转移或其他恶性肿瘤征象。PET/CT表现见表1。病变位于C2椎体6例,C1前弓1例,C1~2、C2~4、C2~5、C3~4椎体各1例;伴邻近结构受累,其中斜坡3例、枕骨髁2例,椎旁及椎管各7例。CT呈溶骨性破坏11例,骨皮质连续性中断或部分缺损11例,边缘部分骨质硬化8例,骨质破坏内部可见骨样密度影4例。与邻近肌肉对比,7例椎旁软组织肿块呈不均匀等、低混杂密度5例(图1),均匀性等密度1例(图2),均匀性低密度1例。

表1 11例颈椎原发性脊索瘤的PET/CT表现
2.2 PET表现 病变SUVmax 3.08~6.67,平均5.16±0.32;长径2.37~6.27 cm,平均(3.63±0.32)cm。两者无显著相关性(r=-0.151,P>0.05)。PET显示:11例病变FDG代谢均高于邻近椎体及肌肉,其中代谢均匀1例,呈均匀性等密度(图2);代谢不均匀10例(图1、3、4),高代谢灶局限于骨破坏内4例(图3),位于骨破坏区及椎旁肿块6例,其中密度不均匀5例(图1),均匀1例(图4)。7例椎管内病灶,与颈髓对比,FDG代谢增高6例(图1),代谢接近1例(图4)。

图1 男,62岁,C3~4脊索瘤。A.CT示C3溶骨性破坏,伴椎前、椎管内巨大软组织肿块(箭),呈等、低混杂密度(对比邻近肌肉);B、C.PET及PET/CT融合图像示病变代谢不均匀增高(箭),SUVmax 5.73,椎管内病变代谢高于受压后移的颈髓(箭)
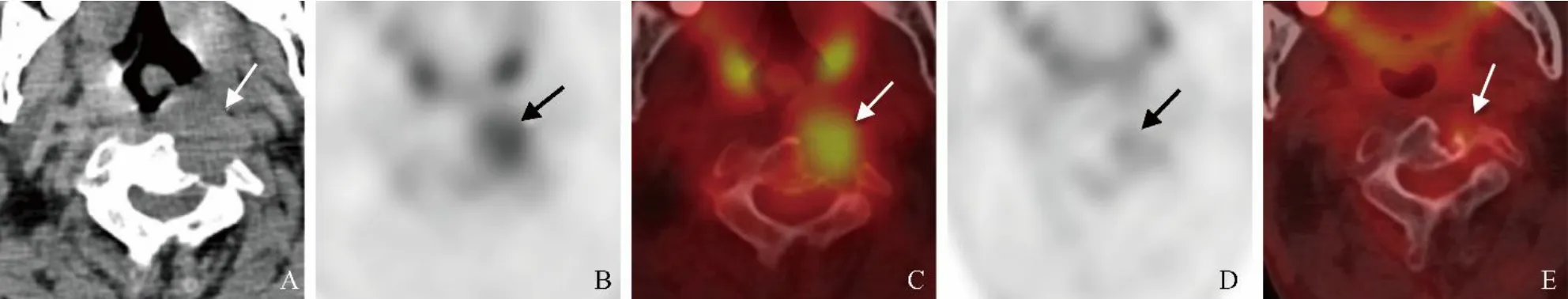
图2 男,61岁,C2脊索瘤。A.CT示C2溶骨性破坏,伴左前方软组织肿块(箭),密度均匀,接近椎旁肌肉;B、C.PET及PET/CT融合图像示病变代谢均匀性增高,SUVmax 4.11(箭);D、E.放疗14个月后PET及PET/CT融合图像示病变缩小,代谢减低,SUVmax 2.18(箭)

图3 女,59岁,C2脊索瘤。A.CT示C2椎体溶骨性破坏(箭),内见残留骨样密度影;B、C.PET及PET/CT融合图像示病变代谢欠均匀,SUVmax 5.78,后部代谢较低(箭)

图4 女,47岁,C2~5脊索瘤。A.CT示C3溶骨性破坏,伴椎旁软组织肿块(白箭),密度均匀,低于椎旁肌肉,并累及椎管(黑箭);B、C.PET及PET/CT融合图像示病变代谢欠均匀,高代谢区位于椎旁软肿块内,SUVmax 3.08(箭),椎管内病变代谢接近颈髓,SUVmax 1.76(箭)
2.3 放疗后PET/CT表现 本组1例患者放射治疗14个月后复查PET/CT,病变缩小,长径由3.37 cm降至2.14 cm;FDG代谢明显减低,SUVmax从4.11降至2.18(图2)。
3 讨论
脊索瘤是一种出现脊索分化的恶性骨肿瘤,病理上可分为经典型、软骨型、去分化型和肉瘤样[3]。本组病例均为经典型脊索瘤。本病最常见于骶骨(50%),其次是颅底(30%)[3]。可动脊柱脊索瘤少见,其中76%位于颈椎[10]。本组患者颈椎脊索瘤多位于C2椎体,并易累及邻近脊椎或颅底骨质。脊索瘤好发年龄为40~60岁[10]。本研究患者平均年龄(52.6±3.8)岁。PET/CT有助于部分骨肿瘤或瘤样病变的诊断[4];但关于脊索瘤的报道较少。
本组脊索瘤FDG代谢高于邻近脊椎及肌肉,平均SUVmax 5.16,与既往部分报道基本一致。Evangelisti等[11]报道14例骶骨脊索瘤治疗前平均SUVmax 5.1,碳离子治疗后为3.4。Miyazawa等[9]报道1例胸椎脊索瘤初诊SUVmax 2.45,7个月后局部复发灶SUVmax 4.37。Mammar等[5]报道7例颅底术后残留脊索瘤SUVmax 2.1~3.5,推断代谢偏低可能与残留病变体积较小有关。然而,本研究发现颈椎原发性脊索瘤SUVmax与病灶大小无相关性,推测脊索瘤FDG代谢以中度增高为主,可能原因为:肿瘤细胞呈高度空泡样,细胞核有丝分裂较少,并与肿瘤细胞排列松散,间杂较多的黏液基质,常见坏死。颈椎脊索瘤往往难以整体切除,多以刮除为主,因此难以将病变的FDG代谢情况与组织病理结果进行精准对比分析。
本组患者多数(10/11)颈椎原发性脊索瘤FDG代谢不均匀。通过对比分析病变的FDG代谢与CT征象,发现高代谢灶可位于骨质破坏区或(和)椎旁肿块,尽管代谢不活跃区域可能含有较多的黏液基质或坏死组织,但不同代谢灶的密度差异并不显著。本组仅1例脊索瘤FDG代谢均匀,CT亦呈均匀性等密度。CT能够显示骨质破坏程度,评估脊柱稳定性,有助于制订手术方案;但组织分辨率较低[3]。尽管如此,由于大部分(6/7)椎管内病灶FDG代谢高于颈髓,PET/CT仍然能够显示脊索瘤椎管内侵犯。MRI可反映病变内部不同成分,清晰显示病变与周围结构的关系[3]。因此,PET/MRI理论上能够为颈椎脊索瘤的评估提供更多有价值的信息。
颈椎脊索瘤多为溶骨性破坏,可伴有邻近椎体或斜坡的累及、椎旁及椎管内侵犯,需要与转移瘤、骨巨细胞瘤、朗格汉斯细胞组织细胞增生症、结核、淋巴瘤等疾病鉴别。骨转移瘤常为多发,有明确的恶性肿瘤病史,或PET/CT发现原发恶性肿瘤。其他病变类型FDG代谢高于脊索瘤。骨巨细胞瘤、朗格汉斯细胞组织细胞增生症的平均SUVmax分别为10.15[12]和9.07[13],均较少累及邻近脊椎,且发病年龄低于脊索瘤。结核、淋巴瘤SUVmax分别为4.1~15.0和4.1~32.9[14];且脊柱结核多累及邻近椎体,伴椎旁冷脓肿;淋巴瘤大部分密度及代谢均匀,骨质破坏相对轻微。
脊索瘤可发生多器官转移,包括骨、淋巴结、脑、肺、胸腹膜、皮肤及皮下组织等,以肺和淋巴结转移最常见[8,15]。既往研究报道颅顶骨及盆腔软组织转移病灶FDG代谢均增高[15-16]。本组颈椎脊索瘤初诊PET/CT均未见转移征象,但1例患者随访过程中MRI发现骨转移。Evangelisti等[11]报道大部分(13/14)骶骨脊索瘤碳离子治疗后FDG代谢减低。亦有研究发现39%的患者全身治疗3个月后PET提示好转[3]。本组1例患者放疗后病变大小及FDG代谢均显著减低。此外,Derlin等[16]发现脊索瘤转移灶生长抑素受体显像阳性,提示核素靶向药物或可用于治疗转移性脊索瘤。
本研究的局限性为:本研究为回顾性分析,样本量较小,存在选择偏移等。
总之,颈椎原发性脊索瘤FDG代谢不均匀增高,呈溶骨性破坏,多位于C2椎体,常伴邻近骨质、椎旁及椎管内侵犯。PET/CT显像中符合以上征象的病变,支持脊索瘤的诊断。

