83例多发肺腺癌患者的临床病理学特征分析
彭子珊,孔 辉,鲍 真,赵红杏,刘 鑫,卢韶华
复旦大学附属中山医院病理科,上海 200032
肺癌是恶性程度较高的肿瘤之一,每年因肺癌死亡人数约1 600万人[1]。作为一种特殊类型的肺癌,多发肺癌(multifocal lung cancer,MLC)的发生率为1%~15%[2]。MLC又可分为多原发肺腺癌(multiple primary lung adenocarcinoma,MPLA)和肺内转移(intrapulmonary metastases,IM),而MPLA和IM的鉴别,对肿瘤分期及治疗有重要意义。1975年,Martini等[3]首次提出MPLA的鉴别标准。随后,Antakli等[4]在1995年提出了修订过的Martini-Melamed标准。美国胸科医师学会在2007年为Martini-Melamed标准增加了临床评估和分子分析[5]。本研究回顾性分析83例多发肺腺癌(multifocal lung adenocarcinoma,MLA)患者的临床病理学特征,根据病理形态学特征及基因突变情况来鉴别MPLA及IM,以提高临床和病理科医师对MPLA和IM的认识水平。
1 材料和方法
1.1 材料
收集2016年1月—2017年12月复旦大学附属中山医院收治的83例MLA患者进行分析。入组患者均有完整的临床病例资料,包括性别、年龄、吸烟史、手术方式、肿瘤数目、肿瘤位置、肿瘤最大径及生存情况等。TNM分期参考标准为美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版肺癌TNM分期,MLA位于同一肺叶时为T3期,MLA位于同侧肺但不同肺叶时为T4期,MLA位于对侧肺叶时为M1a期。随访数据通过查阅病历系统、电话联系等方式获得。
1.2 MLA双原发与转移的鉴别
1.2.1 病理学分析
所有H-E切片均由两名独立的病理科医师阅片,对肺腺癌亚型(贴壁型、腺泡型、乳头型、实体型及微乳头型等)进行独立评分,所占比例最大的亚型认为是主要亚型[6]。根据同一患者的不同肿瘤在石蜡切片上的形态学表现,参考Martini-Melamed标准,若多个病灶均观察到“贴壁型”到肺腺癌浸润的发展过程,则为MPLA;若无,且主要组织学亚型、次要组织学亚型均相似者判断为IM,主要组织学亚型、次要组织学亚型差异较大者判断为MPLA[7-8]。若有争议,则两名医师共同讨论或专家会诊后判定。
1.2.2 基因分析
所有患者均行9基因检测,具体包括表皮生长因子受体(epidermal growth factor receptor,EGFR)基因第18、19、20、21外显子突变、KRAS基因第2外显子突变、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因融合、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)基因第20外显子突变、NRAS基因第2、3外显子突变、BRAF基因第15外显子突变、ROS1基因融合、RET基因融合、PIK3CA基因第9、20外显子突变的检测。若两病灶存在1个及1个以上相同的基因突变,考虑为IM;若两病灶存在1个及1个以上不同的基因突变,则考虑为MPLA[9]。当形态学结论与基因分析结果不一致时,以基因分析结果为准;当两病灶均无基因突变时,采用组织学分析结果[8,10]。
1.3 统计学处理
2 结果
2.1 临床病理学特征
83例患者中,男性33例,女性50例。发病年龄为34~80岁,中位年龄(64.0±8.6)岁。68例患者为双病灶,14例患者为三病灶,1例患者为四病灶。62例患者有吸烟史。37例患者病灶位于同一肺叶,27例患者病灶位于同侧不同肺叶,19例患者病灶位于对侧肺叶。所有肿瘤均经手术切除且均为同时切除(表1)。

表1 83例MLA患者的临床病理学特征Tab.1 The clinicopathological features of 83 MLA patients[n (%)]
2.2 MPLA和IM的鉴别诊断
83例MLA患者根据病理形态学特征,50例(60.00%)判断为MPLA,33例(40.00%)为IM。在50例MPLA中,23例(46.00%)主要组织学亚型及次要组织学亚型差异较大,27例(54.00%)患者的多个病灶均观察到“贴壁型”到肺腺癌浸润的发展过程。1例MLA患者的两个病灶的组织学亚型均以筛状型为主(图1A、B),主要组织学亚型相似,因此组织学判断为IM;另1例MLA患者的一个病灶以乳头型及微乳头型为主(图1C),另一病灶以贴壁型为主,部分为腺泡型(图1D),主要组织学亚型及次要组织学亚型差异较大,因此组织学判断为MPLA。

图1 MPLA和IM患者的组织学形态Fig.1 Histological classification of MPLAs and IM patients
基因突变分析结果显示,83例MLA患者的182个病灶中,118个(68.84%)病灶检测出EGFR基因突变,15个(8.24%)病灶检测出KRAS基因突变,7个(3.85%)病灶检测出ALK基因突变,4个(2.20%)病灶检测出PIK3CA基因突变,3个(1.65%)病灶检测出HER2基因突变,2个(1.10%)病灶检测出BRAF基因突变,1个(0.55%)病灶检测出ROS1基因突变,1个(0.55%)病灶检测出RET基因突变,未检出NRAS基因突变。39例(46.99%)患者的多个病灶均有1个及1个以上相同的基因突变,因此鉴别为IM;其中多个病灶均发生EGFR第18外显子突变为1例,均发生EGFR第19外显子突变为12例,均发生EGFR第20外显子突变为2例,均发生EGFR第21外显子突变为21例,均发生KRAS基因第2外显子突变为1例,均发生ALK基因融合为1例,均发生HER2基因第20外显子突变为1例。35例(42.17%)患者的多个病灶存在1个及1个以上不同的基因突变,因此鉴别为MPLA。例如,1例66岁女性MLA患者,病灶1检测出KRAS基因第2外显子突变,病灶2检测出EGFR第19外显子突变,基因突变不相同,因此鉴别为MPLA。9例(10.84%)患者未检测出任何基因突变,鉴别结果以病理形态学分析结果为准。此外,18例(21.69%)患者的病理形态学分析结果与基因分析结果不一致,最终诊断以基因分析结果为准(表2)。其中6例患者形态学判断为IM,但病灶间存在一个以上差异的基因突变,因此结合基因分析结果判断为MPLA;其中2例病灶位于同一肺叶,3例病灶位于同侧不同肺叶,1例病灶位于对侧肺叶,并且2例出现复发。12例患者形态学判断为MPLA,但病灶间存在一个以上相同的基因突变,因此结合基因分析结果判断为IM;其中2例病灶位于同一肺叶,7例病灶位于同侧不同肺叶,3例病灶位于对侧肺叶,并且3例患者死亡,5例出现复发。结合病理形态学分析结果及基因突变分析结果,最终判断41例(49.00%)为MPLA,42例(51.00%)为IM。
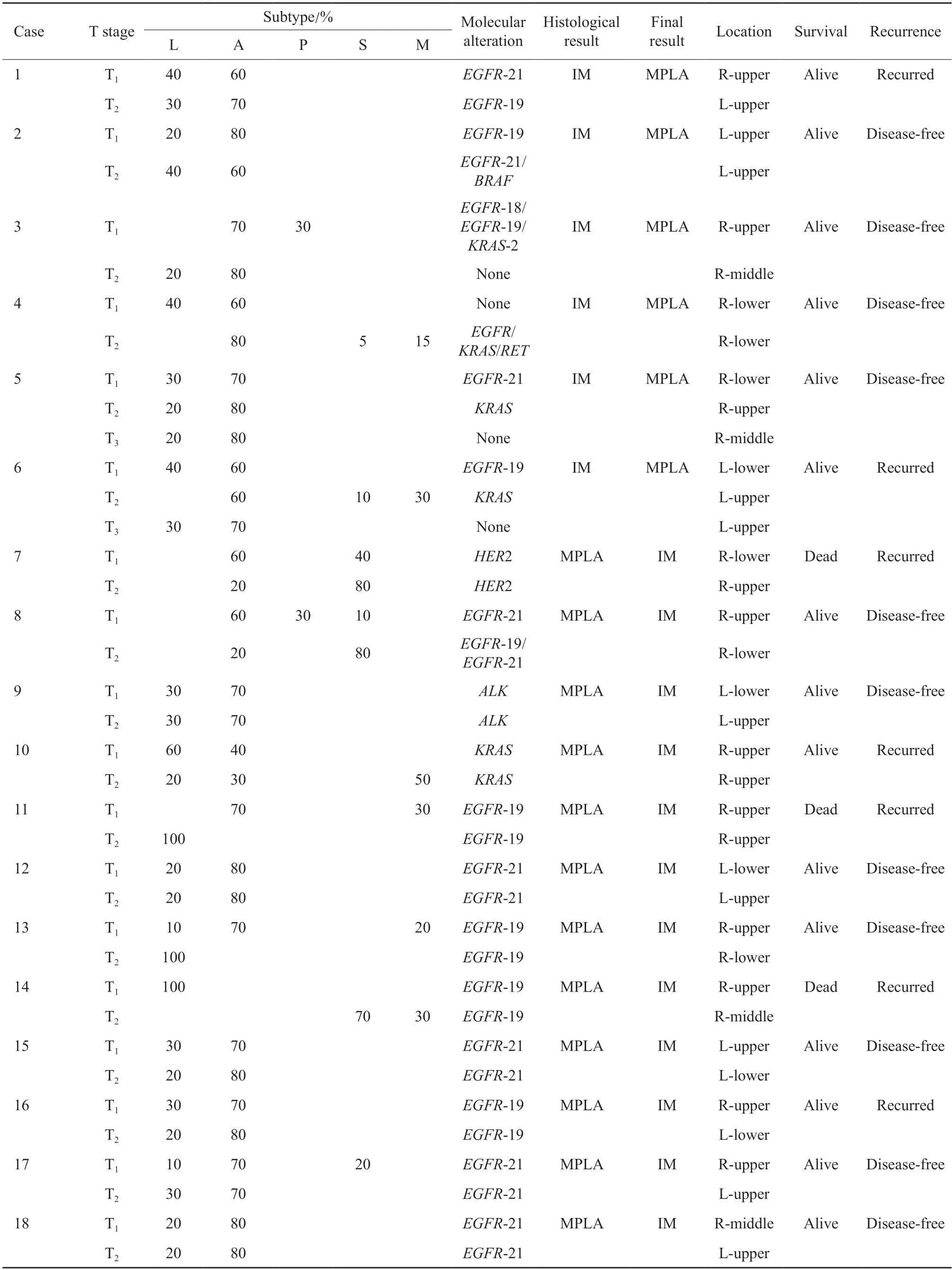
表2 18例病理形态学和基因突变结果不一致的MLA患者的病理学和遗传学信息Tab.2 Pathologic and genetic information of 18 cases of discordant patients according to histological and gene mutation results
2.3 预后分析
83例患者的末次随访时间为2021年2月,中位随访时间为46个月。至末次随访时,22例出现复发转移,10例死亡,3年OS率为93.98%,3年DFS率为77.11%。MPLA组中,5例出现复发转移,2例死亡,3年OS率为95.12%,3年DFS率为87.80%。IM组中,17例出现复发转移,8例死亡,3年OS率为80.95%,3年DFS率为59.52%。
本研究分别比较了病理形态学判断和结合基因分析判断两种情形下MPLA和IM的生存差异。在病理形态学判断的结果中,IM组患者OS率(图2A)和DFS率(图2B)均低于MPLA组,但差异无统计学意义(P>0.05)。结合基因分析后,MPLA和IM组间患者OS率差异无统计学意义(P>0.05,图2C),但DFS率差异有统计学意义(P=0.003,图2D),鉴别为IM的患者DFS率更差。根据淋巴结是否转移分组时,在N0及Nx状态下,IM组患者DFS率更差(P=0.016),OS率亦低于MPLA组,但差异无统计学意义(P>0.05);在N1及N2状态下,IM和MPLA组间患者OS率无明显差异,IM组患者的DFS率更差,但差异无统计学意义(P>0.05,图3)。对OS率和DFS率的单因素分析结果表明,男性(P=0.009)、淋巴血管侵犯(P=0.011)及EGFR野生型(P<0.001)是OS率的危险因素,淋巴管/血管侵犯(P=0.005)及综合标准鉴别为IM(P=0.004)是DFS率的危险因素(表3)。对OS率和DFS率的多因素分析结果表明,EGFR野生型(P=0.007)是OS率的独立危险因素,综合标准鉴别为IM(P=0.007)是DFS率的独立危险因素(表4)。此外,病理形态学分析在单因素和多因素分析中对患者OS率和DFS率的影响差异均无统计学意义(P>0.05),表明病理形态学是鉴别诊断MPLA和IM的重要手段,基因检测可作为重要的补充鉴别手段。
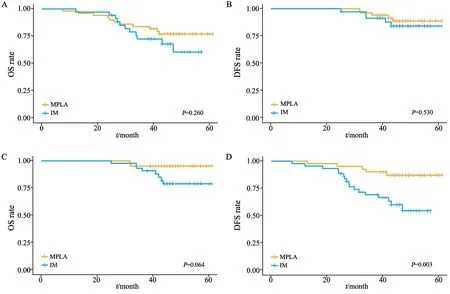
图2 病理形态学鉴别MPLA和IM的OS率(A)、DFS率(B)生存曲线图,病理形态学结合基因突变分析鉴别MPLA和IM的OS率(C)、DFS率(D)生存曲线图Fig.2 OS rate (A) and DFS rate (B) curves of patients with MPLA and IM diagnosed by histological analysis,OS rate (C) and DFS rate (D)curves of patients with MPLA and IM diagnosed by histological and gene mutation analysis
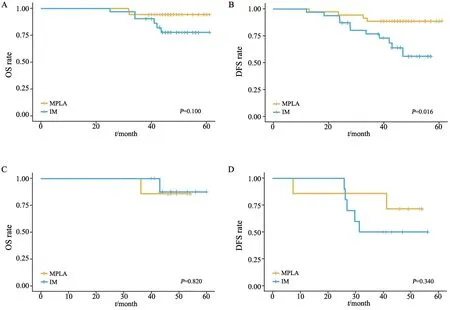
图3 综合鉴别MLC患者N0和Nx状态下MPLA和IM的OS率(A)、DFS率(B)生存曲线图,以及N1和N2状态下MPLA和IM的OS率(C)、DFS率(D)生存曲线图Fig.3 OS rate (A) and DFS rate (B) curves of N0 and Nx patients and OS rate (C) and DFS rate (D) curves of N1 and N2 patients with MPLA and IM diagnosed by histological and gene mutation analysis
表3 影响83例MLA患者预后的单因素分析Tab.3 Univariate analyses of prognostic factors in 83 MLA patients

续表 3
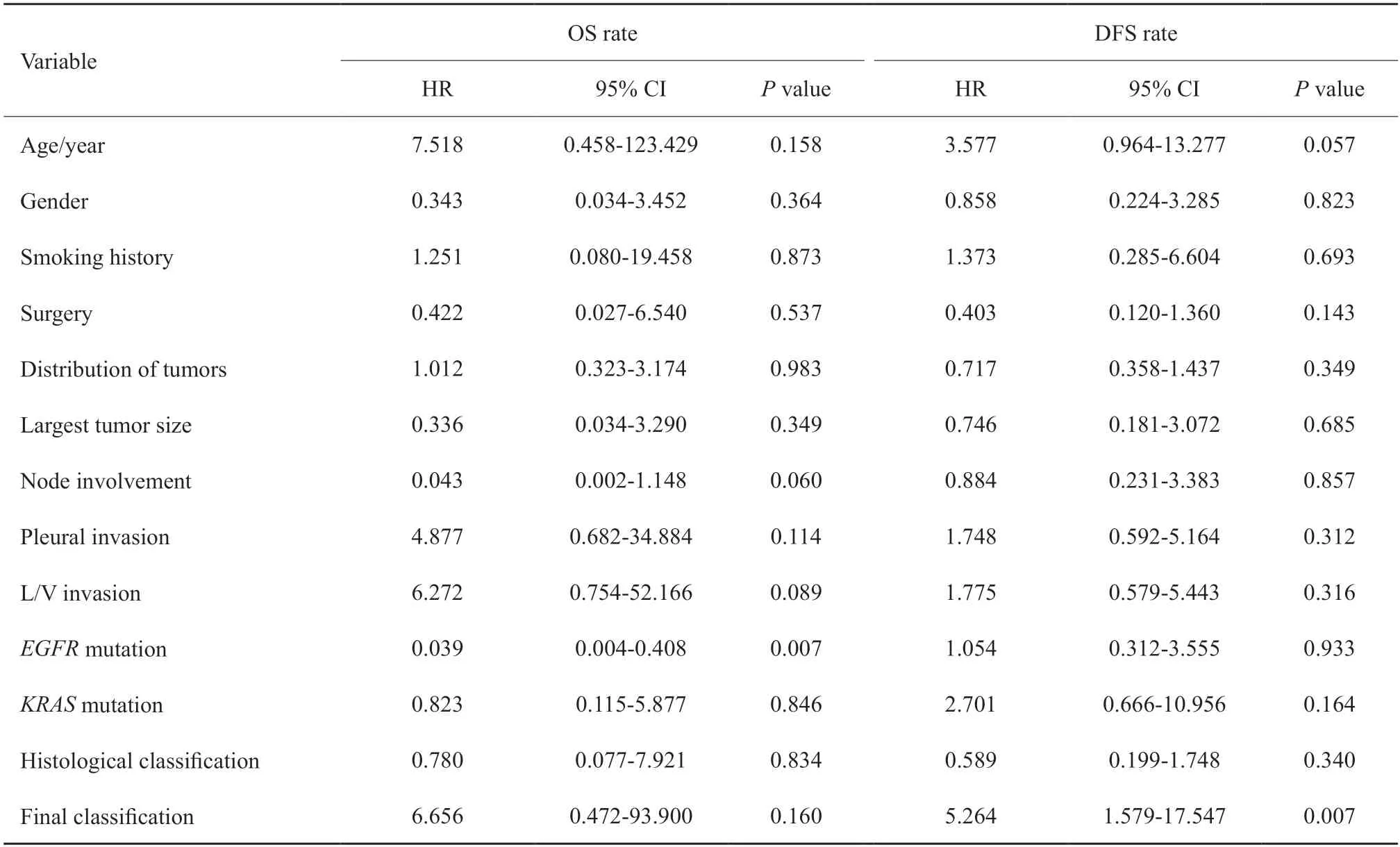
表4 影响83例MLA患者预后的多因素分析Tab.4 Multivariate analyses of prognostic factors in 83 MLA patients
3 讨论
1975年,Martini等[3]首次提出根据肿瘤部位及组织学类型来诊断MPLA的诊断标准。Martini-Melamed标准至今仍然被广泛使用,随后亦有多次修订,着重增加了肿瘤分子遗传学特征,同时兼顾多原发和转移的鉴别诊断[4-5,11]。但目前为止尚无明确的MPLA和IM的鉴别诊断标准。
Girard等[7]研究发现,全面的病理组织学分类分析方法可有效地鉴别诊断MPLA和IM。Sun等[12]研究发现,病灶含贴壁成分通常鉴别为原发病灶,该研究利用贴壁成分及全面的病理组织学分类对54例患者的116个病灶进行鉴别,发现多原发组的患者预后较好,表明差异较大的组织学亚型、贴壁成分为鉴别MPLA和IM的可靠依据。近年来,随着分子生物学技术的广泛应用,比较基因组杂交、微卫星分析及二代测序等在MLC的鉴别中发挥着重要作用。有研究[13]将具有相似分子生物学特征的病灶鉴别为IM,差异较大者鉴别为MPLA。Chang等[14]采用EGFR、TP53突变分析对58例多发非小细胞肺癌患者鉴别MPLA和IM,结果显示,28例为MPLA,22例为IM,8例无法鉴别。此外,Girard等[15]通过分析EGFR、KRAS、BRAF、PIK3CA和TP53的突变状态也有助于鉴别MPLA和IM。但采用多种方法鉴别MPLA和IM时,研究者发现部分病例基因分析与病理形态学分析结果存在差异。Murphy等[16]使用Martini-Melamed标准、二代测序对37例MPLA患者的76个病灶进行分析,其中有9例组织学诊断结果与二代测序基因分析结果差异明显。Chang等[8]利用病理组织学评估、二代测序进行MLC的鉴别,发现22%的病理组织学评估和二代测序结果不一致。此外,Nicholson等[17]阐述了综合病理学分析对MLA的鉴别意义,包括病理学亚型、细胞大小、核分裂象及坏死等。但众多研究一致发现,病理学形态判读具有主观性,即使资深的病理专科医师,病理学判读结果仍存在不一致性。而基因分析在MLC的鉴别中同样具有局限性,如原发性肿瘤和转移性肿瘤间存在异质性,病灶之间突变的相似性,并不表明确定的克隆关系[8]。上述研究表明,鉴别诊断MPLA和IM,需结合病理形态学及基因分析进行综合判断。本研究的83例患者中9例未检测出任何基因突变,鉴别结果以病理形态学分析结果为准;18例患者的病理形态学分析结果与基因分析结果存在差异,最终诊断以基因分析结果为准。
在预后分析中,本研究通过比较单独病理形态学判断和结合基因分析判断的两种情形下MPLA和IM患者的生存差异,进而比较两种方法对预后的指导意义。结果发现,若单独通过病理形态学判断,MPLA和IM组间OS率和DFS率差异无统计学意义,但结合基因分析后,MPLA和IM组间DFS率差异有统计学意义。此外,COX危险因素分析显示,单独病理形态学鉴别MPLA和IM并非OS率和DFS率的危险因素,但结合基因分析综合鉴别MPLA和IM是患者DFS率的独立危险因素,提示基因检测可作为两者鉴别的辅助方法以提高诊断效率,且对患者预后具有指导意义。
文献[8-9,14,18-25]提示,MLC中MPLA的比例为36%~88%,IM的比例为12%~64%。本研究依据病理组织学分析结果,60%的患者鉴别为MPLA,40%为IM。结合基因分析后,49%的患者鉴别为MPLA,51%为IM,与以往研究中的比例类似。此外,IM与多个病灶内均有微乳头成分[8]、KRAS野生型[6]、淋巴结转移[6,23]、吸烟[6,8,23]、肿瘤位置[6,9]等密切相关。多数研究[18,22,25-26]发现,MLC中诊断为IM的患者预后更差;但少数研究[6,27]发现,IM和MPLA的鉴别诊断对患者预后无显著影响。本研究结果显示,IM和MPLA的鉴别诊断对患者的OS率无显著影响,但对患者的DFS率影响显著。MLA患者若诊断为IM,术后更易发生复发转移。且若无淋巴结转移,IM患者更易出现复发,表明MPLA和IM的鉴别诊断在无淋巴结转移的患者中尤为重要。此外,对OS率和DFS率进行单因素和多因素分析发现,综合标准鉴别MPLA和IM与患者的OS率无关,但为DFS率的独立危险因素。综上,MLA患者术后准确检测EGFR状态对患者的OS率非常重要,综合病理组织学分析结果及基因分析结果鉴别诊断MPLA和IM对患者的DFS率非常重要。
随着高分辨计算机断层扫描(high-resolution computed tomography,HRCT)的普及,多发磨玻璃影(ground-glass opacity,GGO)结节的检出率逐步提高[28]。研究[29-30]发现,HRCT表现为GGO的MLC病灶转移倾向很小。Hattori等[31]报道,在多发GGO结节的患者中,未切除的<10 mm的纯GGO结节对患者的OS率无显著影响,定期随访即可。然而,Li等[32]通过对多发GGO结节进行二代测序发现,肺内的纯GGO结节也会发生转移。具有部分实性成分的GGO结节由于侵袭性更强,因此不论大小,均应选择手术切除[33]。Hattori等[34]报道,在MLC患者中,所有病灶均为实性结节、病灶同时有实性结节和混合GGO结节与病灶均为纯GGO结节相比,5年OS率差异有统计学意义,其中所有病灶均为实性结节的患者预后最差,病灶均为纯GGO预后最好。此外,无淋巴结转移的多发GGO结节患者,亚肺叶切除术的5年OS率与肺叶切除术差异无统计学意义[31]。
目前,MLC的鉴别诊断方法有多种,包括病理形态学分析、克隆分析、多个基因组合检测热点基因突变、全外显子测序及全基因组测序,但由于部分分子检测费用较大,目前尚不能普及应用,因此病理组织学特征仍是鉴别诊断MPLA和IM的重要手段,分子检测可作为鉴别的辅助方法以提高诊断准确率。本研究预后分析显示,诊断为IM的MLA患者术后复发风险更高,需定期复查和及时治疗。综上,MPLA和IM的鉴别诊断具有重要的临床意义,仍需要探索更可靠的鉴别诊断方法,为临床精准治疗及预后判断提供可靠依据。

