PD-1在肝细胞癌肿瘤浸润淋巴细胞中的表达及与预后的相关性
肖 锋,肖静文,邵建国,陈丽燕,顾春燕
1.南通大学附属南通第三医院,南通市第三人民医院病理科,江苏 南通 226006;2.南通大学附属南通第三医院,南通市第三人民医院消化科,江苏 南通 226006
目前原发性肝癌是中国第4位常见恶性肿瘤及第2位肿瘤致死病因,严重威胁中国人民的生命健康[1]。肝细胞癌(Hepatocellular carcinoma,HCC)是最常见的组织学类型。研究表明,HCC患者在肿瘤生长的免疫监测中常发现功能缺陷,其中的机制包括部分抗原掩蔽、抗原处理失败、效应细胞抑制和协同刺激不足[2]。
程序性死亡[蛋白]-1(programmed death-1,PD-1)是一种共抑制受体分子,在活化的T淋巴细胞和B淋巴细胞中被诱导表达,在调节外周免疫耐受中发挥重要作用[3-4]。程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)在树突状细胞、巨噬细胞和实质细胞中表达。有证据[5]表明,PD-L1可通过诱导T淋巴细胞凋亡、失能、无应答和功能衰竭,向表达PD-1的T淋巴细胞传递抑制信号,从而抑制免疫应答,因此PD-1/PD-L1在调节宿主免疫应答中发挥关键作用。然而,HCC肿瘤浸润淋巴细胞中PD-1的表达状态与肿瘤免疫主要效应细胞CD8+T淋巴细胞的关系尚不清楚,通过PD-1/PD-L1途径发挥免疫抑制作用的CD8+T淋巴细胞功能的变化仍有待阐明。因此,本研究旨在探讨PD-1在肿瘤浸润淋巴细胞中的表达情况,分析其表达状态与HCC临床病理学参数、PD-L1的表达、CD8+T淋巴细胞之间的相关性及与患者预后的相关性,采用免疫组织化学双标记法检测CD8+PD-1+双阳性T淋巴细胞密度对HCC患者预后的影响,旨在为HCC治疗提供一个潜在的免疫调节靶点。
1 资料和方法
1.1 病例资料
病例纳入标准:①2008年1月—2016年12月于南通市第三人民医院接受手术治疗的所有HCC患者;② 经病理学检查证实为HCC;③术前未接受任何抗肿瘤治疗;④ 有完整的临床及随访资料;⑤ 患者签署知情同意书;⑥ 通过医院伦理委员会批准。排除标准:①复发性HCC;② 术前接受介入、化疗等抗肿瘤治疗的患者。共入组344例患者,其中男性271例,女性73例。平均年龄55.3岁。乙型肝炎病毒表面抗原(hepatitis B virus surface antigen,HBsAg)阳性278例。有肝硬化289例。随访时间为8~114个月。
1.2 组织芯片的制备
组织芯片的制备由上海芯超生物科技有限公司协助完成。步骤为:对纳入病例的H-E染色病理切片重新阅片,标记H-E染色病理切片及对应蜡块上的代表性位置。用打孔仪在样本蜡块上打孔、细针吸取组织,按照排列顺序装载在芯片蜡块中。每例样本均设置3个复点。
1.3 免疫组织化学法检测
抗原修复采用高压修复法,在乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(pH=9.0)中消化3 min;之后将样本与H2O2一起温育15 min。采用EnⅤision免疫组织化学染色法:一抗分别为小鼠抗PD-1单克隆抗体(1∶100,北京中杉金桥生物技术有限公司)、兔抗PD-L1单克隆抗体[1∶50,基因科技(上海)股份有限公司]和兔抗CD8单克隆抗体(1∶100,北京中杉金桥生物技术有限公司),室温温育2 h,然后用辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔或山羊抗小鼠二抗(德国Leica公司)室温温育30 min,最后用二氨基联苯胺(diaminobenzidine,DAB)显色。
免疫组织化学双染色法:按稀释比例同时加入小鼠抗PD-1抗体和兔抗CD8抗体两种一抗,室温温育2 h后,滴加碱性磷酸酶(alkaline phosphatase,AP)标记山羊抗小鼠二抗和HRP标记的山羊抗兔二抗两种二抗,室温温育30 min;用GBI-久红显色5 min、冲洗,随后DAB显色5 min。用苏木精复染。
1.4 结果判定
肿瘤浸润淋巴细胞中PD-1的存在表现为为细胞膜或细胞质染色:依据参考文献[6]的方法,用组织芯片计数PD-1+淋巴细胞数量,然后根据PD-1+细胞计数,大于中位数判为高表达组,小于等于中位数判为低表达组。
肿瘤细胞和肿瘤浸润淋巴细胞中PD-L1通过评估染色细胞的百分比(PD-L1阳性肿瘤细胞数/所有肿瘤细胞数或PD-L1阳性肿瘤浸润淋巴细胞数/所有肿瘤浸润淋巴细胞数)来量化。当≥1%的肿瘤细胞中PD-L1呈阳性反应时,肿瘤细胞被判定为PD-L1阳性表达,判断标准为肿瘤细胞的细胞膜或细胞质部分或完全染色。肿瘤浸润淋巴细胞中PD-L1阳性表达判断标准为细胞膜或细胞质染色阳性细胞数≥1%[7]。
肿瘤浸润CD8+T淋巴细胞密度、CD8+PD-1+双阳性T淋巴细胞密度判定:计数组织芯片各点CD8+淋巴细胞、CD8+PD-1+双阳性细胞数量,计算免疫反应细胞的平均计数,大于平均计数判为高密度组,小于等于平均计数判为低密度组。
结果由两名高年资病理科医师采用双盲法评估,可疑病例由两名医师使用多头显微镜讨论,直到达成共识。
1.5 统计学处理
采用SPSS 19.0软件进行统计学分析。PD-1表达与临床病理学参数等之间的相关性用χ2检验评价。采用Kaplan-Meier法计算总生存率并绘制生存曲线,组间比较用log-rank检验。采用单因素和多因素COX回归分析判断是否为独立预后因素。P<0.05为差异有统计学意义。
2 结果
2.1 PD-1在HCC肿瘤浸润淋巴细胞中的表达及与临床病理学参数的关系
免疫组织化学染色显示,PD-1表达于HCC肿瘤浸润淋巴细胞的细胞膜或细胞质中(图1),肿瘤浸润淋巴细胞中PD-1的阳性率为43.9%(151/344)。PD-1高表达与肿瘤组织学分级有关(P=0.009,表1),与年龄、性别、HBsAg、肿瘤大小、有无肝硬化及微血管侵犯等临床病理学参数无明显相关性。
2.2 PD-1在HCC肿瘤浸润淋巴细胞中的表达与PD-L1表达、肿瘤浸润CD8+T淋巴细胞密度的关系
肿瘤细胞中PD-L1的阳性率为21.8%(75/344),肿瘤浸润淋巴细胞中PD-L1的阳性率为47.1%(162/344),肿瘤浸润CD8+T淋巴细胞高密度率为45.3%(156/344)。PD-1高表达与肿瘤细胞中PD-L1的表达(P<0.001)、肿瘤浸润淋巴细胞中PD-L1的表达(P<0.001)及肿瘤浸润CD8+T淋巴细胞密度相关(P=0.003,图1,表1)。
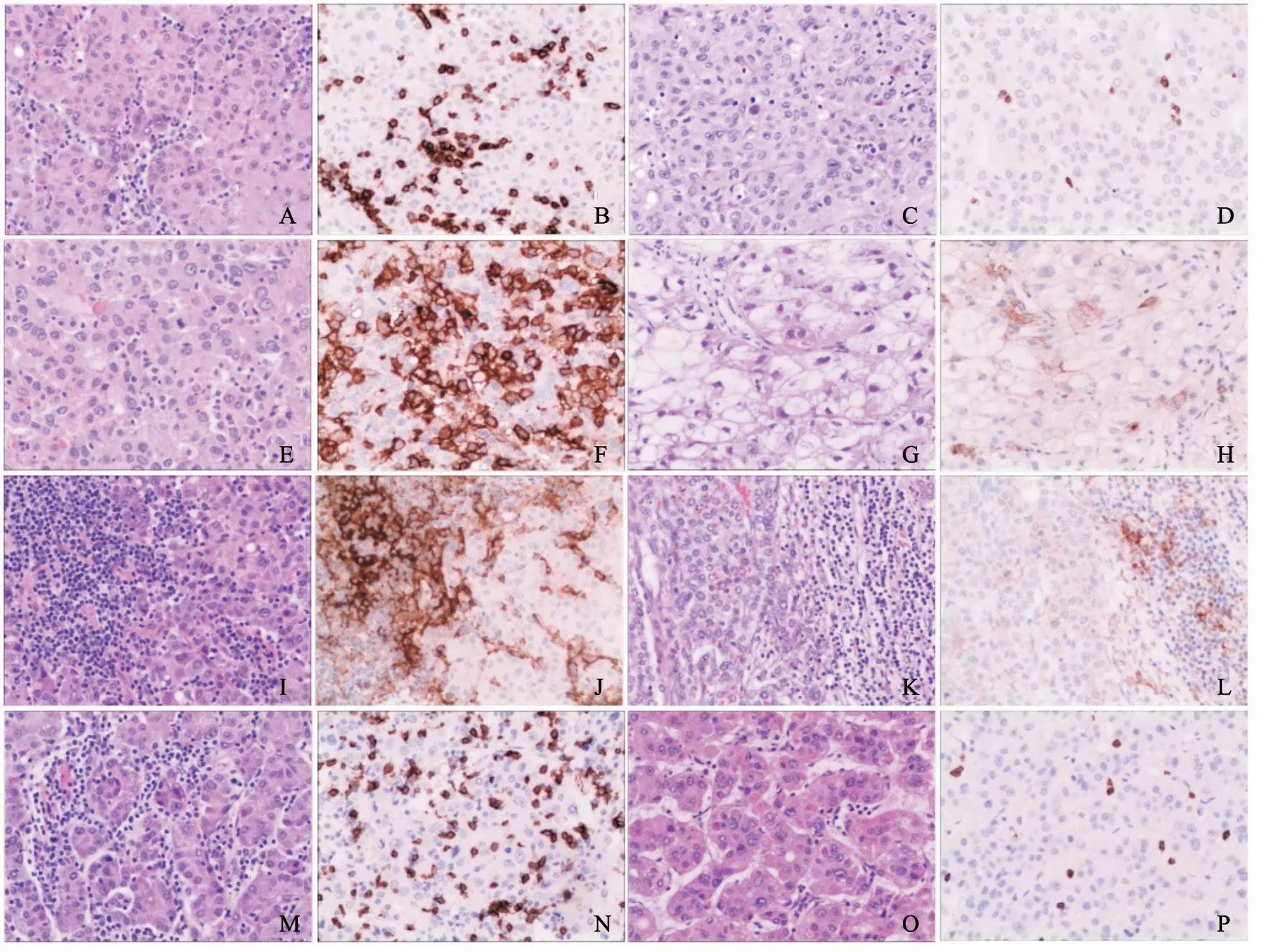
图1 免疫组织化学法标记PD-1、PD-L1和CD8的表达情况Fig.1 Expressions of PD-1,PD-L1 and CD8 detected by immunohistochemistry
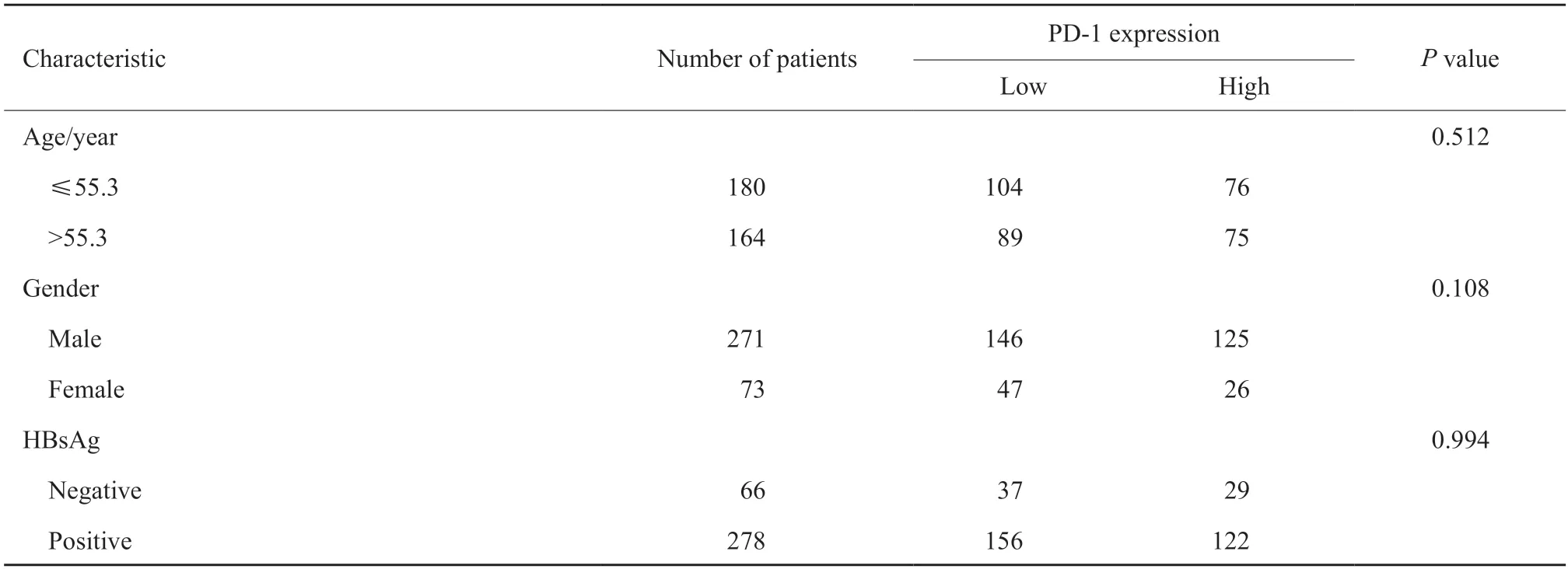
表1 PD-1的表达与HCC患者临床病理学参数、PD-L1表达及肿瘤浸润CD8+ T淋巴细胞的关系Tab.1 Relationship between PD-1 expression and clinicopathological parameters,PD-L1 expression and tumor-infiltrating CD8+ T lymphocytes in HCC patients(n)
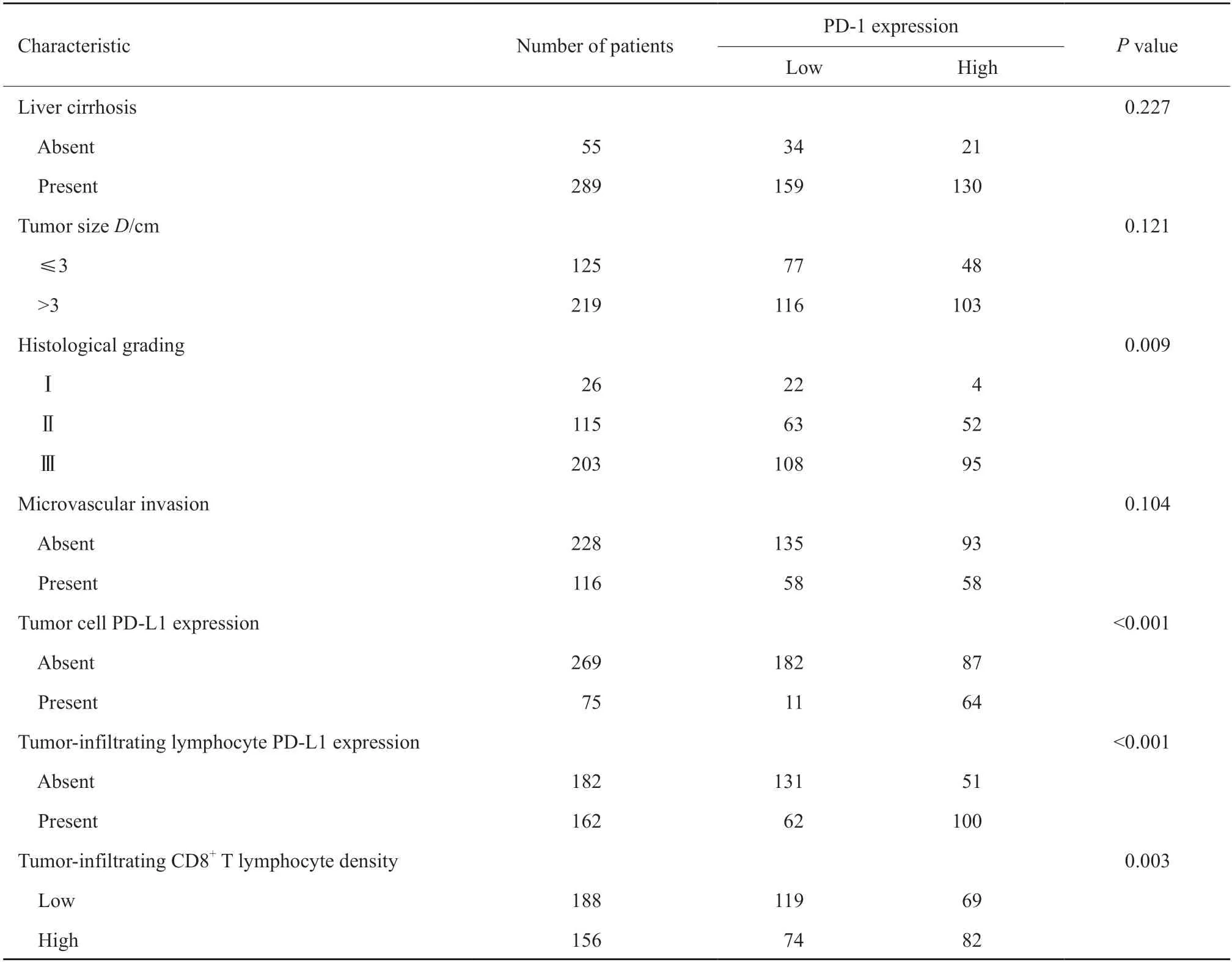
续表 1
2.3 PD-1高表达与HCC预后的关系
Kaplan-Meier生存分析显示,PD-1高表达组HCC患者的OS和DFS较PD-1低表达组明显降低(P均<0.001)。单因素COX回归分析显示,肿瘤浸润淋巴细胞中PD-1高表达是OS和DFS的不良预后因子(OS:HR=2.344,P<0.001;DFS:HR=2.750,P<0.001),肿瘤>3 cm、组织学分级高、有微血管侵犯及肿瘤细胞中PD-L1的表达是OS和DFS的不良预后因子,并且低密度肿瘤浸润CD8+T淋巴细胞是DFS的不良预后因子。为评估可能存在的混杂变量,对单变量COX比例风险分析中达到显著性的因素,以及具有临床意义的指标HBsAg、肝硬化等因素采用多变量COX回归分析,结果显示,肿瘤浸润淋巴细胞中PD-1高表达是OS和DFS的独立不良预后因子(OS:HR=1.654,P=0.010;DFS:HR=2.518,P<0.001,图2,表2~3)。
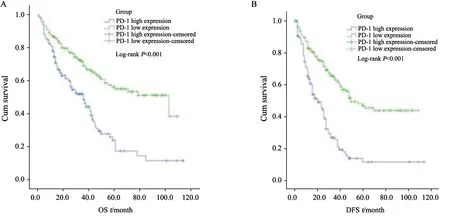
图2 PD-1的表达水平对HCC患者预后的预测价值Fig.2 The prognostic value of PD-1 expression in HCC patients
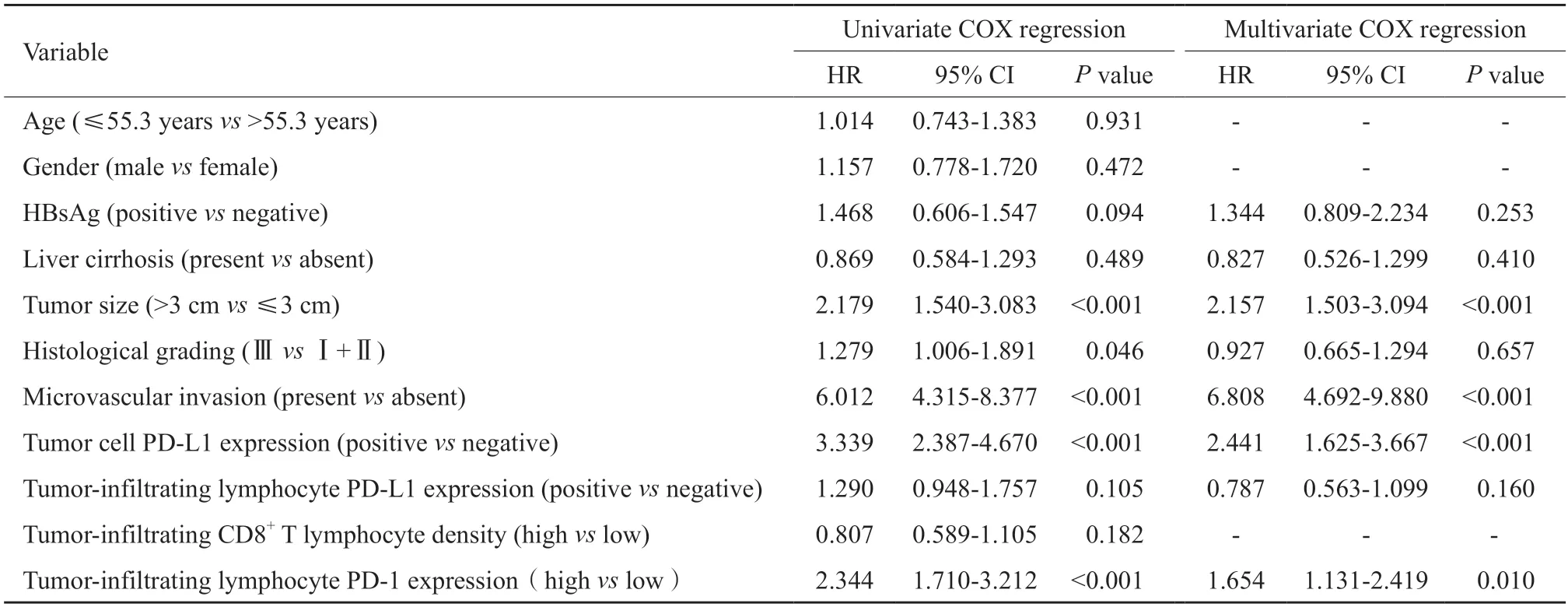
表2 单因素和多因素COX回归分析OS预测因子Tab.2 Univariate and multivariate COX regression analyses of OS predictors
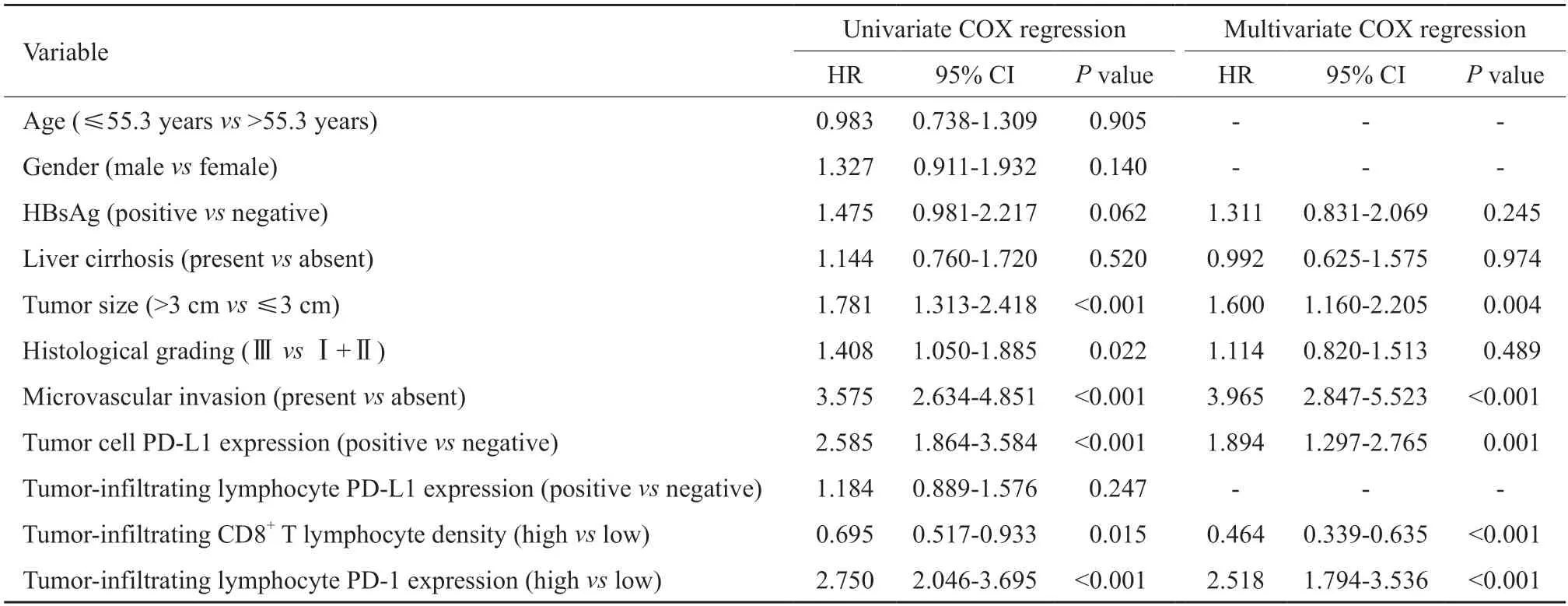
表3 单因素和多因素COX回归分析DFS预测因子Tab.3 Univariate and multivariate COX regression analyses of DFS predictors
2.4 肿瘤浸润CD8+ PD-1+双阳性T淋巴细胞密度对HCC预后的影响
肿瘤浸润CD8+T淋巴细胞对肿瘤患者生存的影响一直备受关注。有研究表明,肿瘤浸润CD8+T淋巴细胞密度与多种实体瘤类型的良好预后相关[8-9],也与化疗和免疫治疗反应的改善相关[10]。本研究数据显示,高密度肿瘤浸润CD8+T淋巴细胞组DFS较低密度组明显改善(P<0.001),并且OS亦优于低密度组,但差异无统计学意义(P>0.05)。进一步对高密度肿瘤浸润CD8+T淋巴细胞组HCC患者用免疫组织化学双染色法检测CD8+PD-1+双阳性肿瘤浸润T淋巴细胞的密度,结果显示,高密度CD8+PD-1+T淋巴细胞组较低密度组OS和DFS更差(P均<0.001,图3~4)。
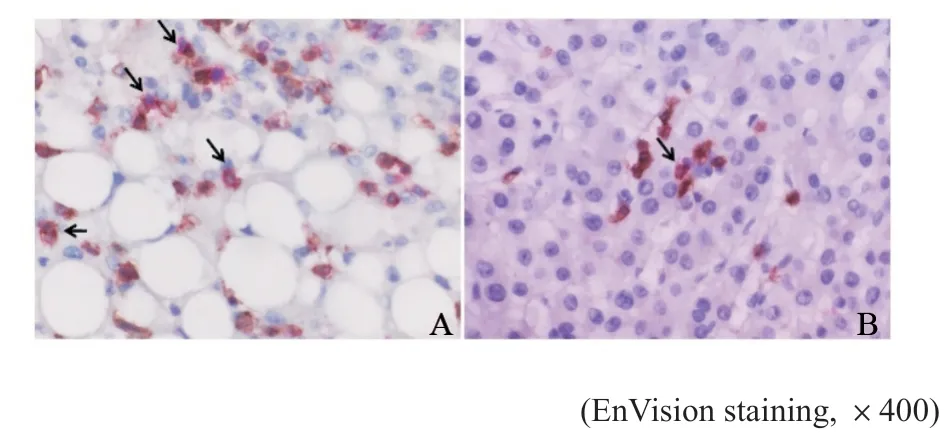
图3 免疫组织化学双标记CD8(棕色)、PD-1(红色)染色Fig.3 Immunohistochemical double labeled CD8 (brown) and PD-1 (red) staining
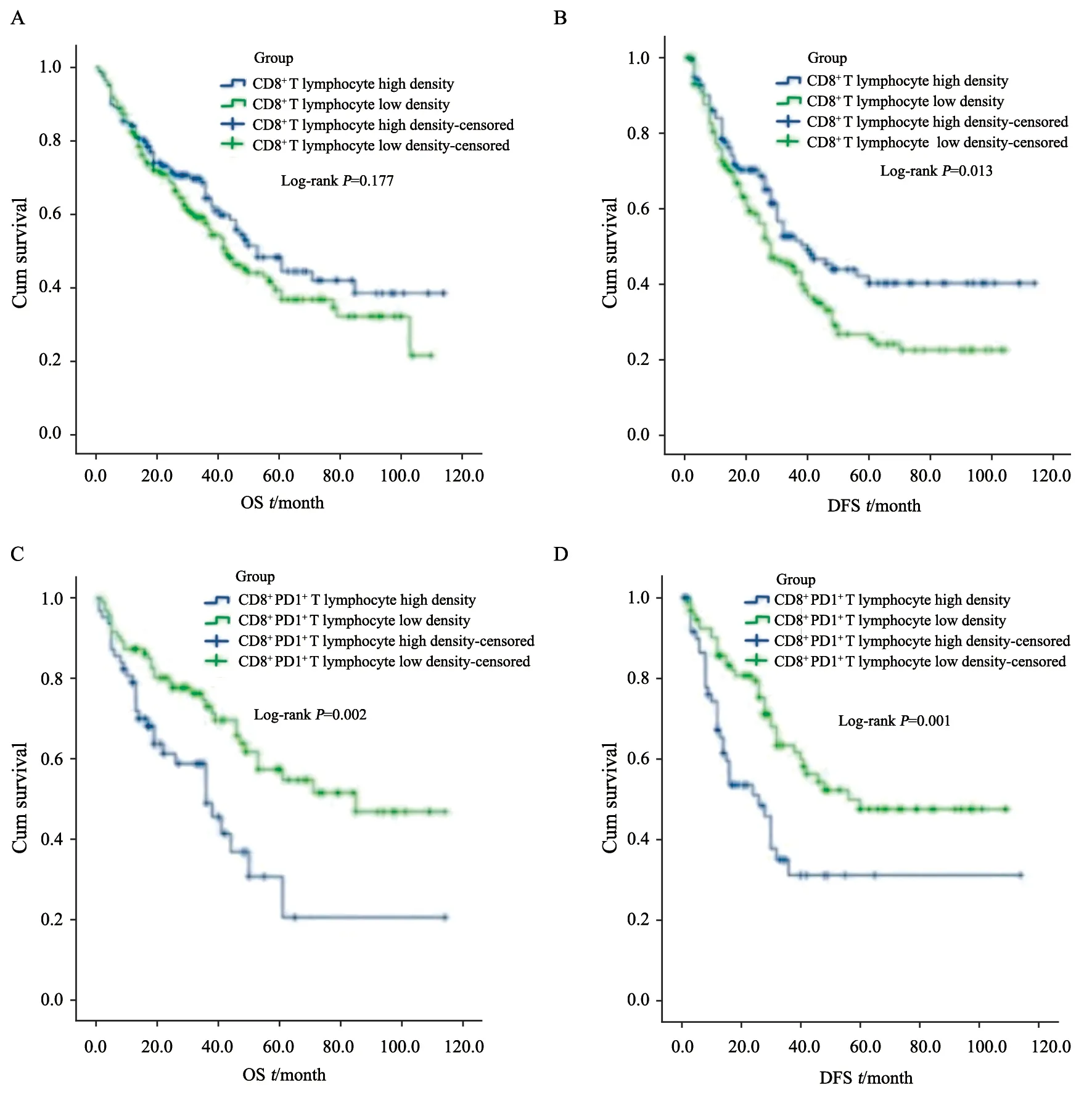
图4 CD8+ PD-1+双阳性T淋巴细胞密度对HCC患者预后的预测价值Fig.4 The prognostic value of CD8+ PD-1+ double expression T lymphocyte density in HCC patients
3 讨论
本研究检测了HCC患者肿瘤浸润淋巴细胞中PD-1的表达情况,结果显示,PD-1高表达与肿瘤组织学分级、肿瘤细胞中PD-L1的表达、肿瘤浸润淋巴细胞中PD-L1的表达及肿瘤浸润CD8+T淋巴细胞密度有关,同时PD-1高表达是OS和DFS的不良预后因子。此外,肿瘤浸润CD8+PD-1+T淋巴细胞的增加可以预测疾病进展和术后复发。
HCC通常是在慢性肝病(慢性乙型肝炎或丙型肝炎病毒感染、代谢紊乱或慢性乙醇性肝损害)的基础上发展而来的,因其促进了肝脏的免疫抑制状态和T淋巴细胞功能衰竭[11]。在肿瘤的发生、发展过程中,肝脏微环境中有效的抗肿瘤免疫监视功能受损,免疫检查点尤其是PD-1/PD-L1信号通路参与了这一过程[12]。
有研究[13]显示,在非小细胞肺癌患者肿瘤组织中,高密度肿瘤浸润PD-1+T淋巴细胞组比低密度组有更高的肿瘤识别能力和明显不同的预后,其中高密度PD-1+T淋巴细胞能预测患者的治疗反应和存活率。在HCC患者中,PD-1在CD8+T淋巴细胞中的表达增加与术后复发有关[14];在未经免疫治疗的HCC患者中,循环和肿瘤浸润CD8+PD-1+T淋巴细胞的密度增加与肝切除术后的进展相关[15],这与本研究结论一致。同时,表达PD-1的肿瘤浸润T淋巴细胞的数量被证明可以预测PD-1阻断后的临床治疗效果[16],并且肿瘤对PD-1阻断的反应取决于预先存在的CD8+T淋巴细胞的状态,这些细胞受到PD-1/PD-L1介导的适应性免疫抵抗的负调节[17]。
对于HCC患者中PD-1/PD-L1通路在CD8+T淋巴细胞和肿瘤细胞之间的作用机制尚不清楚。有研究[18-19]显示,HCC肿瘤浸润CD8+T淋巴细胞中PD-1不同表达水平的亚群具有不同的基因表达模式,高表达PD-1的CD8+T淋巴细胞亚群具有高水平的调节T淋巴细胞衰竭的基因模式,其通过产生低浓度的γ-干扰素和肿瘤坏死因子发挥功能,用抗PD-1的抗体温育该亚群细胞可部分恢复细胞因子的产生,因而具有高表达PD-1的CD8+T淋巴细胞亚群的HCC患者可能对于免疫检查点阻断剂的联合治疗效果更为明显,同时,PD-L1在HCC中的表达可抑制T淋巴细胞在微环境中的功能,本研究显示,肿瘤细胞中PD-L1高表达为HCC患者复发的预测因子,这与之前的研究结论[20]一致。对HCC切除术后标本的分析显示,PD-L1高表达与未进一步接受过免疫治疗的患者的肿瘤侵袭性和预后不良有关[21]。
综上所述,PD-1在肿瘤浸润淋巴细胞中显著上调,尤其是在效应CD8+T淋巴细胞中。这种PD-1表达的增加可能是HCC患者预后不良的原因。进一步通过多变量分析来证实PD-1+和CD8+PD-1+免疫浸润T淋巴细胞的预后价值,并强调与HCC肿瘤细胞中PD-L1表达的显著相关性。这些发现拓展了我们对HCC患者抗肿瘤反应过程中HCC细胞与CD8+T淋巴细胞间PD-1/PD-L1相互作用的认识。

