小鼠不同频率轻型TBI后脑组织tau蛋白的毒性差异研究
程兴滕,尹亚东,张 赛,孙中磊
(1.枣庄矿业集团滕南医院,山东 枣庄 277000;2.枣矿集团中心医院,山东 枣庄 277100;3.武警后勤学院附属医院 脑科研究所,天津 300162)
颅脑创伤(Traumatic brain injury,TBI)导致认知功能障碍的发生率不断上升,其引发的神经退行性变机制多种多样,例如,弥漫性轴索损伤破坏微管功能,为tau和淀粉样蛋白病的发展提供了潜在的环境。大量的研究表明,tau低聚物与TBI后的神经变性和记忆障碍相关[1-3]。tau低聚物还被证明与突触功能障碍、变形和随之而来的慢性神经突触损伤有关[4]。由于不同类型TBI后脑组织tau低聚物的生化特性及毒性特性仍不清楚,因此对于研究TBI后的tau低聚物与神经变性和记忆障碍对应的联系至关重要。本研究利用小鼠爆炸损伤TBI模型探索和表征单次轻度颅脑创伤(Single mild traumatic brain injury,sTBI)和重复性轻度颅脑创伤(Repeat mild traumatic brain injury,rTBI)小鼠大脑中的tau低聚物,研究tau低聚物的结构差异和毒性差异。
1 材料与方法
1.1 实验动物与主要材料 野生型C57BL / 6雄性小鼠32只,6月龄,体重(28±2.5)g,新生24 h内C57BL / 6小鼠32只,购买自北京维通利华。人神经母细胞瘤SH-SY5Y细胞(天津医科大学分子生物实验室惠赠);硝酸纤维素膜(上海博亚公司,中国); TOMA1、T22、Tau-5、突触后标记物(PSD95)、突触前标记物(Synaptophysin)、突触树突标记物(Drebrin)、β-action购自美国abcam公司;重组R40-tau购自美国cayman公司;其余试剂如非特殊说明均由当地试剂商提供。
1.2 动物模型及分组 将小鼠置于PVC管中,头部从一端伸出,使用1%~4%的异氟烷麻醉小鼠后用20 psi冲击波射向头部以产生TBI[5-6]。将小鼠随机分为4组,每组8只: SB-24 h组:单次爆炸后24 h组; SB-3周组:单次爆炸后3周组; RB-3周组:反复爆炸后3周组,是在第1、3、5、7、9和12天完成6次爆炸; sham组:假TBI后3周组,小鼠置于与其他组相同的条件下,但没有爆炸。在实验结束的各时间点取脑组织,使用tau低聚物特异性T22抗体进行快速蛋白脂质色谱(FPLC)免疫沉淀分离可溶性tau低聚物。
1.3 细胞培养 配制 DMEM 培养液,将SH-SY5Y细胞培养在10% FBS 的DMEM中。将培养箱中的平皿拿出,加入 10 mL 完全 DMEM 培养液,小心不要让培养液冲掉细胞,待细胞铺满瓶底 80%时,按1∶3 的比例进行传代,继续培养、扩增。海马神经元细胞提取自新生24 h内的小鼠8只。其提取方法如下:小鼠浸泡于浓度为75%的乙醇中消毒,断头处死,逐层暴露脑组织,取海马组织。体式显微镜下仔细剥离附着于海马组织表面的微小血管,并检查是否有红色絮状组织残留。将所得海马组织放入含有800 μL 取材培养基的EP管中,用眼科镊剪碎成小于1 mm的组织块。然后向EP管中加入200 μL的2.5%胰酶,在37 ℃消化15 min,然后吸取组织在洗脱培养基里转移3遍,用1 mL移液枪反复吹打,直至不见明显的组织块。然后将EP管放入离心机,1 000 rpm、5 min,弃上清后加入接种培养基重悬细胞。通过血球计数板计算细胞数量,以文献常用的细胞量8×104/cm2的密度进行接种。接种4 h后全量更换为神经元维持培养基,后续每隔3 d半量换液。
1.4 tau低聚物制备 取小鼠大脑,每个实验组的脑组织都用数字随机编码后,并从前额叶皮层区域免疫沉淀获取tau低聚物。从接受单次和重复爆炸的大脑中获得了免疫沉淀的低聚物。根据寡聚分离物的浓度、分子量和PK消化曲线进行选择。具体如下[7-8], 30 μL甲苯磺酰基活化的免疫磁珠用20 μg抗tau低聚物特异性多克隆抗体T22(1.0 mg / mL)包被,并在50 μL 0.1 mol/L硼酸溶液(pH 9.5)中稀释,以保持珠浓度为20 mg/mL。将珠粒在37 ℃下保持过夜,然后洗涤珠子(0.2 mol/L Tris-HCl,0.1%牛血清白蛋白,pH 8.5),与100 μL的TBI脑匀浆[磷酸盐缓冲液(Phosphate Buffer solution ,PBS)混悬物]孵育,在室温下旋转1 h。然后将珠子用PBS洗涤3遍并用pH 2.8的0.1 mol/L甘氨酸洗脱,在amicrocon离心过滤装置中离心。在4 ℃下以14 000 g 离心25 min,截取分子量值为25 kDa。将低聚物重悬于无菌PBS中,并使用二辛可宁酸蛋白测定法测量蛋白浓度。将样品再次在amicrocon离心过滤器设备中(截取25 kDa)在4 ℃下以14 000 g离心25 min,储存在-80 ℃备用[7,9]。
1.5 tau低聚物扩增 通过将冻干的重组4R-Tau沉淀物以1 mg / mL的浓度溶解在PBS中获得的重组4R-Tau单体[53]接种TBI脑源性tau寡核苷酸。在室温下旋转4 h,以1∶100(w/w)的比例制备低聚物-单体混合物。每次接种后,均取等分取样并立即用于蛋白质印迹分析,以确保维持质量。
1.6 MTT和乳酸脱氢酶测定 SH-SY5Y细胞和原代神经细胞分组为sham组、RB-3周组、SB-24 h组、SB-3周和4R-Tau组,分别用对应的tau低聚物0.5 μmol/L处理24 h。按照试剂说明,使用MTT测定法测定细胞活力,使用乳酸脱氢酶(LDH)测定细胞毒性。
1.7 分离突触小体 原代神经细胞分组为sham组、Untreated组、RB-3周组、SB-24 h组、SB-3周和4R-Tau组,用对应的tau低聚物0.5 μmol/L处理24 h。使用Syn-PER试剂按照试剂使用说明书分离包含突触前、突触后和树突标记的突触小体。从新生24 h的C57/B6小鼠24只,分离出完整的海马组织,并将其与手中的每个寡聚样品一起在人工脑脊液中充气孵育1 h。孵育后,将组织在Syn-PER试剂(1 mL Syn-PER/100 mg组织)以及蛋白酶和磷酸酶抑制剂中匀浆。使用组织研磨器将海马组织研磨10次,并将悬浮液以1 200 g离心10 min。收集上清液,然后以15 000 g在 4 ℃下离心20 min,随后将含有所需突触小体的沉淀重悬于HEPES缓冲的Krebs缓冲液中,进行蛋白质免疫印迹分析。
1.8 Western blot分析 每个样品10 μg上样在预制的十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳分离蛋白质,电泳后半干转移到硝酸纤维素膜上。然后将膜用在含0.1%牛血清白蛋白磷酸盐缓冲盐水(PBS)在室温下将膜封闭1 h。PBST洗涤后与PBST中的一抗4 ℃孵育过夜: TOMA1(1∶10 000)、T22(1∶10 000)、Tau-5(1∶10 000)、PSD95(1∶10 000)、Synaptophysin(1∶10 000)、Drebrin(1∶10 000)、重组R40-tau (1∶10 000)和β-actin(1∶10 000)。PBST洗涤后将膜与山羊抗兔二抗(1∶2 000)在室温下孵育2 h。PBST洗涤使用增强的化学发光系统(ECL试剂盒)检测免疫反应性条带,并使用ImageJ 1.42q软件程序分析图像。
1.9 统计学分析 使用Prism 7.0软件(GraphPad)进行数据分析。样本采用单因素方差分析,两两比较采用LSD检验,P<0.05被认为具有统计学意义。
2 结果
2.1 单次和重复的TBI小鼠大脑tau低聚物的生化特性不同 实验结果表明,3种检测试剂RB-3周组tau低聚物与sham组相比均表现出明显差异,其差异具有统计学意义(P<0.05),而其他组与sham组相比没有明显差异(P>0.05,见图1A,表1)。FPLC色谱图表明,tau低聚物表现出不同的尺寸分布曲线。SB-24 h、SB-3周和sham组tau低聚物的主峰在75至150 kDa之间,对应于二聚体和三聚体,另外还有一个小的单体对应峰。RB-3周中的主峰对应于三聚体及以上(150~250 kDa,见图1B)。

图1 各组tau低聚物表达量及FPLC色谱峰值
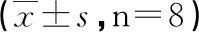
表1 各组蛋白相对含量
2.2 RB-3W组tau低聚物毒性最强 SH-SY5Y 的MTT、LDH实验结果显示,与sham组低聚物相比RB-3周和4R-Tau组显示出明显的细胞毒性和细胞死亡率(P<0.05),而SB-24 h和SB-3周组与sham组没有差异(P>0.05,见表2)。tau低聚物分别用T22和TOMA1抗体进行了预孵育,结果与无抗体孵育组相比与T22 和TOMA1预孵育后,RB-3周组细胞生存力均显著提高(P<0.05)。在原代神经元培养物中重复MTT、LDH实验,结果与sham组低聚物相比RB-3周和4R-Tau组显示出明显的细胞毒性和细胞死亡率(P<0.05,见表2)。
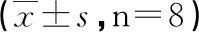
表2 实验各组tau低聚物毒性检测
2.3 sTBI和rTBI诱导功能不同的tau低聚物的形成 与未处理组相比突触提取物Synaptophysin水平在RB-3周和4R-Tau组降低, PSD95水平在TBI各组均降低, Drebrin水平仅在RB-3周组降低(P<0.05),而与sham相比,仅RB-3周组可引起PSD95和Drebrin水平的降低(P<0.05,见图2,表3)。
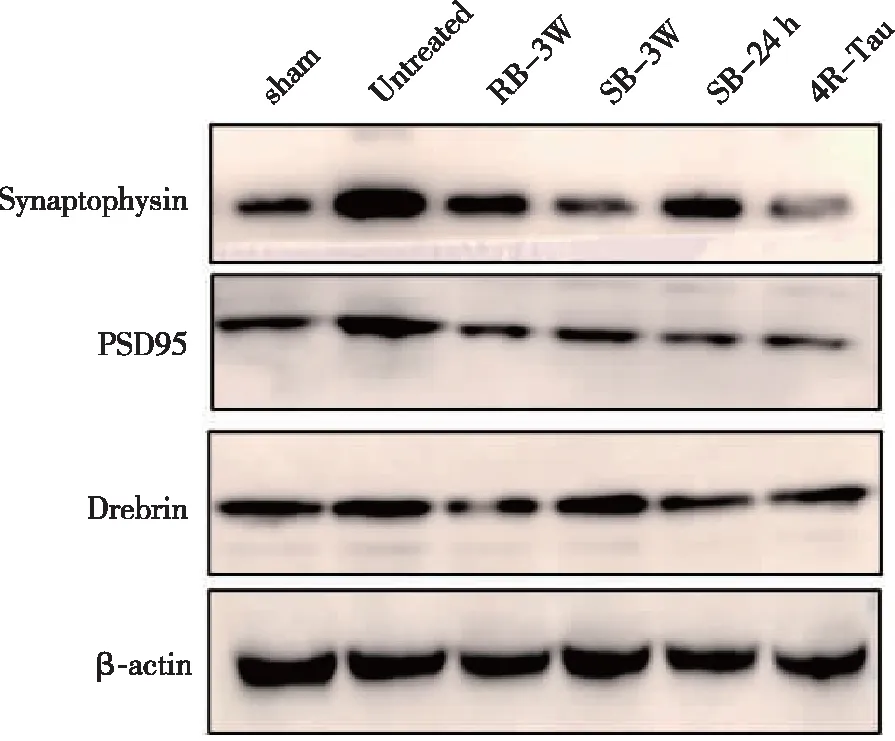
图2 PSD95,Synaptophysin,Drebrin和β-actin免疫印迹条带
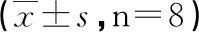
表3 各组蛋白相对含量
3 讨论
既往的研究表明,从爆炸后72 h开始,轻度爆炸(小鼠承受冲击力为20 psi)会破坏皮质的血管完整性和血脑屏障,爆炸还引起皮质中星形胶质细胞反应性和神经胶质原纤维酸性蛋白表达的增加,以及氧化应激标志物和tau低聚物水平的增加(对T22有反应)[5]。还有研究表明,在爆炸一次后3周和重复爆炸1个月后的脑组织分析结果显示两组的磷酸化tau病理学(AT8)和tau构象变化标记物(CP13)均显著增加,在时间上与sTBI和rTBI诱导的记忆力和认知缺陷重叠[5-6]。这种差异性的风险可能归因于tau蛋白的多态性。为此,本研究从野生型sTBI和rTBI小鼠大脑中分离tau低聚物,以检测其在不同类型TBI后观察到的神经变性差异的机制。
本研究发现RB-3周组在不同tau低聚物抗体(tau-5、T22 、TOMA1)检测中均表现出明显差异,而其余各组与sham组相比均未见明显差异,并且FPLC色谱图分析表明tau低聚物表现出不同的尺寸分布曲线,RB-3周组峰值与其它各组存在差异。为了进一步评估sTBI和rTBI小鼠脑组织tau低聚物的毒性差异,本研究采用tau低聚物(0.5 mM/L)与SH-SY5Y细胞和原代神经元(来自C57BL / 6野生型小鼠)共培养,结果表明,RB-3周组tau低聚物毒性最强,为了明确这种毒性作用是tau低聚物介导的,本研究将5种TBI脑源性tau低聚物分别用T22和TOMA1抗体进行了预孵育,结果RB-3周低聚物与T22 和TOMA1预孵育后细胞生存力均显著提高。这些研究结果表明,我们所观察到的细胞毒性是由tau低聚物介导的。
还有研究表明,脑源性tau低聚物会影响神经元传递并损害海马长期增强记忆[10]。为了分析评估tau低聚物对突触的影响之间的差异,本研究测量了低聚物中几种突触标记的水平,标记包括PSD95、Synaptophysin和drebrin。研究不同的tau低聚物对新鲜海马突触小体的影响是一种离体测定,并且是对tau低聚物功能特性进行体内研究的最接近方法。本研究结果首次显示TBI脑源性tau低聚物会影响海马神经元突触小体,即不同损伤类型TBI后tau低聚物对神经细胞突触的影响不同,这些发现再次支持了这些tau低聚物不同的观点。
最早在TBI后24h检测到tau低聚物,tau在TBI后积聚,是神经退行性疾病高度相关的证据之一[11]。最近的一项研究报告说rTBI后3个月内,大脑中tau低聚物的数量增加[12]。另一项研究比较了人脑中的tau聚集物与慢性颅脑创伤(CTE)和阿尔茨海默症(AD)的关系,发现与正常对照大脑相比,tau低聚物在诊断为CTE(I~IV期)和AD的大脑中显著增加,并且CTE IV期和AD的可溶性tau低聚物水平非常相似[3]。此外,在TBI后,还会出现诸如出血、脑血流变化、脑血管损伤、轴突损伤和神经元过度兴奋等多种因素与tau释放、磷酸化、聚集和从大脑清除的减少相关[13-14]。 总的来说,已经确定晚期阿尔茨海默氏病脑中可溶性tau低聚物的水平与记忆力丧失相关。因此TBI后脑中tau低聚物的升高、扩散和长期存在很可能与后来的神经变性有关。本研究调查了TBI后长达3周的小鼠大脑中tau低聚物的存在,这些研究结果补充了上述研究,并支持以下观念:TBI后的内源性tau可能变形、获得毒性,这很可能与神经变性有关。
总之,本研究证明不同类型的TBI导致形成不同的tau形态,具有不同的毒性和损伤潜能,可以预测TBI后神经变性和痴呆的风险。这项研究强调了鉴定与tau神经退行性相关的多态性并开发针对每种毒性、低聚、多态性的不同疗法的重要性。这突出了开发特定的免疫疗法干预方法的重要性,该方法在神经变性发作之前表达有毒tau低聚物的高特异性和清除潜能。除了这些研究外,研究宿主对tau低聚物形成的影响也至关重要。对于诸如APOE[15]和TREM2[16]等位基因也会影响tau低聚物,因此有助于确定神经变性和晚期痴呆的风险[17]。

