CD2在乳腺癌肿瘤微环境中的作用及其预后意义
杨 柯,李天禹
(1.遵义医科大学 研究生院,贵州 遵义 563099;2.遵义医科大学附属医院 中医科,贵州 遵义 563099)
乳腺癌(Breast cancer,BC)是常见女性癌症死亡原因,且近年发病率有明显升高趋势,尽管在临床治疗方面取得了进展,但总体上仍面临失败和复发的危险。既往对乳腺癌的研究主要集中在癌细胞上,认为肿瘤的产生和发展取决于抑癌或致癌基因突变,故源自该理论的治疗也都是杀死肿瘤细胞[1]。传统的抗肿瘤放化疗具有很强的细胞毒性,它使肿瘤细胞中的核酸和蛋白质变性;这也会导致继发性损伤和增加治疗抵抗力,并引起严重的不良反应,甚至继发肿瘤形成[2-3]。但最近研究表明肿瘤微环境(Tumor microenvironment,TME)在乳腺癌的发生发展、转移和耐药中起着至关重要的作用[4-7]。然而,在明确乳腺癌TME中免疫和基质成分的动态调节方面仍然存在挑战。故本研究基于TCGA中乳腺癌数据探讨乳腺癌肿瘤微环境中免疫成分、基质成分以及肿瘤浸润免疫细胞(Tumor-infiltrating immune cell,TIC)在乳腺癌预后及发生、发展中的作用,探寻抗乳腺癌治疗的潜在靶标。研究的分析流程(见图1)。

图1 研究流程
1 材料与方法
1.1 数据下载 从TCGA数据库(https://portal.gdc.cancer.gov/) 下载1 222例乳腺癌病例的转录组RNA-seq数据(正常样品113例;肿瘤样品1 109例)和相应的临床数据。
1.2 ESTIMATE评分 使用ESTIMATE算法估计每个样品在TME中的免疫、基质成分的比例,以3种得分的形式展现:免疫评分(ImmuneScore),基质评分(StromalScore)和总分数(ESTIMATEScore),分别与免疫、基质和两者之和呈正相关。分数越高,TME中相应成分的比例就越大。
1.3 生存分析 根据各评分中位数将乳腺癌患者分为高、低表达两组, 用“survival”、“survminer”R包做生存分析,绘制Kaplan-Meier生存曲线,对数秩(log-rank)检验,P<0.05有统计学意义。
1.4 筛选差异表达基因(DEGs) 根据免疫评分和基质评分的中位分数,将肿瘤样品分为高分组或低分组。用“limma”包进行差异分析,筛选差异表达基因。筛选标准设置:|log2FC|>1,错误发现率(FDR)<0.05。用R语言“pheatmap”包作DEGs热图。
1.5 GO、KEGG富集分析及PPI网络构建 用“clusterProfiler”、“richplot”和“ggplot2”R包对DEG进行GO和KEGG富集分析并作图。P值和q值均<0.05的富集条目有统计学意义。通过STRING数据库构建蛋白质-蛋白质相互作用(PPI)网络,然后使用3.7.2版的Cytoscape进行重构。交互关系置信度大于0.95的节点用于构建网络。红色表示上调的基因,绿色表示下调的基因。
1.6 评分和临床病理特征差异分析 从TCGA下载乳腺癌样品对应的临床病理特征数据包括性别、年龄、TNM分期。用R进行分析,年龄和M分期用Wilcoxon秩和检验作为显著性检验,T分期、N分期和stage用kruskal wallis秩和检验。
1.7 COX回归分析 用“survival”R包行单变量COX回归分析,并展示在单变量COX中按P值从小到大排序的前16个基因。
1.8 GSEA分析 用GSEA 4.0.3将所有肿瘤样品的整个转录组作GSEA分析,P<0.05和FDRq<0.05的基因集进一步做多GSEA分析。
1.9 肿瘤免疫细胞浸润 使用CIBERSORT计算方法估算所有肿瘤样品中的TIC丰度分布,行免疫细胞的差异表达(Wilcoxon秩和检验)和相关性分析(Pearson相关系数)。
2 结果
2.1 ESTIMATE评分与乳腺癌患者生存率相关 用Kaplan-Meier生存分析探讨免疫评分和基质评分与总体存活率之间的相关性。在ImmuneScore或StromalScore中评分较高表示乳腺癌TME中免疫或基质成分较多。ESTIMATEScore是ImmuneScore和StromalScore的总和,表示这两种成分在TME中的综合比例。免疫成分的比例与总体生存呈正相关(见图2A)。 StromalScore与总体生存没有显著相关性(见图2B),这些结果表明,TME中的免疫成分更适合于预测BC患者的预后。
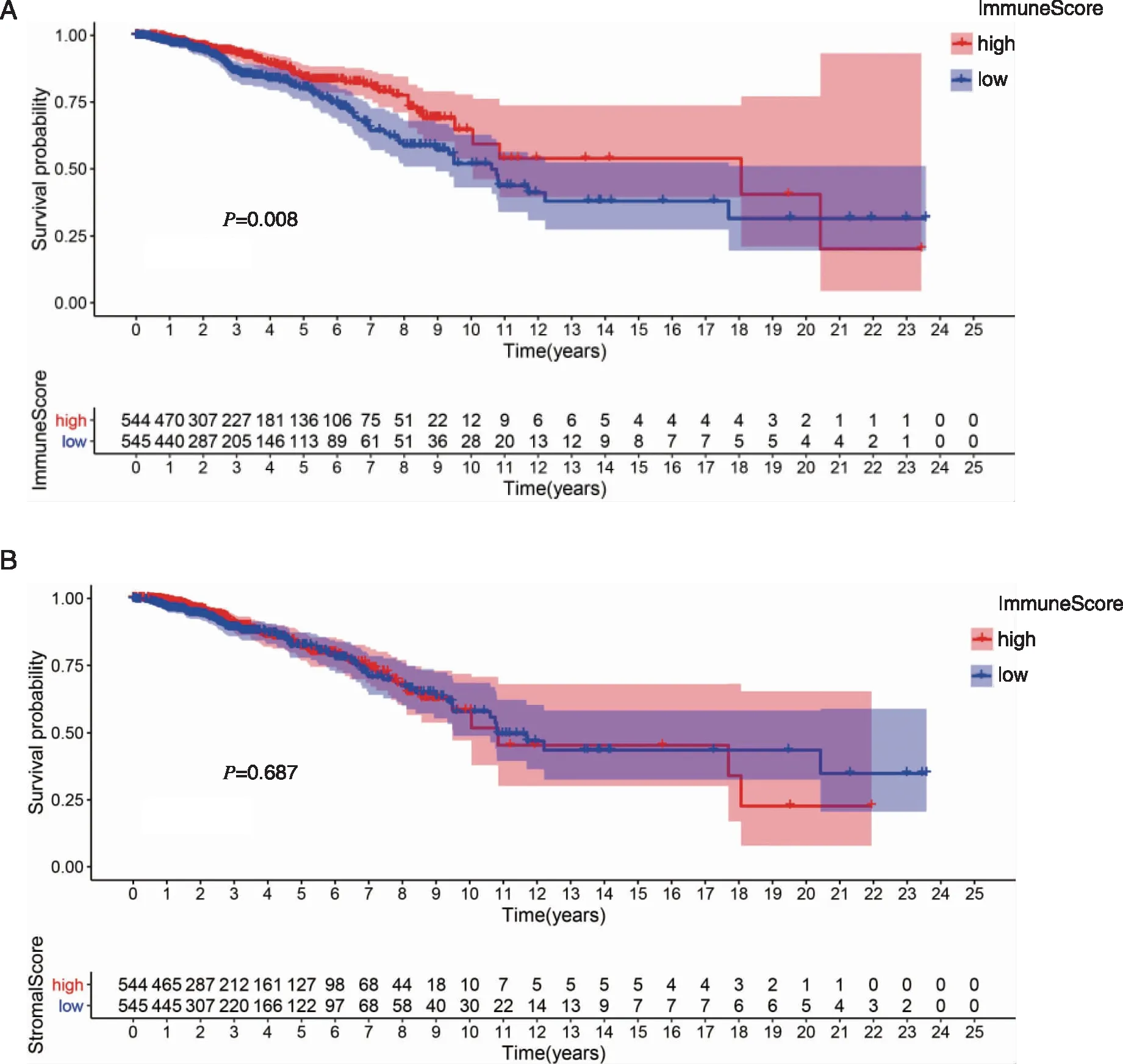
A:免疫评分;B:基质评分 。
2.2 评分与乳腺癌患者的临床病理特征有关 为了确定免疫和基质成分的比例与临床病理特征之间的关系,从TCGA数据库中分析了乳腺癌病例的相应临床信息。如图2所示,ImmuneScore与年龄(见图3A)、性别(见图3B)相关,StromalScore与年龄(见图3C)、Ⅰ期和Ⅱ期、Ⅱ期和Ⅲ期(见图3D)相关,而ESTIMATEScore与年龄(见图3E)、性别(见图3F)、TMN分期中T1和T2、T1和T4(见图3G)相关。这些结果表明免疫和基质成分的比例与乳腺癌的进展有关,例如侵袭和转移;年龄越大免疫评分、基质评分和ESTIMATEScore都越小;免疫评分和ESTIMATEScore在女性患者中评分更高,但这有可能与TCGA乳腺癌中女性占比更大有关。

A:免疫评分与年龄 ;B:免疫评分与性别;C:基质评分与年龄;D:基质评分与分期;E:ESTIMATEScore与年龄;F:ESTIMATEScore与性别;G:ESTIMATEScore与T分期。
2.3 DEGs富集分析 对高分和低分样本进行比较分析乳腺癌TME中免疫成分和基质成分的差异表达基因。与中位数相比,从ImmuneScore(高分与低分的样本)获得了总共832个DEG,其中729个基因上调,103个基因下调(见图4A、C、D)。同样,从StromalScore获得了773个DEG,由634个上调基因和139个下调基因组成(见图4B~D)。ImmuneScore和StromalScore高评分组中共有193个上调基因,低评分组中有30个基因都下调,这些DEGs(共223个)可能是乳腺癌TME状态的决定因素。基因本体(GO)富集分析的结果表明,DEGs几乎富集到与免疫相关的GO条目,例如T细胞活化、T细胞活化的调节、淋巴细胞分化等条目(见图4E)。京都基因与基因组百科全书(KEGG)富集分析还显示了细胞粘附分子(CAMs)、细胞因子与细胞因子受体相互作用以及造血细胞谱系的富集(见图4F)。由以上结果可知DEGs的整体功能富集到免疫相关的活动,这意味着免疫因子的参与是乳腺癌中TME的主要特征。
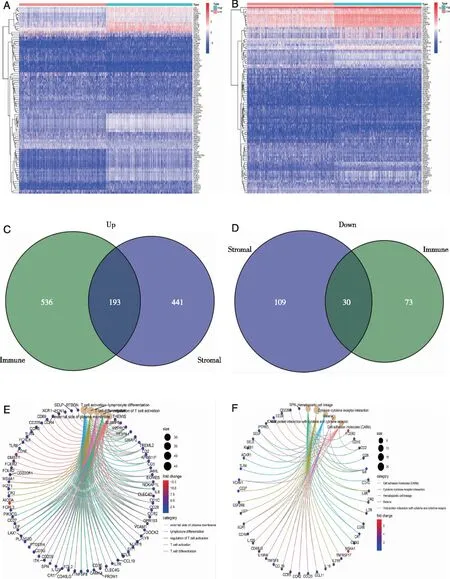
A:免疫评分DEGs热图 ;B:基质评分DEGs热图;C:上调基因;D:下调基因;E:GO富集分析;F:KEGG富集分析。
2.4 PPI网络与单因素COX回归的相交分析 为了进一步探讨其潜在机制,使用Cytoscape软件在STRING的基础上构建了PPI网络。223个基因之间的相互作用显示在图5A中,条形图表示按节点数排名的前30个核心基因(见图5B)。对乳腺癌患者的生存进行单因素COX回归分析,以确定223个DEGs中的关键基因(见图5C)。然后,将PPI网络中的主要节点与按单因素COX回归的P值排名的前32个基因取交集,得到CD2、CD5、CCL19、CD3E、CD27、CD40LG、CD52、IL7R、CD48这9个关键基因(见图5D )。在这9个基因中,按照PPI网络节点数目及P值大小综合考虑选择了CD2进一步分析。

A:PPI网络;B:核心基因条图;C:单变量COX分析;D:关键基因韦恩图。
2.5 CD2表达与乳腺癌患者生存及TNM分期的关系 糖蛋白CD2是主要在T和NK细胞上表达的共刺激受体,与LFA3结合,LFA3是在例如抗原呈递细胞上表达的细胞表面蛋白[8],其功能有两个:粘附和激活[9]。在本研究中,根据CD2表达的中位数将乳腺癌样本分为CD2高表达组和CD2低表达组。生存分析表明,高表达CD2的乳腺癌患者比低表达CD2的患者具有更长的生存期(见图6A),但在一定年限过后CD2低表达者生存较好。然后分析临床特征与CD2的关系,Wilcoxon秩和检验表明,肿瘤样品中CD2的表达高于正常样品中的表达(见图6B)。在同一患者的正常组织与肿瘤组织之间的配对分析中观察到了相似的结果(见图6C)。CD2表达与临床病理分期特征的相关性检验表明,CD2表达在T分期中差异有统计学意义,在N分期和M分期中差异无统计学意义(见图6D~F)。
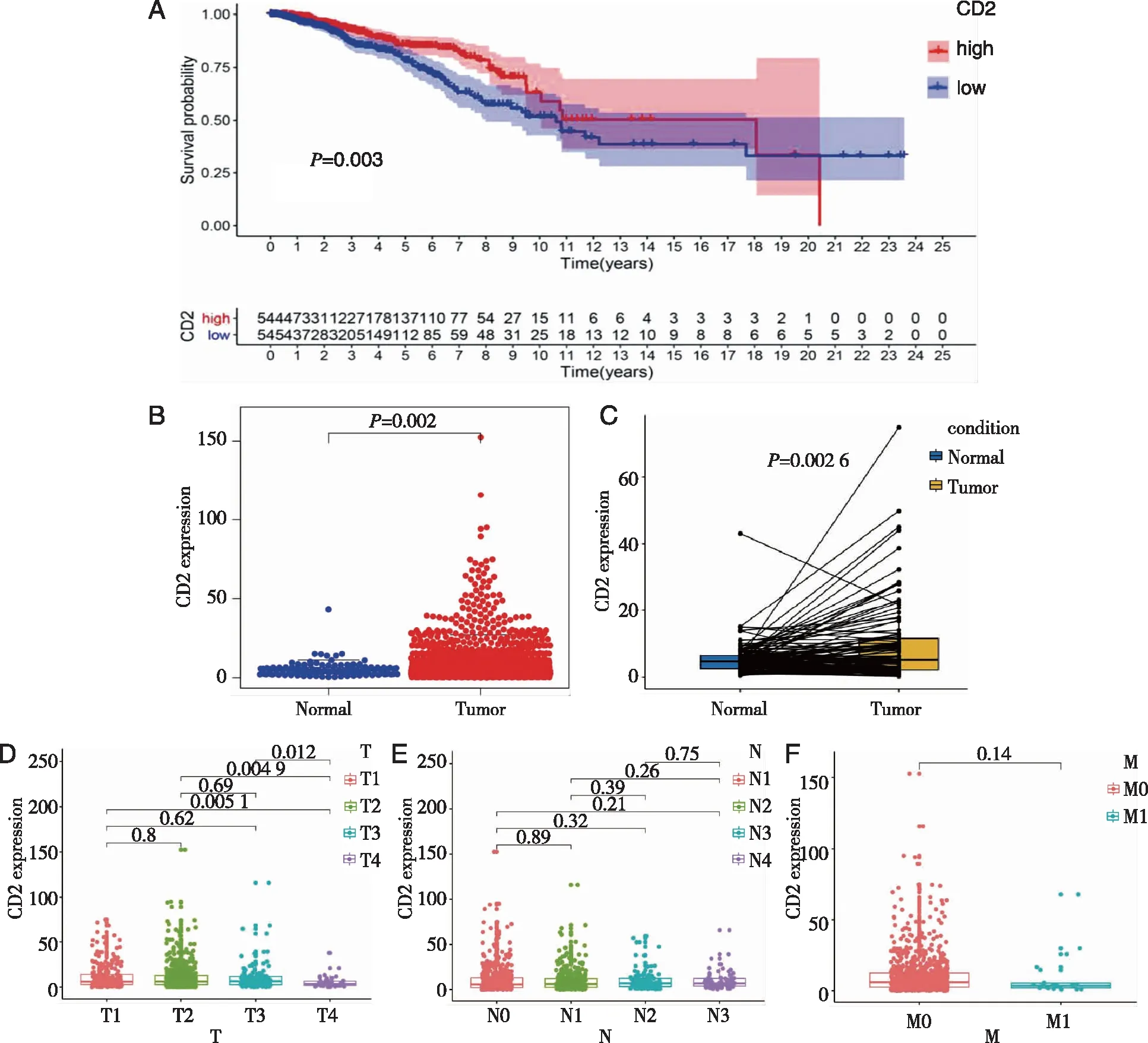
A:生存曲线 ;B:CD2差异表达;C:配对分析 ;D-F:CD2表达与TNM分期。
2.6 CD2可能成为TME的潜在指标 GSEA分别在高表达和低表达组与CD2表达中位水平相比。如图7A所示,CD2高表达组的基因主要富集在B细胞受体信号通路、T细胞受体信号通路、凋亡、趋化因子信号通路、JAK-STAT信号通路、天然杀伤细胞介导的细胞毒性、VEGF信号通路、肿瘤途径。低CD2表达的样品在HALLMARK中富集的基因集较少,满足P<0.05和FDRq<0.05的只有糖基磷脂酰肌醇GPI锚定生物合成(见图7B),目前已发现多种糖基磷脂酰肌醇锚定蛋白质与肿瘤血管生长、侵袭等密切相关。这些结果表明,CD2可能是乳腺癌TME状态的潜在指标。

A:CD2高表达组GSEA;B:CD2低表达组GSEA。
2.7 CD2与TIC比例的相关性 为了进一步证实CD2表达与免疫微环境的相关性,使用CIBERSORT算法分析了肿瘤浸润免疫亚群的比例,并在乳腺癌样品中构建了21种免疫细胞谱。图8A显示了乳腺癌肿瘤样品中21种TIC的比例。图8B显示了21种TIC之间的相关性, Pearson系数行相关性检验。图9A显示了低CD2表达或高CD2表达的乳腺癌肿瘤样本中21种免疫细胞相对于CD2表达水平中位数的表达差异,Wilcoxon秩和检验。差异分析的结果表明,一共有15种TIC与CD2的表达相关。散点图显示16种TICs比例与CD2表达的相关性,该线性模型表示免疫细胞的比例以及CD2表达,Pearson相关性分析(图9B仅展示其中两个,其余见附件,P<0.05)。其中9种TICs与CD2表达呈正相关,包括B记忆细胞、幼稚B细胞、M1巨噬细胞、活化的CD4+T细胞、静息CD4+T细胞、CD8 T细胞、滤泡辅助性T细胞、γδT细胞、调节性T细胞。7种TICs与CD2表达呈负相关,包括静息树突状细胞、M0巨噬细胞、M2巨噬细胞、活化的肥大细胞、静息肥大细胞、中性粒细胞、静息NK细胞。差异分析和相关性分析结果取交集得到与CD2表达相关的15种TIC(见图9C)。这些结果进一步支持CD2的水平影响TME的免疫活性。

A:TICs;B:TICs相关性。

A:TICs表达差异 ;B:相关性分析;C:差异分析和相关性分析取交集。
3 讨论
在此研究中,我们基于CIBERSORT和ESTIMATE算法从TCGA数据库中筛选乳腺癌患者预测生存和临床病理特征的TME相关基因。一系列生物信息学分析表明,CD2主要参与免疫活动,在乳腺癌免疫微环境中起着至关重要的作用,可能是乳腺癌患者TME状态的潜在指标。TCGA数据库中乳腺癌转录组数据分析结果表明,TME中的免疫成分有助于预测乳腺癌患者的预后。特别是,TME中免疫和基质成分的比例与乳腺癌的进展如侵袭和转移相关。这些结果表明了探索肿瘤细胞与免疫细胞之间相互作用的重要性,为开发更有效的治疗方案提供了新的见识。
乳腺癌肿瘤微环境中的细胞类型包括成纤维细胞、内皮细胞、间充质细胞和免疫细胞等,TME的各种成分构成了一个复杂的网络,可以精确地调节肿瘤的发生以及肿瘤细胞与其他成分的相互作用[10]。其中成纤维细胞对乳腺肿瘤的发生、乳腺癌微环境重塑和癌细胞扩散都有积极的影响[11]。嗜酸性粒细胞通过调节免疫细胞组成或活性、生长因子和基质金属蛋白酶的分泌以及促进血管生成,在TME中具有间接促肿瘤生长的作用[12]。TME中的基质细胞通过分泌可溶性分子或外泌体促进肿瘤细胞的生长和转移。异常的微环境可降低机体免疫监视和杀死肿瘤的能力,还导致低抗肿瘤药物渗透性和反应性以及高耐药性;肿瘤血管生成和微环境缺氧可限制TME中的药物浓度并增强肿瘤细胞的干性;这使得肿瘤细胞能够稳定增殖、抵抗凋亡、逃避免疫清除、维持干性并转移至远处[12]。因此,修饰TME以有效攻击肿瘤细胞可能成为一种全面而有效的抗肿瘤策略。正常细胞,例如干细胞和免疫细胞会渗透并破坏异常的TME,用健康细胞重塑TME是肿瘤治疗的新方向。
乳腺癌具有增殖快、易转移和易耐药的特性,使其防治成为世界一大难题。
随着对TME的认识的逐渐加深,以TME成分为靶标已成为一种有效的癌症治疗手段。大量的临床前和临床研究证明,靶向TME中的血管生成、细胞外基质(ECM)和细胞成分已取得初步成功[13]。在本研究中,我们从TCGA数据库中乳腺癌的转录组学分析出发,结果显示高表达CD2的乳腺癌患者比低表达CD2的患者具有更长的生存期,但在患乳腺癌存活18年左右该差异逐渐消失。CD2表达在N分期和M分期中差异无统计学意义,表明CD2表达与乳腺癌淋巴结受累程度和范围及是否远处转移无明显关系。但随着T分期的进展,CD2表达逐渐降低,CD2表达与乳腺癌原发灶大小和邻近组织受累范围相关,这与生存分析结果具有一致性。以上表明CD2的表达与临床病理特征如临床分期和远处转移及预后不良密切相关。它提示CD2可能是乳腺癌中TME的潜在预后标志物和治疗靶标。
CD2是在T细胞、NK细胞、胸腺细胞和树突状细胞表面表达的免疫球蛋白超家族的跨膜糖蛋白[14]。CD2的结合伴侣是淋巴细胞相关抗原3(LFA3,也称为CD58),在B细胞、T细胞、单核细胞、粒细胞、胸腺上皮细胞的表面表达[15]。CD2具有多种作用,在细胞内,CD2影响肌动蛋白细胞骨架的重排和激活细胞信号传导[16];CD2是T细胞-APC结合后免疫突触装配中的重要组成部分,有助于T细胞信号转导[17];在胸腺细胞发育及NK细胞活化中也起着重要作用[18-19]。因此,我们进一步分析了CD2表达与TME之间的关系。GSEA结果显示CD2高表达组主要富集在B细胞受体信号通路、T细胞受体信号通路、凋亡、趋化因子信号通路、JAK-STAT信号通路、天然杀伤细胞介导的细胞毒性、VEGF信号通路、肿瘤途径。新生血管的形成,对于某些生理和病理状况而言必不可少,其中后者包括肿瘤的生长、发展、侵袭和转移。异常血管生成通过募集VEGF、T(reg)细胞和免疫抑制肿瘤相关巨噬细胞(TAM)来诱导低氧环境[20]。缺氧也可激活 VEGF 信号通路,调控细胞生长和血管生成,VEGF信号轴的激活与乳腺癌的肿瘤进展和预后不良有关[21]。抗CD2单克隆抗体可在体外诱导免疫调节作用,这进一步表明CD2具有多功能性及在乳腺癌中起重要作用,靶向CD2的疗法可能成为治疗乳腺癌患者的新曙光。
在本文中,CIBERSORT对TIC比例的分析表明,乳腺癌患者中记忆B细胞、幼稚B细胞、M1巨噬细胞、活化的CD4+T细胞、静息CD4+T细胞、CD8 T细胞、滤泡辅助性T细胞、γδT细胞、调节性T细胞与CD2表达呈正相关。以上免疫效应细胞,是主要负责癌症免疫监视的免疫细胞;CD8 T细胞是抗肿瘤免疫应答的主要效应因子,具有抗肿瘤活性,乳腺癌CD8T细胞高表达患者具有更好的预后[22-24],这与我们前面生存分析结果一致。M2巨噬细胞与CD2表达呈负相关,研究表明巨噬细胞具有可塑性,并且肿瘤相关巨噬细胞可以在肿瘤微环境中充当免疫抑制细胞,M2巨噬细胞参与肿瘤的免疫调节,促进肿瘤的侵袭和转移[25-26]。肿瘤相关巨噬细胞形成肿瘤基质的主要组成部分,M2样TAM富集在低氧性肿瘤区域,在体内具有促血管生成活性,并且随着肿瘤的进展而增加[27],这与GSEA富集结果相一致,进一步证明了我们生物信息分析结果的可靠性。据以上结果,可证明肿瘤浸润性免疫细胞的数量与乳腺癌患者存活之间的相关性,我们能否靶向CD2,消除乳腺癌的免疫微环境抑制状态,增强免疫应答,提高乳腺癌患者的预后。
总之,我们使用ESTIMATE算法,通过对TCGA数据库中乳腺癌样品进行一系列生物信息学分析,确定了乳腺癌中TME相关基因。CD2可能是乳腺癌肿瘤微环境相关的潜在预后标志物和治疗靶标,在未来可进一步实验验证,为乳腺癌的治疗提供新方向。

