基于iTRAQ 技术的肝癌细胞蛋白质组学研究
关媛月 高玉雪 庄 园 陈德喜 王延军
首都医科大学附属北京佑安医院北京市肝病研究所,北京 100069
乙型肝炎病毒(hepatitis B virus,HBV)是一种以体液和血液传播为主的嗜肝DNA 病毒[1],HBV 持续感染所致的肝癌是影响全球的一个重大健康问题,全世界至少超过3.5 亿是慢性HBV 的感染者[2],每年有约887 000 人死于HBV 相关的肝病。尽管已证实核苷(核苷酸)类似物(NAs)和聚乙二醇化干扰素-α(Peg-IFNα)可有效抑制HBV 复制,但NAs 需要长期服用,α 干扰素(IFNα)治疗则易产生各种副作用,且这两种药物均难以根除HBV,实现慢乙肝的临床治愈[3]。因此,研究HBV 感染相关特异性蛋白标志物,寻找新的药物治疗靶点,对于临床具有重要的意义和价值。本研究使用同位素标记相对和绝对定量(isotope tagging for relative and absolute protein quantitation,iTRAQ)技术对稳定表达HBV 的HepG2.2.15 细胞株及其亲本HepG2 细胞株进行鉴定和定量分析,筛选出差异蛋白,通过生物信息学分析差异蛋白功能及相应通路,为进一步探讨HBV 致病的分子机制提供参考依据。
1 材料与方法
1.1 细胞
HepG2 和HepG2.2.15 的肝癌细胞系于北京市肝病研究所保存。
1.2 主要仪器与试剂
高效液相色谱仪(Nano,HPLC)、Durashell-C18色谱柱(4.6 mm×250 mm,5 μm,EASY-Spray column)、质谱系统(Orbitrap Fusion)和蛋白定量染液(23238)购自美国Thermo 公司;超声波细胞破碎仪(XO)购自南京先欧仪器公司;硫脲(T7875)购自美国Sigma 公司;尿素(161-0731)购自美国Bio-Rad 公司;iTRAQ®试剂盒(4381664)和iTRAQ Reagent 8 Plex(4381663)购自美国AB Sciex 公司;DMEM 培养基(2003938)和胎牛血清(F8318)购自美国Sigma 公司。
1.3 细胞培养
用含有10%胎牛血清的DMEM 培养基进行两种肝癌细胞的培养,2~3 d 进行1 次传代,放置到含有5%CO2、37℃的培养箱中培养。
1.4 细胞蛋白质谱分析
1.4.1 细胞收集 收集处于对数生长期的细胞,按照细胞传代的方法进行消化和计数,确保细胞数达到1×107个/mL 以上,将细胞沉淀放置到-80℃的冰箱备用。
1.4.2 细胞蛋白提取和定量 细胞中加入裂解液(7 mol/L尿素,2 mol/L 硫脲)混匀,用超声细胞破碎仪超声60 s后室温提取30 min,然后15 000 r/min(离心半径为13.5 cm),4℃离心20 min,收集上清分装冻存于-80℃;使用常规的蛋白质考马斯亮蓝染色法进行总蛋白的定量。
1.4.3 细胞蛋白酶解和iTRAQ 标记 取100 μg 蛋白溶液置于离心管中,使用iTRAQ®酶解试剂盒进行酶解,得到100 μL 酶解后的样品;使用iTRAQ Reagent 8 Plex 进行标记,混合标记后的样品,离心并真空冷冻干燥后保存待用。
1.4.4 酶解产物的液相色谱串联质谱分析 取标记产物10 μL 进行质谱分析。采用RIGOL L-3000 高效液相色谱系统进行分离,分离后用高效液相色谱仪进行质谱分析。
1.5 差异蛋白的分类及其功能分析
使用Uniprot-human 数据库中的蛋白GO 注释,鉴定所得差异蛋白最可能的生物学过程(biological process)、细胞学组分(cellular components)及分子功能(molecular function)属性;使用京都基因与基因组百科全书(KEGG),数据库和蛋白质相互作用网络(PPI)分析差异蛋白的富集通路、相互关系以及可能处于的功能群。
1.6 统计学方法
本研究采用Thermo 公司的配套商用软件Proteome Discoverer 2.1 进行结果分析。两组细胞间蛋白差异分析采用t 检验,两组间蛋白差异倍数≥1.2 及P <0.05 的蛋白被认为是差异蛋白。以P <0.05 为差异有统计学意义。
2 结果
2.1 差异蛋白的筛选
利用Proteome Discoverer 2.1 软件,共检测出5394 个蛋白,按照上述差异蛋白判断标准共筛选出856 个差异蛋白,其中上调的蛋白497 个,下调蛋白359 个,见图1。并将前20 个最有显著差异的蛋白质列出。见表1。
2.2 差异蛋白的GO 分析
对差异蛋白进行GO 分析,分别富集到20 条生物学过程术语、12 条细胞组分术语和6 条分子功能术语,其主要影响信号转导、转运和囊泡介导的运输等生物学过程。见图2。
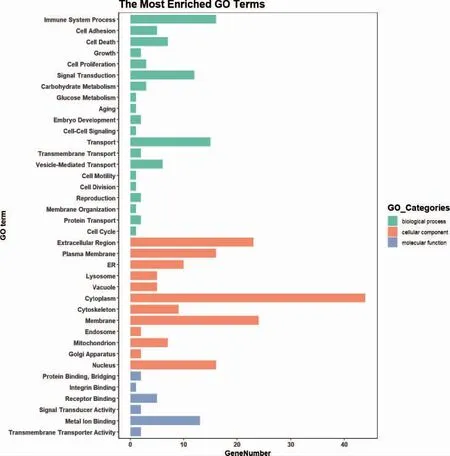
图2 差异蛋白的GO 功能分类分布图
2.3 差异蛋白的KEGG 分析
对差异蛋白进行KEGG 信号通路分析发现,HBV表达后涉及的信号通路有药物代谢、化学致癌、细胞色素P450 代谢异物以及MAPK 信号通路等。见图3。
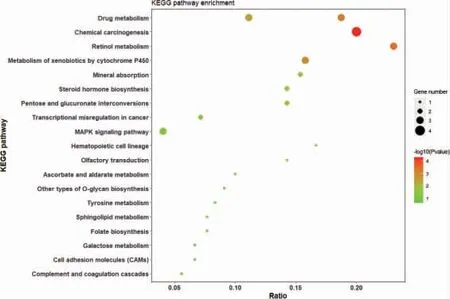
图3 差异蛋白的KEGG 通路富集分析
2.4 差异蛋白的相互作用分析
对差异蛋白间的相互作用进行了分析,结果显示,多种蛋白之间具有相互关系,如SCF(是一种重要的造血干细胞生成因子)可与PROM1 和CD166 相互作用,深色节点代表上调,浅色节点代表下调。见图4。
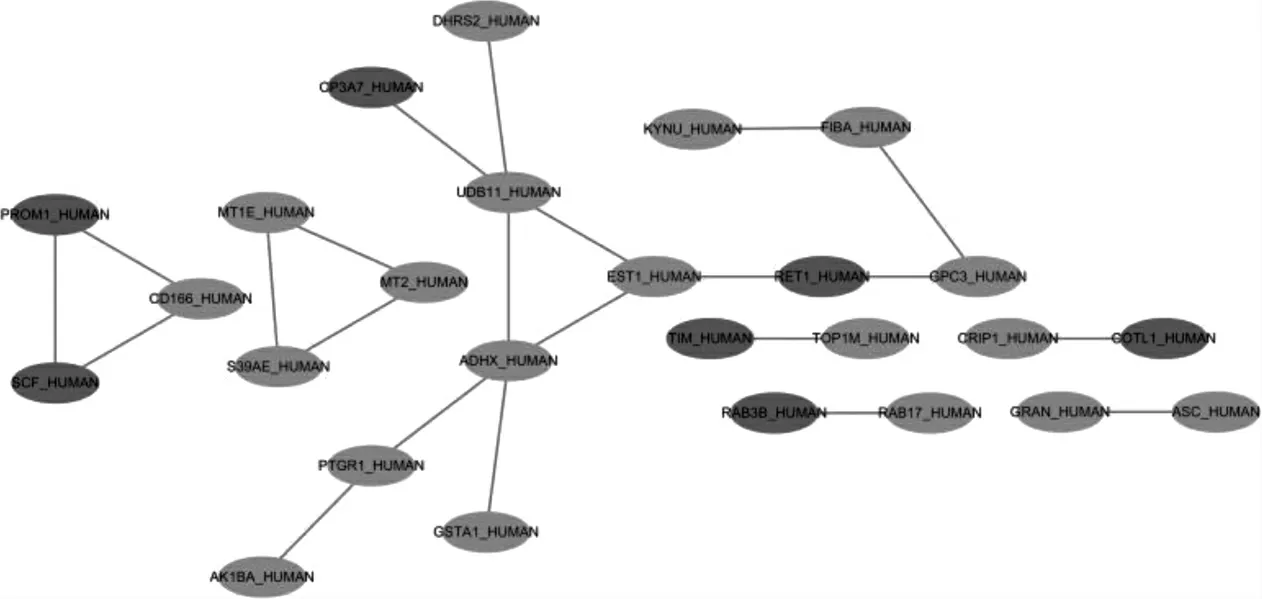
图4 差异蛋白的相互作用网络图
3 讨论
慢性HBV 感染不仅导致致命的肝脏疾病(如肝硬化和肝衰竭),而且使肝癌的风险大大增加,了解HBV 复制和感染的发病机制有利于改善患者筛查和治疗方案,也可以为药物和疫苗开发提供新途径。本研究利用iTRAQ 技术筛选了稳定表达HBV 的HepG2.2.15和亲代HepG2 细胞株之间差异蛋白,共鉴定出856 个显著差异的蛋白,对所有显著差异蛋白做了GO 聚类分析及功能富集分析,试图挖掘在稳定表达HBV 肝癌细胞中有意义的蛋白,为进一步了解HBV 病毒感染、复制及发生发展的分子机制提供理论基础。
微管相关蛋白1S(microtubule-associated proteins 1S,MAP1S)作为一种差异蛋白在HepG2.2.15 细胞株中显著上调。MAP1S 是一种微管相关的自噬激活剂,可以通过微管依赖性和非依赖性方式影响自噬[4-6]。研究[7]发现MAP1S 也可以通过维持Bcl-2 和P27 的水平,通过LKB1-AMPK-mTOR 通路抑制二乙基亚硝胺诱导的肝癌;天然成分亚精胺也能够通过激活MAP1S介导的自噬来延长寿命,防止肝纤维化和肝癌的发生[8]。MAP1S 调控的自噬缺陷也可能会影响心脏病、癌症、神经退行性疾病和一系列其他疾病[9-13],但MAP1S 在HBV 所致肝癌中的作用还需要进一步研究。
COLGALT2 是糖基转移酶GLT25 家族成员之一,在HepG2.2.15 细胞株中显著上调,其具有催化胶原糖基化修饰的糖基化转移酶活性,介导胶原蛋白上的羟基赖氨酸G1cα1,2Gal β1-糖基化修饰[14]。众所周知,HBV 感染所致的肝纤维化是肝硬化、肝癌的重要环节,在肝纤维化的初期,肝脏会表现出很强的再生修复能力,在损伤修复过程中,细胞外基质的沉积是肝纤维化重要的生物学机制。细胞外基质的沉积与胶原纤维糖基化修饰密切相关,相关研究已经证明Colgalt2 介导的G1cα1 和2Gal β1-糖基化修饰具有促进肝细胞再生及抗肝细胞凋亡的作用[15-16]。研究还发现糖基转移酶Glt25D2 可能参与HBV 包膜蛋白LHBs的Thr37 位糖基化修饰来影响LHBs 分泌,从而影响HBV 病毒颗粒的组装[17-18]。
在HepG2.2.15 细胞株中也观察到热休克蛋白α8(heat shock protein 8,HSPA8)的上调。研究显示,在HepG2.2.15 细胞株中过表达HSPA8 可增加HBV的复制,而通过干扰RNA 敲除HSPA8 的表达,可以很大程度上抑制HBV 的复制,但对宿主细胞不产生细胞毒性[19]。此外,还有研究显示,氧麻黄碱的抗HBV作用是通过破坏HSPA8 mRNA 的稳定性发挥抗HBV 的作用,这意味着HSPA8 是一个抗HBV药物靶点[20-21]。以上的研究提示,HSPA8 可能在协助HBV 复制方面发挥着重要作用。
除以上所述的蛋白外,还有SEC14L2,DUSP6 和TIMELESS 等差异蛋白,既往研究发现,这些蛋白并不参与HBV 的感染,但与EB 病毒[22]、登革热病毒[23]、HIV[24]、HCV[25]等其他病毒感染有关,以后的研究将进一步对这些差异蛋白在HBV 感染中的作用进行探讨与研究,为HBV 致病的分子机制提供参考依据。

