软骨特异性敲除SIRT1 基因对小鼠椎体骨质疏松的影响及机制分析*
唐家国 覃松 王凯 邹凯 何精选 李晨芳 于滨生
骨质疏松症(osteoporosis)是绝经后妇女和老年人常见的代谢性骨病[1]。骨质疏松症的病理特征包括骨量减少、骨微结构异常、骨密度降低、骨脆性增加,导致骨折的风险增加[2]。据估计,目前全球约有2 亿人患有骨质疏松症,美国约有3400万患者被诊断患有骨质疏松症或低骨量[3]。骨质疏松症可引起疼痛、脊柱畸形和脆性骨折。脆性骨折通常是由低能量的冲击造成的,如从站立高度跌落、轻微碰撞或其他常规的轻伤。在50 岁的妇女中,发生骨质疏松性骨折的风险可能高达50%[4]。椎体骨折是常见的骨质疏松性骨折。椎体骨折可引起长期疼痛,严重影响患者的生活质量,甚至可增加死亡的风险[4]。因此,骨质疏松症已成为世界范围内的一个主要公共健康问题[3]。但是,目前关于骨质疏松症的治疗还没有金标准。近年来,关于基因因素对骨质疏松的影响研究成为了热门话题。
沉默信息调节因子1(silent information regulator 1,SIRT1)是一种Ⅲ型乙酰转移酶基因,已在哺乳动物中得到深入研究。最近的研究确定SIRT1 在代谢疾病、退行性疾病、癌症和衰老的病理生理学中起着至关重要的作用[5]。有研究报道,SIRT1 基因在骨质疏松患者的外周血单核细胞的细胞核及细胞质中表达均增高[6]。目前有研究证实,在前成骨细胞中特异性敲除SIRT1 基因,对骨松质的体积没有明显影响,而在成熟的成骨细胞中特异性敲除SIRT1 基因,则会导致骨松质的体积明显地减少[7-9];相反,SIRT1 基因的激活或过表达,会出现因年龄增加而导致的骨质丧失减少。骨折作为骨质疏松最常见的并发症之一,严重椎体骨折可能导致截瘫[10]。而手术是治疗骨质疏松性骨折的主要方法,虽然像椎体骨质疏松性压缩性骨折手术治疗具有操作简单、恢复迅速和手术时间短等优点。但是并没有解决骨质疏松性骨折的根本问题[11]。因此,预防和早期治疗骨质疏松具有十分重要的临床意义。
骨质疏松症被广泛认为是一种典型的衰老相关疾病,而SIRT1 是细胞生存和寿命的重要调节因子[12]。SIRT1 参与了众多的生物学过程,包括DNA 修复、能量代谢、肿瘤抑制和线粒体内稳定等,成为近年来的研究热点[13]。有研究表明,SIRT1 基因与骨代谢和骨量关系密切[14]。
在本研究中,笔者使用Cre-Lox系统对小鼠软骨中SIRT1基因特异性敲除构建(SIRT1 cKO)小鼠,分为SIRT1 基因未敲除与SIRT1 基因敲除的两组小鼠模型,对两组小鼠尾椎通过Micro-CT 扫描,对尾椎骨小梁数量、骨小梁的厚度、骨量体积百分比进行量化比较。再采用HE 染色、Masson 染色评价椎体骨质结构的改变,通过比较两组小鼠尾椎椎体骨质改变情况,从而探讨SIRT1 基因对小鼠椎体骨质疏松的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
用Col2a1-CreERT2转基因小鼠与SIRTlCO/CO小鼠杂交获得SIRT1+/+小鼠,两种小鼠均从美国杰克逊实验室购买。实验中使用的小鼠被安置在北京大学香港科技大学医学中心的实验动物中心的单独通风鼠笼中特定的无病原体(specific pathogen free,SPF)屏障区域,处于12 h 光照/12 h 黑暗周期下,在环境控制的房间中进行常规通风。所有的小鼠都可以自由获取食物和无菌水。所有实验程序和小鼠治疗均按照实验动物管理规定进行。
1.1.2 主要仪器
高速冷冻离心机(SIMA 公司,德国),光学显微镜(Leica 公司,德国),PCR 热循环仪(Eppendorf 公司,德国),凝胶成像系统Dolphin-DOC(Weahec 公司,美国),包埋切片机(Skura 公司,日本)。Micro-CT(SCANCO Medical AG 公司,瑞士,CT100,深圳市弗劳恩科技服务有限公司),ABIPrism 7000 型荧光定量PCR 仪(ABI 公司,美国)。
1.1.3 主要试剂
SIRT1 一抗(Abcam 公司,美国),他莫昔芬、玉米油(Sigma 公司,美国),TRE-trizol(Invitrogen 公司,美国),FastGreen Solution、Safranin OSolution(Scytek 公司,美国),PrimeScript II 1st Strand cDNA Synthesis Kit、SYBB Premix Ex Tap II(Takara 公司,日本)。
1.2 方法
1.2.1 建立软骨特异性敲除SIRT1 基因小鼠模型
实验小鼠的繁殖参考于菲等[15]在利用SIRT1 基因敲除建立小鼠膝骨关节炎模型的研究中的繁殖方法。通过SIRTlCO/CO小鼠和Col2a1-CreERT2转基因小鼠先分别分笼进行繁殖,按照1只SIRTlCO/CO雄鼠和1 只SIRTlCO/CO雌鼠合笼、1 只Col2a1-CreERT2雄鼠和1 只Col2a1-CreERT2雌鼠合笼的方式进行繁殖。待SIRTlCO/CO小鼠和Col2a1-CreERT2小鼠繁殖到20 只以上,按照1 只SIRTlCO/CO雄鼠与1 只Col2a1-CreERT2雌鼠通过合笼的方式进行繁殖得到SIRT1+/+小鼠,SIRT1+/+小鼠繁殖到20只以上时正常条件下饲养,饲养至8 个月龄,然后向SIRT1+/+小鼠腹腔注射他莫昔芬10 mg/mL,75 mg/kg 体重,每日1次,连续注射5 d,即获得SIRT1-/-小鼠。
1.2.2 实验分组
将14 只Col2a1-CreERT2转基因小鼠按随机数字表法分成A 组对照组(SIRT1+/+小鼠组)与B 组敲除组(SIRT1-/-小鼠组),每组7 只,B 组小鼠进行上述方法进行软骨特异敲除性SIRT1 基因。同时对A 组小鼠进行等剂量的玉米油腹腔注射。在他莫昔芬注射完毕8 周后,通过颈椎脱臼法处死,留取尾椎(Co5-Co9)标本,10%福尔马林溶液固定后石蜡包埋。
1.2.3 软骨特异性敲除SIRT1 基因小鼠的基因表型通过荧光定量PCR 反应鉴定
通过NCBI 网站GeneBank 查询SIRT1 基因序列如表1所示,使用Primer Premier 5.0 软件进行引物合成。采用逆转录试剂盒进行cDNA 合成。根据SIRT1 基因的退火温度选择三步法完成扩增,经过44 次循环。扩增产物的特异性依据溶解曲线判断,内参为GAPDH。以TaKaRa SYBR Premix Ex Taq II(Perfect Real Time)试剂盒说明作为反应参数,数据分析采用Bio-Rad CFX Manager Software1.6 系统及2-Ct的方法进行。
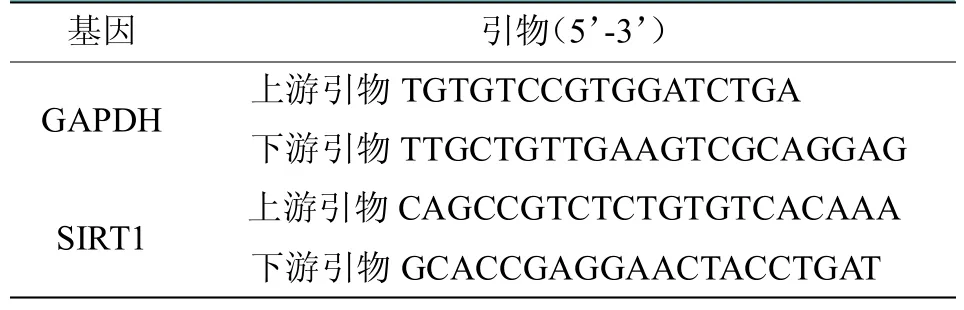
表1 软骨特异性敲除SIRT1 基因小鼠荧光PCR反应鉴定的引物
1.2.4 Micro-CT 扫描检测
将两组小鼠尾椎标本保存于10%福尔马林溶液中固定24 h,然后整洁摆放在Micro-CT 扫描专用管中,扫描参数为:55 kV 的峰值电压,200 A 的电流,11.4 m 的扫描层分辨率,再采用计算机软件对骨小梁数量、骨小梁的厚度以及骨量体积百分比进行定量分析。
1.2.5 骨组织比较
组织标本在10%多聚甲醛中固定24 h,脱钙并石蜡包埋,连续切片,片厚5 m,行HE 染色和Masson 染色。
1.2.6 免疫组化染色
组织标本在10%多聚甲醛中固定24 h,脱钙并包埋在石蜡中。获得了连续的5 m 切片。组织切片在65℃烤箱烘烤3 d,用蒸馏水冲洗2 次,然后进行抗原修复。切片用PBS洗涤3 次,用过氧化物酶阻断剂处理,再用PBS 洗涤3 次。切片用非免疫动物血清处理,然后与SIRT1 抗体一起孵育。切片用PBS 洗涤3 次,然后用二抗孵育。切片用琼脂溶液处理,然后用两滴新鲜的琼脂溶液处理。
1.2.7 免疫组化结果评定
免疫组化结果评定参考于斐等的研究[16],在显微镜下,对SIRT1 抗体呈免疫组化阳性的细胞被染成棕色。将染色强度分为4 级(见表2),以每张切片中所见的阳性细胞范围分为5 级(见表3)。每张切片染色积分以两者乘积表示。评分人员按评分标准均进行双盲评分,数据为两次评估的平均值。

表2 免疫组化染色强度分级表

表3 免疫组化阳性细胞范围分级表
1.3 统计学方法
运用SPSS 17.0 软件进行数据统计分析。计量资料应先进行正态性检验,结果符合正态分布,用均数±标准差表示,采用t 检验对两组数据进行的统计学分析比较。P<0.05 为差异有统计学意义。
2 结果
2.1 SIRT1 基因敲除的鉴定
剪取两组小鼠尾尖软骨组织提取DNA,两组小鼠基因表型采用荧光定量PCR 反应鉴定。结果显示A、B 两组小鼠SIRT1 mRNA 表达量分别为(8.08±1.64)、(2.61±1.11),差异有统计学意义(P<0.01)(见图1)。两组小鼠SIRT1 表达趋势的电泳图如图2 所示。证实B 组小鼠软骨组织中SITR1 基因敲除成功。

图1 基因在两组小鼠中的表达

图2 实验中两组小鼠SIRT1 基因表达的电泳图
2.2 SIRT1 的免疫组化结果
SIRT1 抗体在小鼠尾椎椎间盘髓核内免疫组化染色积分,A 组为(5.07±2.99)、B 组为(3.10±2.69)。B 组与A 组比较差异有统计学意义,(P<0.01,见图3)。

图3 椎间盘髓核组织免疫组化中SIRT1 的表达情况(×400):A.A 组小鼠模型中髓核组织中SIRT1 的表达情况;B.B 组小鼠模型髓核组织中SIRT1 的表达情况
2.3 Micro-CT 结果
两组小鼠的尾椎标本通过Micro-CT 扫描分析得出的骨量体积百分比(Bone volume/Total volume,BV/TV),骨小梁数目(Trabecular number,Tb.N),骨小梁厚度(Trabecular thickness,Tb.Th)相关数据(见表4)。B 组小鼠骨量体积百分比显著高于A 组小鼠,差异有统计学意义(P<0.05);B 组小鼠骨小梁数目均显著高于A 组小鼠,差异有统计学意义(P<0.05)(见图4);A、B 组小鼠骨小梁厚度比较,差异无统计学意义(P>0.05)。
2.4 椎体骨改变情况
Micro-CT扫描后三维重建得出A 组和B 组小鼠的椎体骨改变情况,可以看出B 组小鼠椎体中央或整个区域松质骨密度较A 组减低,并成蜂窝状或不规则片状低密度改变(见图5)。
表4 Micro-CT 扫描下两组小鼠尾椎BV/TV、Tb.N 及Tb.Th 结果比较(,n=7)
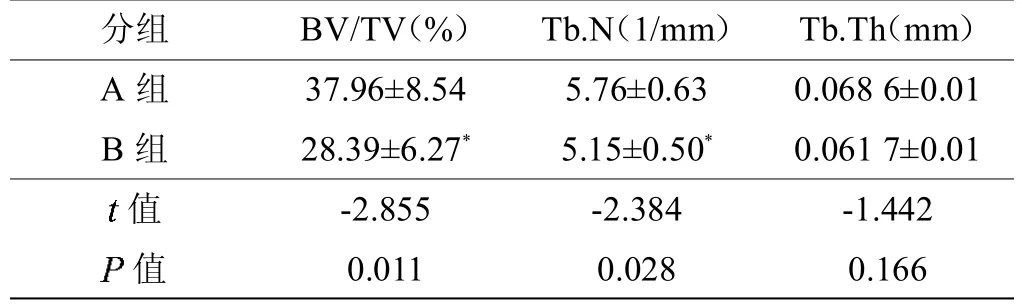
表4 Micro-CT 扫描下两组小鼠尾椎BV/TV、Tb.N 及Tb.Th 结果比较(,n=7)
注:A 组为SIRT1 基因未敲除组,B 组为SIRT1 基因敲除组;*与A 组比较,P<0.05。
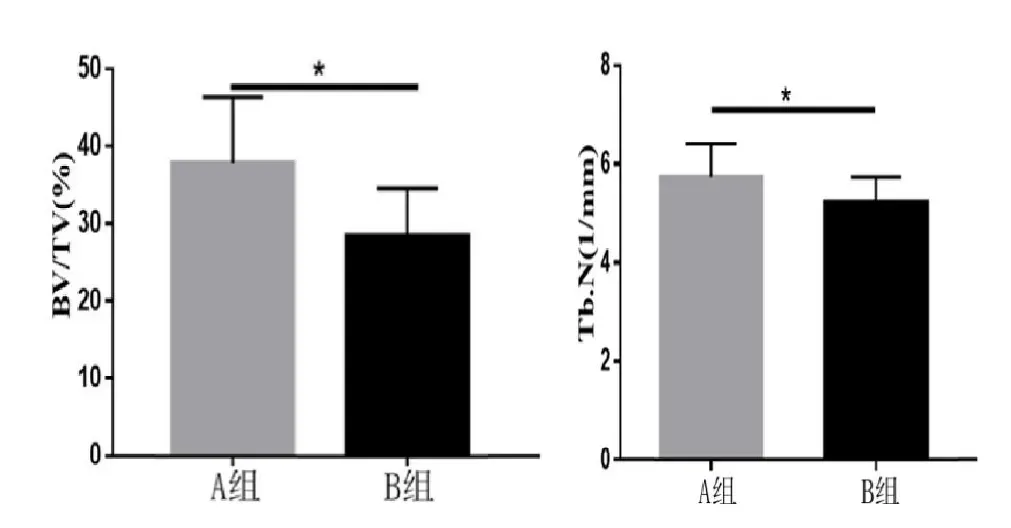
图4 两组小鼠骨量体积百分比、骨小梁数目的比较

图5 MicroCT 三维重建图:A.A 组小鼠模型的三维重建图;B.B 组小鼠模型的三维重建图
2.5 骨组织切片结果
骨的组织学切片对比,A 组小鼠椎体骨组织较B 组骨质分布更密集(见图6)。


图6 两组小鼠椎体骨组织表现:A.A 组在100 倍镜下的HE 染色;B.A 组在200 倍镜下的HE 染色;C.A 组在200 倍镜下Masson 染色,椎体骨组织均表现为骨小梁变薄、骨间隙增大;D.B 组在100 倍镜下的HE 染色;E.B 组在200 倍镜下的HE 染色;F.B 组在200 倍镜下Masson 染色,均可以显示A 组小鼠椎体骨组织较B 组骨质分布更密集
3 讨论
随着我国逐步进入老年性社会,骨质疏松的发病人数逐年升高。由于骨量减少、骨微结构破坏、骨强度降低及骨脆性增加,骨质疏松患者极易发生骨折,严重者可引起患者股骨头坏死、瘫痪,甚至死亡[17]。而手术是骨质疏松性骨折目前最有效的治疗方法,然而骨质疏松性骨折患者以老年人居多,术后的恢复非常缓慢[18]。同时,给患者家庭和社会带来了沉重的经济负担[3]。因此,从基因方面治疗或者延缓骨质疏松的进展,以及减少骨质疏松性骨折的发生具有十分重要的意义。
有学者进行体外实验证实特异性敲除间充质干细胞的SIRT1 基因,可抑制间充质干细胞向成骨和成软骨方向分化[7]。而本实验研究中通过Micro-CT 扫描得到A、B 两组小鼠的骨量体积百分比、骨小梁数目和厚度以及三维成像下等数据进行相互比较,并通过椎体骨组织的HE 染色及Masson 染色进行骨组织学对比,发现软骨特异性敲除SIRT1 基因组小鼠导致骨微结构恶化,表现为骨小梁变薄、骨间隙增大和骨密度降低。同时,笔者的实验结果也证实了上述文献报道的SIRT1 基因的敲除导致骨质丧失的现象。
近年来,与骨代谢相关的分子信号通路成为研究热点。研究表明,与骨质疏松相关的信号通路包括Wnt/ -catenin、RANKL/RANK/OPG、NF-B、PPAR-、PTH、MAPK、pi3k/Akt、Hedgehog 和Notch 信号通路[19]。白藜芦醇作为SIRT1基因的激动剂[20],目前在研究SIRT1 基因对骨质疏松的作用机制中得到广泛应用。有体外实验研究[21]报道,间充质干细胞通过白藜芦醇处理后会促进细胞的成骨向分化。同时,也有体内实验研究表明[22],通过药物激活SIRT1 保护绝经后骨质疏松症和衰老相关骨质疏松症的小鼠模型的骨质疏松症。经SIRT1 激动剂治疗后,骨量显著改善。目前,SIRT1 基因激动剂白藜芦醇已用于人体试验,可显著增加老年肥胖男性的骨量[23]。第四军医大学西京医院的研究通过白藜芦醇对大鼠骨质疏松模型的作用机制研究中证明了藜芦醇调节SIRT1-NF-kB 信号通路,促进成骨细胞分化,预防骨质疏松症[24]。近期也有研究报道,通过白藜芦醇激活SIRT1/FoxO1 信号通路促进小鼠骨质疏松模型骨质生成,对骨质疏松起到保护作用[25]。本研究中利用特异性敲除软骨SIRT1 基因,导致小鼠尾椎骨质流失增加,可能阻断或减少了SIRT1 基因对SIRT1-NF-kB 信号通路、SIRT1/FoxO1 信号通路及其他骨代谢通路的激活,减少成骨细胞分化,导致骨质疏松的形成。然而,每个骨代谢的信号通路并不是单独存在的,更常见的是多条通路相互交叉共同调节骨代谢。也有可能还存在未知、潜在的骨代谢信号通路,这需要我们下一步实验证实。
然而,这项研究有一定的局限性。骨矿物质形成和成骨细胞分化的调节是复杂的。在这项动物实验体内研究中,笔者只检测了SIRT1 基因敲除对小鼠尾椎骨质疏松的影响,而没有研究SIRT1 基因激动剂对小鼠骨质疏松的影响。另外,笔者未对骨质疏松调节的分子通路进行研究,我们需要进一步探索SIRT1 基因对骨量调的分子机制。
综上所述,笔者目前的研究证实SIRT1 基因对小鼠尾椎骨质疏松具有保护的作用。这些发现提供了强有力的证据,证明SIRT1 是骨量的积极调节者,是开发骨质疏松症的新疗法的一个有希望的靶点。

