粘着斑相关蛋白Kindlin-1 在血管内皮细胞的表达及功能研究*
吴晓昊 陶楚 姚青 伏学坤 梁超 曹惠玲肖国芝
Kindlin 家族蛋白是能够激活整合素胞内区并参与粘着斑(focal adhesion)形成的一类蛋白[1-3]。在哺乳动物细胞中,共有三种Kindlin 蛋白,即分别由Fermt1、Fermt2 和Fermt3 基因编码的Kindlin-1,2 和3[4-5]。虽然Kindlin 家族蛋白具有高度相似的结构特征,但研究表明三种Kindlin 蛋白具有不同的组织表达特异性[6]。现有实验证据显示Kindlin家族蛋白可在多种器官组织中发挥重要功能[7-11]。目前已知Kindlin-1 主要表达于皮肤及小肠等上皮组织中[6,12],然而Kindlin-1 在骨关节相关组织中的表达情况仍不清楚。本研究收集了健康及疾病状态下的骨关节组织样品,针对性研究了Kindlin-1 在健康及疾病状态下在骨关节组织中的表达情况及相关潜在功能。
1 材料与方法
1.1 实验动物、主要仪器及试剂
健康的SPF 级C57BL/6 和DB1/J 雄性小鼠用于实验,所有动物实验均通过南方科技大学实验动物中心伦理审核(SUSTC-JY2020120,SUSTech-JY2020202)。主要仪器:YB-6LF 石蜡包埋机、TST1200 包埋专用冷台、电热鼓风干燥箱(上海一恒科学仪器有限公司);RM2255 石蜡切片机(Leica 公司,德国);SP8 共聚焦显微镜(Leica 公司,德国);细胞培养箱(Thermo Fisher 公司,美国);超净工作台(Thermo Fisher 公司,美国)。主要试剂:Kindlin-1 抗体(Sigma 公司,美国,SAB4200465);CD31 抗体(Abcam 公司,美国,ab28364);Endomucin 抗体(Abcam 公司,ab106100);DMEM 培养基(Thermo Fisher 公司,美国,11965092);胎牛血清(Thermo Fisher 公司,美国,16140071);Lipofectamine RNAiMAX 转染试剂(Thermo Fisher 公司,美国,Cat#13778075)。
1.2 内侧半月板失稳定术诱导性关节炎
选取6 只2 月龄的健康C57BL/6 雄性小鼠,常规麻醉,于右下肢髌骨内侧行约1 cm 纵行切口,曲屈关节并使髌骨向外侧脱位,从而暴露关节腔。用显微镊移除脂肪垫,并用显微剪刀切断内侧半月板,缝合切口。于左下肢行假手术作为对照,即只暴露关节腔,不切断内侧半月板。造模后2 个月处死小鼠,分离两侧膝关节组织。
1.3 胶原诱导性关节炎
选取12 只2 月龄的健康DBA1/J 雄性小鼠,简单随机分为模型组6 只和对照组6 只,常规麻醉,模型组小鼠于尾根部注射用不完全弗氏佐剂乳化的牛Ⅱ型胶原0.1 mL,正常对照组同法、同部位注射0.1 mL 生理盐水,造模后48 d处死小鼠,分离两侧踝关节组织。
1.4 组织学及免疫荧光分析
骨关节组织于4%多聚甲醛中固定24 h,常规脱钙并石蜡包埋切片。根据试剂盒说明进行Safranin O &Fast Green染色(Solarbio,Cat#G1371)。免疫荧光染色中,待分析切片样品于0.2% Triton X-100 中穿透5 min,2%BSA 溶液中室温封闭1 h,并于相应一抗(1∶200)中4°C 过夜孵育,二抗(1∶200)室温孵育1 h。随后,在共聚焦显微镜(Leica SP8 Confocal Microsystems)下检测荧光信号。
1.5 细胞迁移实验
人类脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)于DMEM 培养基(10%胎牛血清)中培养,细胞密度至80%时转染Kindlin-1 siRNA,转染试剂为Lipofectamine RNAiMAX,转染条件参考试剂说明书。转染后24 h 换液,细胞密度至100%进行细胞划痕实验,动态观察划痕后0、9、18、21 h 细胞向划痕区域的迁移程度。
1.6 统计学方法
采用Graphpad Prism 8.0 软件对数据进行分析。计量资料用均数±标准差表示,两组间比较采用两独立样本t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Kindlin-1 表达于正常骨组织内并与H 型血管共定位
首先分离2 月龄健康C57BL/6 小鼠的骨关节组织,石蜡切片并用Kindlin-1 抗体进行免疫荧光标记,结果显示在健康小鼠内,骨关节表面软骨组织中无Kindlin-1 表达(见图1A 左)。Kindlin-1 阳性细胞主要分布于生长板矿化软骨区域及临近的骨髓腔内(见图1A 中),且阳性标记信号多呈圆形血管样分布(见图1A 右)。现有文献表明生长板矿化软骨及相邻的骨髓腔内主要分布有H 型血管[8],所以笔者应用CD31 和Endomucin 对H 型血管进行标记,并研究Kindlin-1 与H 型血管是否存在共定位。结果显示,Kindlin-1与H 型血管存在显著的共定位(见图1B)。
2.2 DMM 模型中Kindlin-1 显著升高并可特异性标记异常新生血管
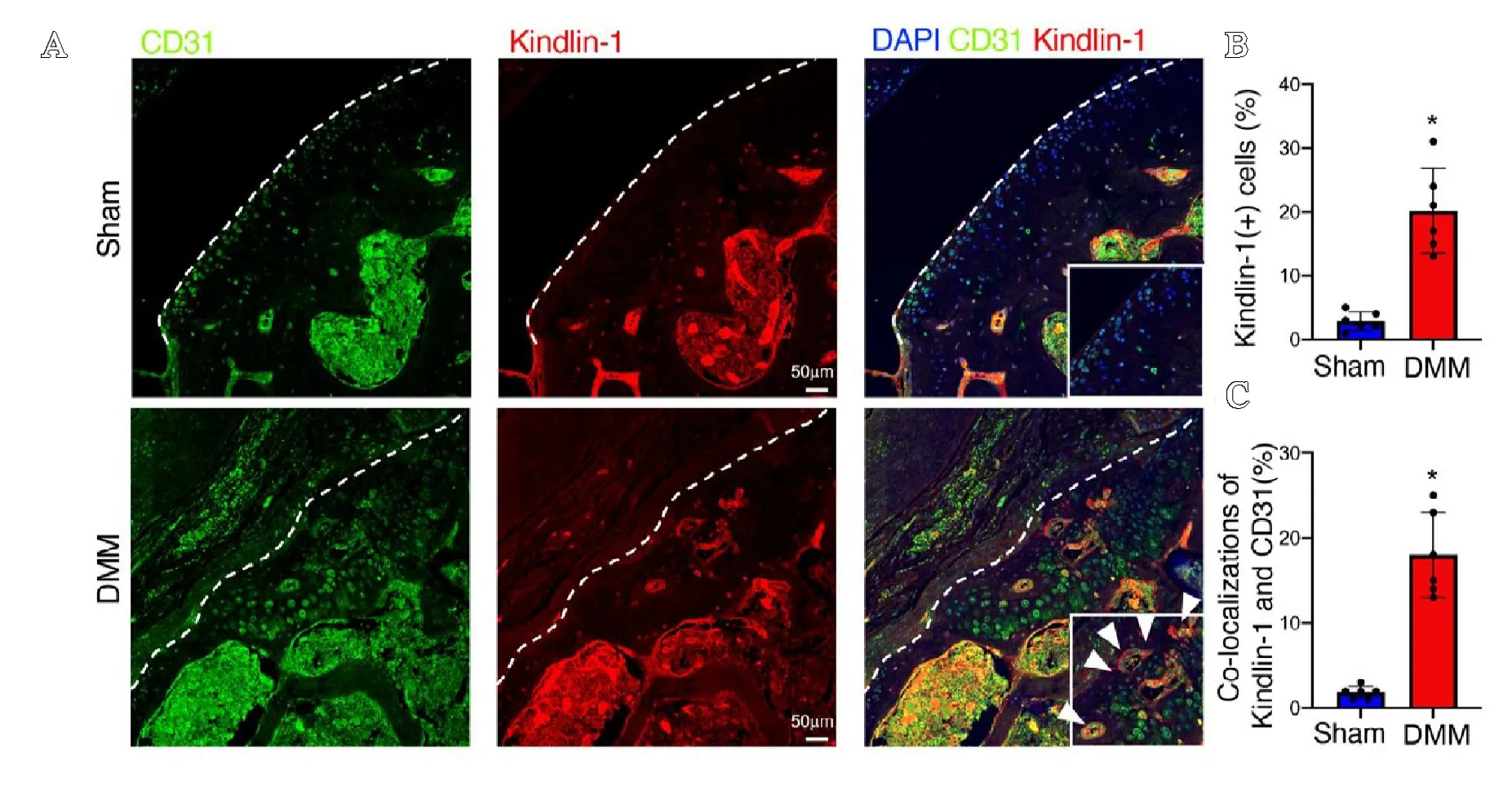
内侧半月板失稳定术(destabilization of the medial meniscus,DMM)可用于在动物模型中模拟骨性关节炎的发病过程。笔者对2 月龄C57BL/6 小鼠进行了DMM 手术,术后2 个月处死小鼠,分离膝关节组织,石蜡切片,并用Kindlin-1和CD31(血管标志物)抗体进行免疫荧光标记。结果显示,在行假手术的对照骨关节软骨组织内CD31 少量表达,且无Kindlin-1 表达(见图2A)。在行DMM 手术后的骨关节软骨组织内CD31 和Kindlin-1 的表达量显著升高,且Kindlin-1与CD31 存在显著的共定位(见图2A-C)。在骨关节半月板组织中笔者也检测到了相似的现象。在行假手术的对照半月板组织中,CD31 及Kindlin-1 均少量表达(见图2D);在行DMM 手术后的半月板组织中,CD31 与Kindlin-1 表达量均显著升高且存在共定位(见图2D-F)。以上结果提示了在骨性关节炎发病过程中,关节软骨组织内Kindlin-1 表达显著升高并可特异性标记异常新生的血管。
2.3 CIA 模型中Kindlin-1 显著升高并可特异性标记异常新生血管
胶原诱导性关节炎(collagen induced arthritis,CIA)可用于在动物模型中模拟类风湿性关节炎发病过程。笔者对2月龄DBA1/J 小鼠进行胶原诱导性关节炎,诱导48 d 后处死小鼠,分离踝关节组织,石蜡切片,并用Kindlin-1 和Endomucin(血管标志物)抗体进行免疫荧光标记。结果显示,在对照骨关节组织内Endomucin少量表达,且无Kindlin-1表达(见图3A)。在CIA 诱导后的骨关节组织内Endomucin和Kindlin-1 的表达量显著升高,且Kindlin-1 与Endomucin存在显著的共定位(见图3A-C)。对Kindlin-1 和Endomucin阳性区域进行组织学Safranin O&Fast Green 染色分析,结果显示,在炎症造成的软骨肥大及异位骨化区域,Kindlin-1和Endomucin阳性信号主要分布于肥大软骨细胞(Hypertrophic chondrocytes,HC)和新生的骨组织(Bone,B)的交界处(见图3D)。以上结果提示了在类风湿性关节炎发病过程中,关节软骨组织内Kindlin-1 表达显著升高并可特异性标记异常新生血管。
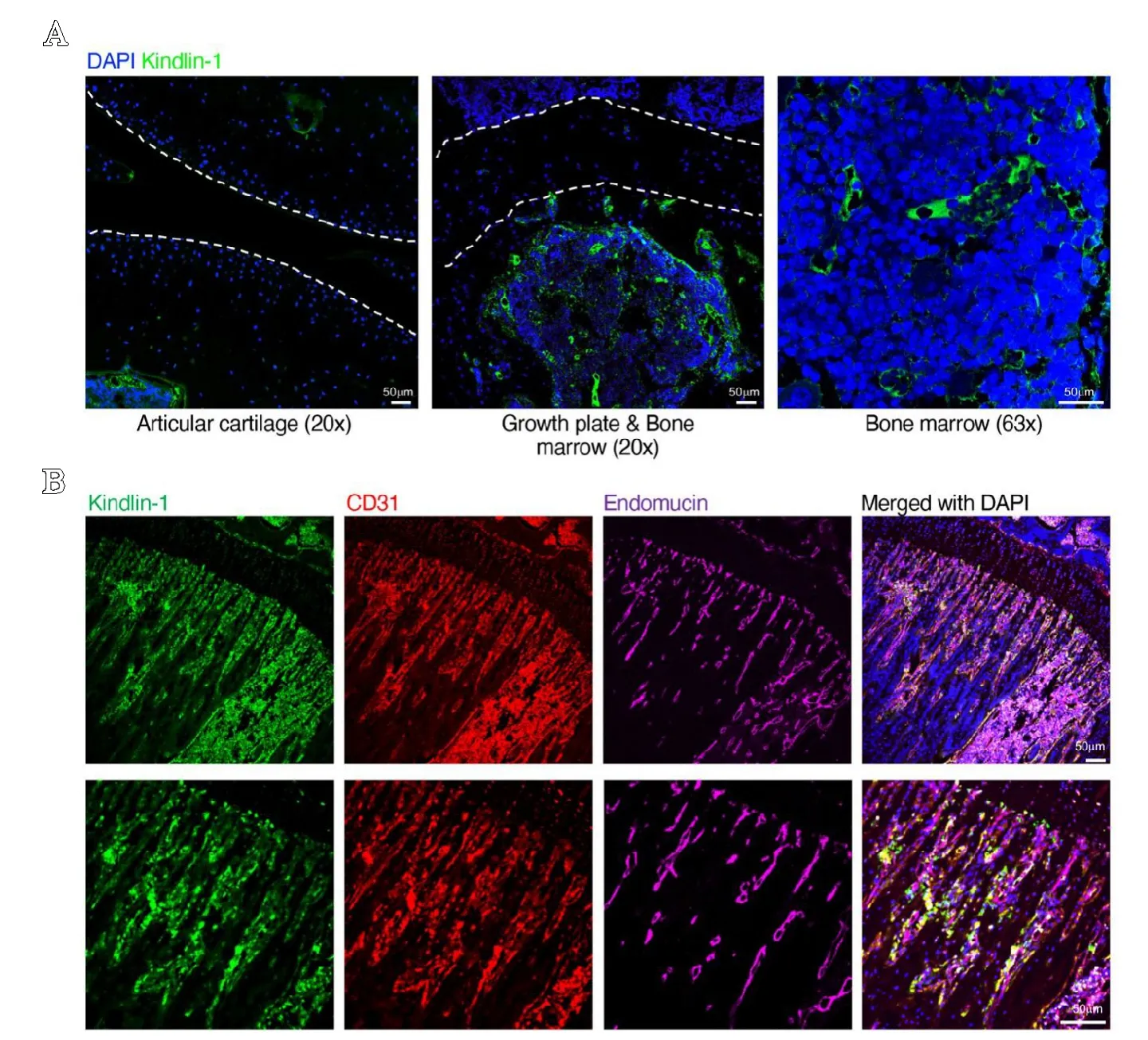
图1 A.免疫荧光分析显示健康C57BL/6 小鼠骨关节组织内Kindlin-1 的表达情况,左图为关节软骨区域,中图为生长板及临近骨髓腔区域,右图为高倍镜下的骨髓腔区域;B.免疫荧光分析显示骨髓腔内Kindlin-1 与CD31 和Endomucin 共同标记的H 型血管的表达情况
2.4 siRNA 敲除Kindlin-1 加强HUVECs 的体外迁移能力
为探索血管内皮细胞是否表达Kindlin-1 蛋白,笔者应用人类脐静脉血管内皮细胞(HUVECs),检测Kindlin-1 的表达量,结果显示HUVECs 可以表达高水平的Kindlin-1(见图4A)。为探索Kindlin-1 蛋白在血管内皮细胞内的潜在生物学功能,笔者构建并筛选了针对Kindlin-1 的siRNA 序列(#1073、#1798 和#2987)并确认了体外敲除效率,结果显示siRNA 序列#1073 和#1798 均可有效降低Kindlin-1 在HUVECs 中的表达水平(见图4A)。应用筛选到的siRNA序列,笔者研究了敲除Kindlin-1 对HUVECs 的体外迁移能力的潜在影响。结果显示,siRNA 敲除Kindlin-1 显著地加强了HUVECs 的体外迁移能力(见图4B-C)。
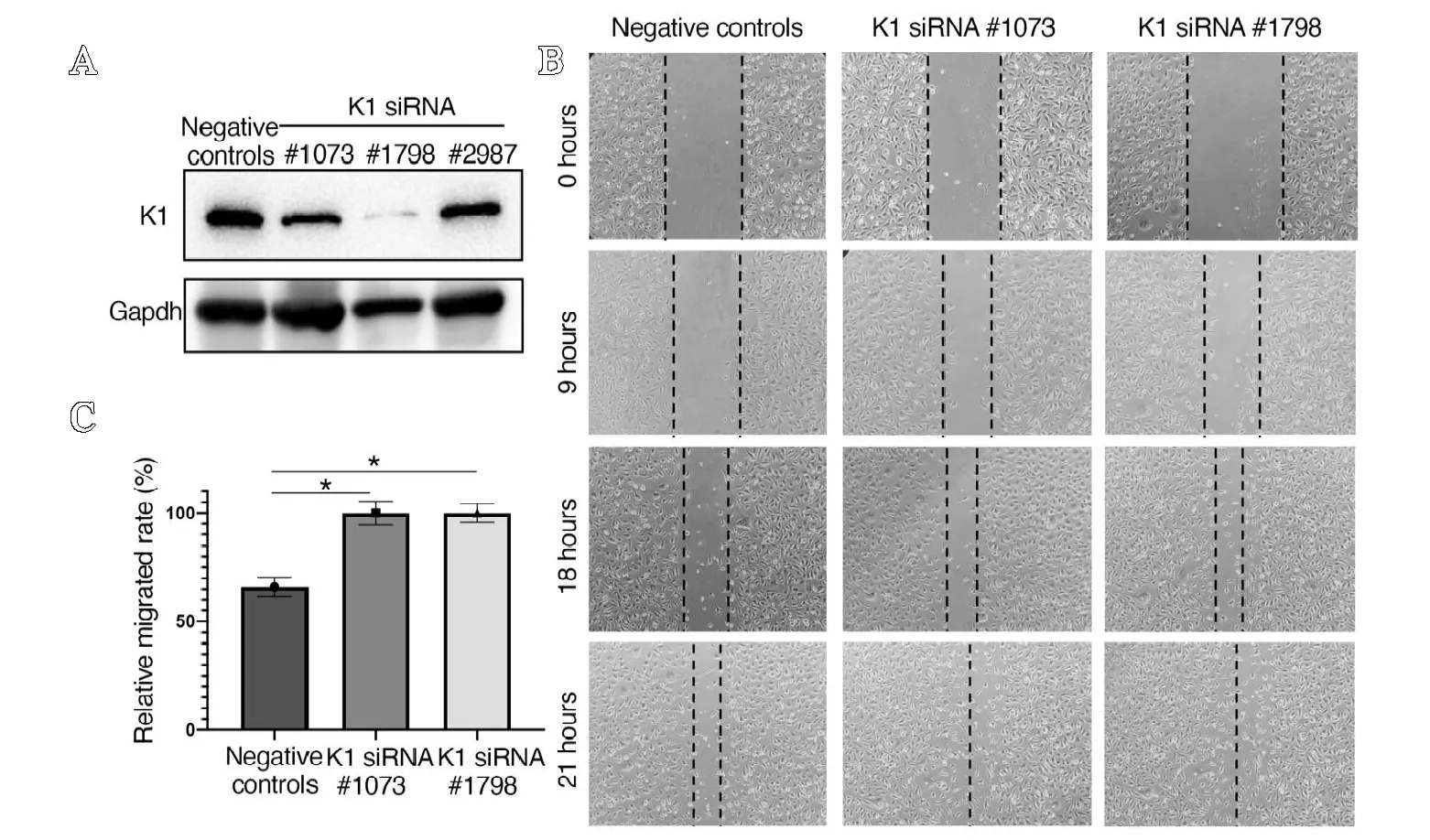
图4 A.HUVECs 筛选针对Kindlin-1 的siRNA 序列;B.HUVECs 敲除Kindlin-1 后,体外进行划痕实验观察细胞迁移能力;C.划痕迁移实验的量化数据
3 讨论
目前已知Kindlin家族蛋白具有不同的组织表达特异性,Kindlin-1 主要表达于皮肤及小肠等上皮组织中。本研究首次发现Kindlin-1 表达于正常骨组织的骨髓腔内,且与CD31和Endomucin 共同标记的H 型血管具有显著的共定位,提示了Kindlin-1 可能表达于骨髓腔的血管内皮细胞中。
在骨关节相关疾病中,异常的血管新生(angiogenesis)均扮演重要角色。例如,在骨性关节炎中,异常应力导致的软骨下骨重塑会诱发异常的血管新生侵入软骨下骨及软骨组织,异常新生的血管带来炎症因子,破骨前体细胞等进一步导致关节软骨的损伤及骨赘形成[13]。在类风湿性关节炎中,系统性自身免疫反应导致骨关节组织内滑膜组织过度增生,炎症刺激异常的血管新生在关节区域形成血管翳。血管翳带来的炎症因子等可进一步导致骨破坏[14]。为验证Kindlin-1与血管组织具有相关性的假设,笔者对两种不同类型的关节炎动物模型骨关节组织内Kindlin-1 的表达情况进行检测。实验结果表明在骨性关节炎模型和类风湿性关节炎模型中,Kindlin-1 的表达水平均显著升高,且均可特异性标记模型中的异常形成的新生血管,提示了Kindlin-1 作为骨关节相关疾病中异常新生血管标志物的潜在可能。
人类脐静脉血管内皮细胞(HUVECs)是目前最为常用的研究血管内皮细胞生物学功能的体外细胞模型。为取得Kindlin-1 在血管内皮细胞中表达的直接证据,笔者对人类脐静脉血管内皮细胞(HUVECs)进行了蛋白检测,结果表明HUVECs 可表达高水平的Kindlin-1。为探索Kindlin-1 蛋白在血管内皮细胞生物学功能中的潜在角色,笔者筛选了体外敲除Kindlin-1 的siRNA 序列,并定量观察敲除Kindlin-1对HUVECs 体外迁移能力的影响。结果表明敲除Kindlin-1显著地加强了HUVECs 的体外迁移能力,提示了Kindlin-1对血管内皮细胞生物学功能具有调控作用。值得注意的是,笔者首先发现了骨关节组织内Kindlin-1 表达与血管组织有高度相关性,且在血管新生增强的关节病变组织中显著升高,这使我们假设在血管内皮细胞中敲除Kindlin-1 会影响血管内皮细胞的相关功能。出人意料的是,实验结果证明在人脐静脉血管内皮细胞中敲除Kindlin-1 显著增强了细胞的迁移能力,提示了Kindlin-1 在血管新生中可能扮演着抑制因子的角色,其升高可能是血管新生过程中的伴随结果而非起因。同时,虽然人脐静脉血管内皮细胞是目前最为常用的研究血管内皮细胞相关功能的体外细胞模型,其是否能在体外环境模拟骨关节病变组织内异常的血管新生过程仍有待进一步验证。后续实验需进一步设计体外和体内实验来验证血管内皮细胞表达Kindlin-1 在生理病理条件中的相关功能。
本实验初步探索了Kindlin-1 在骨关节组织内的表达情况及功能,提示了Kindlin-1 作为血管组织标志物及潜在靶点的可能性。然而,目前仍缺乏活体动物实验数据验证Kindlin-1在血管新生过程中的作用和相关机制,后续实验应构建转基因动物以研究Kindlin-1 在血管内皮细胞内的功能及其在活体环境下与疾病发生发展的关系进行进一步探索研究。

