黄芪甲苷通过TGF-β1/Smad3信号通路对慢性心力衰竭大鼠心肌细胞凋亡的影响及机制研究
宋爱新,王 璐,张媛媛
慢性心力衰竭是各种心血管疾病终末期阶段的共同表现,由于心肌受损导致心肌结构和功能变化,最终引起心室射血及充盈能力受损的一组临床综合征,其发病率和住院率均较高,是心血管疾病病人死亡的主要原因之一[1]。慢性心力衰竭病因复杂,常见病因主要有冠心病、高血压、风湿性心脏病等,临床表现为呼吸困难、咳嗽、水肿等,病理学表现为心脏扩大变性、心肌细胞凋亡、心肌纤维增生及炎性细胞浸润,最终导致心室重构及心功能下降[2]。目前,临床上主要使用β-受体阻滞剂、利尿剂等西药治疗,但有较多不良反应和禁忌证。黄芪是中国传统补气中药,有补气升阳、托毒利脓、固表止汗、利水消肿等作用,在心血管系统疾病方面有广泛应用前景[3]。黄芪甲苷(astragaloside Ⅳ,ASⅣ)是从黄芪中提取的一种皂苷类化合物,具有保护心肌细胞、提高心脏功能等作用,对心血管系统疾病具有一定治疗作用[4-5]。ASⅣ已被证实具有保护心肌作用,但其具体作用机制研究较少,本研究通过建立慢性心力衰竭大鼠模型,观察黄芪甲苷对大鼠心肌细胞凋亡的影响,探讨其可能作用机制,为临床治疗慢性心力衰竭提供理论依据。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级SD大鼠55只,雄性,7周龄,体质量(260±20)g,购自上海杰思捷实验动物有限公司,生产许可证号:SCXK(沪)2018-0004。保持温度(22±2)℃,相对湿度为(55±5)%,明暗周期12 h/12 h,大鼠购入后适应性饲养7 d。
1.2 药物、主要试剂和仪器 黄芪甲苷(纯度≥98%,南京春秋生物工程有限公司),盐酸贝那普利片(批准文号:国药准字H20053390,10 mg,成都地奥制药集团有限公司生产),原位末端标记(TUNEL)试剂盒(北京中杉试剂公司),兔抗大鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)多抗、Smad3多抗、半胱氨酰天冬氨酸特异性蛋白酶(cysteiny aspartate specific protease-3,Caspase-3)多抗(美国Abcam公司),VEVO2100小动物高分辨率超声成像系统(加拿大Visual Sonics公司),iWorx动物多导生理记录仪(美国iWorx公司)。
1.3 方法
1.3.1 慢性心力衰竭大鼠模型的建立及分组 随机取45只大鼠,依照文献[6]方法,采用主动脉缩窄法建立慢性心力衰竭大鼠模型。大鼠术前禁食不禁水24 h,使用1%戊巴比妥钠(40 mg/kg)麻醉后仰卧固定,腹部备皮,自剑突下1 cm处腹部正中纵向切口,约2 cm,分离皮肤,打开腹腔,游离腹主动脉,采用4号手术线进行结扎,使腹主动脉缩窄至原来直径的40%~60%,关闭腹腔,逐层缝合。术后继续饲养8周,超声心动图检测造模大鼠心功能,显示左室射血分数(left ventricular ejection fraction,LVEF)≤45%,表示造模成功。将造模成功的41只大鼠随机分为模型组(11只)、ASⅣ低剂量组(10只)、ASⅣ高剂量组(10只)和阳性对照组(10只)。剩余10只大鼠作为假手术组,分离腹主动脉,但不结扎,其余操作同上。所有大鼠术后按每只2×105U青霉素腹腔注射以防感染,连续注射3 d。
1.3.2 干预方法 末次干预12 h后,ASⅣ和盐酸贝那普利片以1%羧甲基纤维素(CMC)溶解,根据临床人用剂量等量换算,ASⅣ低剂量组、ASⅣ高剂量组和阳性对照组大鼠分别按体质量灌胃25 mg/kg、50 mg/kg黄芪甲苷溶液和0.9 mg/kg盐酸贝那普利溶液,模型组和假手术组给予同体积的1% CMC灌胃。每天干预1次,连续8周。
1.3.3 超声检测心功能指数 末次灌胃后2 h,将大鼠仰卧固定,超声检测心功能。记录大鼠LVEF、左室收缩末期内径(left ventricular end systolic dimension,LVESD)、左室舒张末期内径(left ventricular end diastolic dimension,LVEDD)。
1.3.4 血流动力学检测 心功能检测完毕后,腹腔注射戊巴比妥钠麻醉大鼠,颈部备皮后右侧颈部行2 cm切口,分离颈总动脉,结扎远心端,近心端做一切口,导管一端经此切口插入左心室,另一端接压力传感器,连接生理信号采集系统,测定左室舒张末压(left ventricular end diastolic pressure,LVEDP)、左室收缩末压(left ventricular end systolic pressure,LVESP)、左室内压最大上升速率(+dp/dtmax)、左室内压最大下降速率(-dp/dtmax)。
1.3.5 苏木素-伊红(HE)染色和Massion染色观察心肌病理变化 检测完血流动力学,处死大鼠,开胸取出心脏,冲洗干净,滤纸吸干水分和血迹,沿房室沟剪去左右心房,剪掉主动脉和肺动脉,剪去右心室,留取左心室,从左心室中部横轴切下部分心肌组织(约0.5 cm厚)于4%多聚甲醛中固定72 h。经脱水、透明、石蜡包埋、切片(厚度约4 μm)后分别进行HE染色和Massion染色,乙醇脱水、二甲苯透明、中性树胶封片后置于显微镜下观察心肌病理变化。
1.3.6 TUNEL染色观察心肌细胞凋亡情况 取心肌石蜡切片,常规脱蜡脱水处理,加入3%过氧化氢(H2O2)处理,蛋白酶K消化20 min,磷酸缓冲盐溶液(PBS)冲洗,加入TUNEL反应液,37 ℃湿盒中反应1 h,PBS冲洗,加入POD转化剂,37 ℃反应30 min,PBS冲洗,加入DAB显色,封片镜检,细胞核中有棕色颗粒者为凋亡细胞,计算凋亡率,凋亡率=凋亡细胞数/细胞总数×100%。
1.3.7 定量聚合酶链反应(qPCR)法检测心肌组织TGF-β1、Smad3、Caspase-3 mRNA相对表达水平 将剩余部分心肌组织放入液氮中保存。取液氮保存的心肌组织70 mg,研磨匀浆,离心后取上清液,提取总RNA,用紫外分光光度法测定RNA浓度,按照逆转录试剂盒说明书逆转录cDNA,配制20 μL反应体系,包括上下游引物各0.5 μL,模板DNA 1 μL,2×SYBR Mixture 10 μL,加双蒸水至总体积20 μL。设置反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,35个循环;以β-actin内参作为对照,采用2-△△CT法计算目的基因的相对表达水平。引物序列均由上海生工设计合成,基因聚合酶链反应(PCR)引物序列见表1。
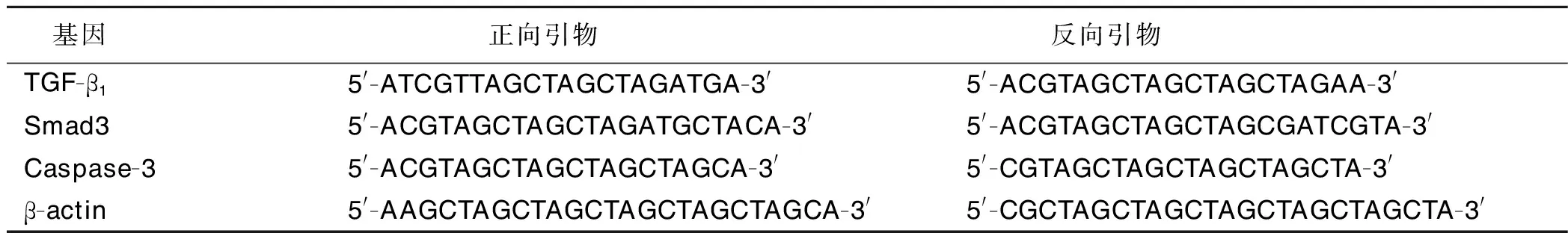
表1 PCR引物序列
1.3.8 蛋白免疫印迹(Western Blot)法检测心肌组织TGF-β1、Smad3、p-Smad3、Caspase-3蛋白相对表达水平 取液氮保存心肌组织80 mg,RIPA细胞裂解液裂解细胞,离心后取上清液,按照BCA试剂盒说明书测定蛋白浓度,100 ℃水浴加热10 min,蛋白变性。制备样品,配制凝胶,蛋白上样,加入等量上样缓冲液,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后将蛋白转至聚偏氟乙烯(PVDF)膜上,TBST溶液洗膜3次,5%脱脂牛奶封闭2 h,将膜放入稀释的TGF-β1、Smad3、p-Smad3、Caspase-3一抗(1∶2 000)中4 ℃孵育过夜,TBST溶液洗膜3次,放入辣根过氧化物酶(HRP)标记的二抗(1∶50 000)中,室温孵育1 h,TBST溶液洗膜3次,加入ECL发光液,曝光、显影,凝胶成像分析系统分析结果。以TGF-β1、Smad3、p-Smad3、Caspase-3蛋白条带灰度值与β-actin比值作为蛋白相对表达水平。
2 结 果
2.1 各组大鼠心功能指标比较 与假手术组比较,模型组、ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组LVEF降低,LVESD、LVEDD升高(P<0.05);与模型组比较,ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组LVEF升高,LVESD、LVEDD降低(P<0.05);与ASⅣ低剂量组比较,ASⅣ高剂量组、阳性对照组LVEF升高,LVESD、LVEDD降低(P<0.05);阳性对照组LVEF略高于ASⅣ高剂量组,LVESD、LVEDD略低于ASⅣ高剂量组,差异均无统计学意义(P>0.05)。详见表2。
表2 各组大鼠心功能指标比较(±s)
2.2 各组大鼠血流动力学指标比较 与假手术组比较,模型组、ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组LVESP、+dp/dtmax、-dp/dtmax降低,LVEDP升高(P<0.05);与模型组比较,ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组LVESP、+dp/dtmax、-dp/dtmax升高,LVEDP降低(P<0.05);与ASⅣ低剂量组比较,ASⅣ高剂量组、阳性对照组LVESP、+dp/dtmax、-dp/dtmax升高,LVEDP降低(P<0.05);阳性对照组LVESP、+dp/dtmax、-dp/dtmax高于ASⅣ高剂量组,LVEDP低于ASⅣ高剂量组,但差异无统计学意义(P>0.05)。详见表3。
表3 各组大鼠血流动力学指标比较(±s)
2.3 HE染色观察心肌组织病理学变化 HE染色显示,假手术组心肌细胞形态正常,肌纤维排列整齐,结构清晰,细胞连接紧密;模型组心肌细胞水肿,肌纤维排列紊乱、断裂,细胞间质水肿,可见炎性浸润;ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组均较模型组有不同程度改善,心肌细胞损伤减轻,肌纤维排列较规则,其中ASⅣ高剂量组和阳性对照组改善较明显。详见图1。
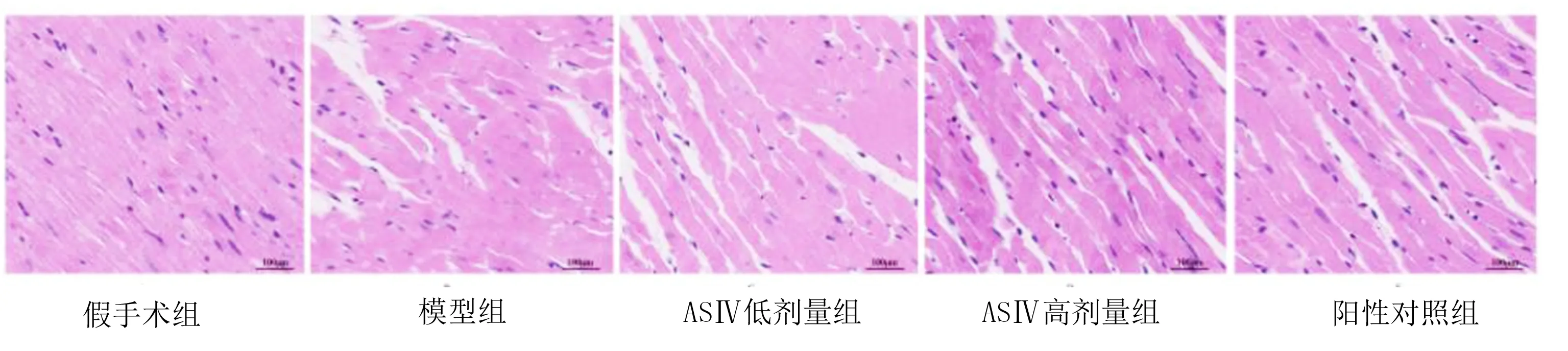
图1 心肌组织HE染色(×200)
2.4 Massion染色观察心肌组织病理学变化 Massion染色显示,假手术组仅有极少量胶原纤维分布于细胞间隙;模型组心肌细胞周围出现大量蓝色胶原纤维分布;ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组胶原纤维较模型组明显减少。详见图2。
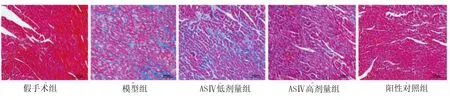
图2 心肌组织Massion染色(×200)
2.5 TUNEL染色观察心肌细胞凋亡情况 假手术组、模型组、ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组心肌细胞凋亡率分别为(3.67±1.59)%、(72.56±6.25)%、(43.14±5.18)%、(22.48±4.69)%、(19.58±4.62)%,细胞凋亡率组间比较差异有统计学意义(F=327.466,P<0.001)。与假手术组比较,模型组、ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组细胞凋亡率升高(P<0.001);与模型组比较,ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组细胞凋亡率降低(P<0.001);与ASⅣ低剂量组比较,ASⅣ高剂量组、阳性对照组细胞凋亡率降低(P<0.001);阳性对照组细胞凋亡率略低于ASⅣ高剂量组,差异无统计学意义(P>0.05)。详见图3。
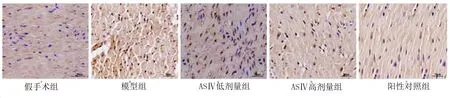
图3 心肌组织TUNEL染色(×400)
2.6 心肌组织TGF-β1、Smad3、Caspase-3 mRNA相对表达水平 心肌组织TGF-β1、Caspase-3 mRNA相对表达水平组间比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组、ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组心肌组织TGF-β1、Caspase-3 mRNA相对表达水平升高(P<0.05);与模型组比较,ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组的TGF-β1、Caspase-3 mRNA相对表达水平降低(P<0.05);与ASⅣ低剂量组比较,ASⅣ高剂量组、阳性对照组TGF-β1、Caspase-3 mRNA相对表达水平降低(P<0.05);阳性对照组TGF-β1、Caspase-3 mRNA相对表达水平低于ASⅣ高剂量组,差异均无统计学意义(P>0.05)。各组Smad3 mRNA相对表达水平比较,差异无统计学意义(P>0.05)。详见表4。
表4 心肌组织TGF-β1、Smad3、Caspase-3 mRNA相对表达水平比较(±s)
2.7 心肌组织TGF-β1、Smad3、p-Smad3、Caspase-3蛋白相对表达水平比较 与假手术组比较,模型组、ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组心肌组织TGF-β1、p-Smad3、Caspase-3蛋白相对表达水平升高(P<0.05);与模型组比较,ASⅣ低剂量组、ASⅣ高剂量组、阳性对照组TGF-β1、p-Smad3、Caspase-3蛋白相对表达水平降低(P<0.05);与ASⅣ低剂量组比较,ASⅣ高剂量组、阳性对照组TGF-β1、p-Smad3、Caspase-3蛋白相对表达水平降低(P<0.05);阳性对照组TGF-β1、p-Smad3、Caspase-3蛋白相对表达水平低于ASⅣ高剂量组,但差异均无统计学意义(P>0.05)。各组Smad3蛋白相对表达水平比较,差异无统计学意义(P>0.05)。详见表5、图4。
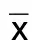
表5 心肌组织TGF-β1、Smad3、p-Smad3、Caspase-3蛋白相对表达水平比较(±s)

图4 心肌组织TGF-β1、Smad3、p-Smad3、Caspase-3蛋白相对表达水平
3 讨 论
多种病理因素均可引起慢性心力衰竭,导致心脏功能受损,使病人长期反复住院治疗,严重影响病人生活质量和生命健康。目前,研究认为,引起慢性心力衰竭的关键因素主要有心肌细胞凋亡、心肌纤维化、心室重构及多种信号通路异常激活或抑制等因素,经过治疗后,部分病人心脏功能得以恢复或者部分恢复,能够改善病人临床症状,提高预后[7-8]。ASⅣ具有广泛的药理作用,尤其在心血管疾病中的作用日渐受到重视,本研究从心脏结构和功能、血流动力学以及心肌细胞凋亡方面评价ASⅣ对慢性心力衰竭大鼠的心肌保护作用,初步探讨其可能作用机制。
心室重构是慢性心力衰竭的重要病理基础,是指心肌受到外来因素影响出现的代偿性改变,包括心室结构和功能等方面的变化,抑制心室重构是抑制心脏疾病的关键步骤[9-10]。LVEF、LVESD、LVEDD是评价心室结构和功能的主要指标,LVEF是心室泵血功能的重要参数,心室泵血功能是临床判断心功能的主要指标,LVESD和LVEDD反映心室收缩功能。血流动力学指标是评价心肌收缩和舒张功能的重要指标,LVESP和+dp/dtmax反映心肌收缩功能,LVEDP与心肌舒张功能呈负相关,-dp/dtmax反映心肌舒张功能。心肌纤维化是心室重构的重要病理特征,发生慢性心力衰竭的大鼠心肌细胞凋亡率与心肌纤维化的变化程度呈正相关[11]。ASⅣ对心肌梗死动物具有心肌保护作用,并可抑制慢性心力衰竭大鼠心室重构,改善心脏功能[12-13]。ASⅣ还可保护心肌细胞免受病毒性心肌炎引起的心肌细胞损伤和纤维化,减少心肌细胞凋亡,保护心肌细胞[14]。本研究成功建立慢性心力衰竭大鼠模型,经不同剂量ASⅣ治疗后,心功能指标、血流动力学指标、心肌病理形态均有明显改善,抑制心肌细胞纤维化,降低细胞凋亡率,且ASⅣ高剂量组与阳性对照组的改善效果差异无统计学意义,提示ASⅣ可减少慢性心力衰竭大鼠心肌细胞凋亡和纤维化,逆转心室重构,对心功能具有显著改善作用。
TGF-β1/Smad3信号通路在多种疾病的纤维化重构中起关键作用。TGF-β1是激活成纤维细胞的关键因子,通过诱导胶原纤维合成,引起器官纤维化,导致心室重构,是引发心脏疾病的关键因素。Smad蛋白是TGF-β1下游介质之一,Smad3是Smad家族成员之一,由TGF-β1激活,在心脏疾病中表达明显上调,参与促进心肌纤维化,引起心室重构。TGF-β1/Smad3信号通路的激活对心室重构的致病过程起着关键的促进作用[15]。Caspase-3蛋白是凋亡过程中的主要效应因子,激活后可使凋亡抑制物失活,激活凋亡调节蛋白,促使细胞凋亡。研究显示,在非酒精性脂肪肝、动脉粥样硬化疾病过程中,TGF-β1/Smad3信号通路参与介导肝细胞及血管内皮细胞的凋亡和纤维化[16-17]。已有研究显示,在心肌梗死和心肌缺血再灌注动物模型中,抑制TGF-β1/Smad3信号通路,可明显抑制左心室重构,发挥抗心肌重塑作用[18-19]。本研究经不同剂量ASⅣ治疗后,大鼠心肌组织中TGF-β1、p-Smad3、Caspase-3蛋白表达明显下降,心肌纤维化和凋亡率明显下降,ASⅣ高剂量效果优于低剂量,且与阳性对照药物效果差异无统计学意义,提示ASⅣ减少慢性心力衰竭大鼠心肌凋亡率,抑制心肌纤维化,可能是通过抑制TGF-β1/Smad3信号通路活化,发挥逆转心室重构的作用。
综上所述,ASⅣ能够改善慢性心力衰竭大鼠心肌功能,减少心肌纤维化,降低心肌细胞凋亡率,逆转心室重构,其可能是通过抑制TGF-β1/Smad3信号通路发挥作用,为临床治疗慢性心力衰竭提供一定的理论依据。

