GW9662对内脏脂肪素诱导的THP-1源性泡沫细胞的作用
庄世虹 成蓓
(1南京医科大学附属南京医院 南京市第一医院老年医学科,江苏 南京 210006;2华中科技大学同济医学院附属协和医院老年医学科)
在动脉粥样硬化(AS)形成的过程中,过氧化物酶体增殖物活化受体(PPAR)γ在糖脂代谢平衡中的作用越来越受到重视,它与代谢综合征的胰岛素抵抗、高血压、肥胖的发生密切相关。PPARγ作为一种重要的核受体,其被证实能在巨噬细胞核内表达,并能通过调控胆固醇代谢的关键酶来保持脂质稳态〔1〕。Dahl等〔2〕发现内脂素(visfatin)在AS斑块巨噬细胞中表达明显增加,冠心病患者中其表达水平明显升高。visfatin有促进巨噬细胞源性泡沫细胞形成的作用,本研究运用PPARγ拮抗剂GW9662进一步确证PPARγ信号通路对visfatin调控的巨噬细胞泡沫化的影响。
1 材料与方法
1.1主要试剂 人单核细胞(THP-1)购自武汉大学生物研究所,RPMI1640干粉培养基和胎牛血清购自美国Gibco公司,GW9662购自瑞士Alexis公司,佛波酯、TritonX-100购自美国Sigma公司,人重组visfatin购自美国Peprotech公司,蛋白提取试剂盒购自上海Beyotime公司,总胆固醇(TC)测定试剂盒购自北京五洲元业生物公司,游离胆固醇(FC)测定试剂盒购自美国Cayman公司,丽春红染液、异硫氰酸罗丹明(TRITC)标记的荧光试剂盒和异硫氰酸荧光素(FITC)标记的荧光试剂盒购自武汉博士德公司,鼠抗人腺嘌呤核苷三磷酸(ATP)结合盒转运蛋白(ABC)A1和兔抗人ABCG1一抗购自英国Abcam公司,硝酸纤维素膜购自英国Whatman公司,增强型化学发光(ECL)液发光试剂盒购自美国Pierce公司,辣根过氧化物酶标记的羊抗鼠和羊抗兔二抗购自北京中杉金桥公司,兔抗人β-actin一抗购自美国Cell signal公司,其他试剂均为国产分析纯。
1.2提取低密度脂蛋白(LDL) 取健康人血浆200 ml,用密度梯度离心法〔3〕离心后吸取离心管中间层的淡黄色脂蛋白条带为所需的LDL,将其装入透析袋中,置于磷酸盐缓冲液(PBS)中充分透析24 h,经聚乙二醇浓缩,调整浓度为100 mg/L。无菌0.45 μm微孔滤膜过滤除菌,4℃冰箱中避光保存,2 w内使用。
1.3实验分组和细胞干预 取对数生长期的THP-1加入含160 nmol/L佛波酯和10%胎牛血清的RPMI1640培养液中培养48 h诱导分化为巨噬细胞:细胞由悬浮状态变为贴壁状态,形状由圆形变为梭形或不规则形。各组按照以下方案加入不同的干预因素:visfatin组:加入2×10-6mol/L visfatin后并加入100 mg/L LDL的培养液孵育处理24 h;不同浓度GW9662组:分别给予1、5、10、20 μmol/L GW9662,再加入2×10-6mol/L visfatin和100 mg/L LDL孵育24 h;LDL组:仅加入100 mg/L LDL。
1.4油红O染色 各组细胞用PBS清洗2次,4%多聚甲醛固定10 min,加入油红O染液染色10 min,再用苏木素染液复染5 min,水洗后封片,光镜下观察细胞质内的红色颗粒状物质为经油红O染液染色后的细胞质内脂质,细胞核为蓝色。
1.5泡沫细胞计数 按Wada等〔4〕的方法进行油红O染色后的半定量分析:将细胞质内脂质面积<细胞核面积记为“-”;细胞质内脂质面积≥细胞核面积记为“+”,即表示泡沫细胞,每一块玻片随机计数100个细胞。
1.6细胞内TC和FC含量的测定 各组细胞用PBS清洗2次,刮下后离心取沉淀,用PBS清洗细胞沉淀2次,离心后弃去上清,加入7.2%三氯乙酸去蛋白,再加入等体积的氯仿和甲醇的混合溶液,冰浴中超声破碎仪破碎细胞,离心后吸取上清,按照TC和FC测定试剂盒的使用说明分别测定细胞内TC和FC含量,并将剩余的细胞沉淀物溶于0.1 mol/L氢氧化钠之后,二喹啉甲酸(BCA)法测定细胞内蛋白质含量,以每毫克细胞蛋白质中含有胆固醇的微克数(μg/mg)作为胆固醇含量的计算单位。胆固醇酯(CE)等于TC与FC之间的差值。细胞内CE/TC比值均大于50%提示泡沫细胞形成。
1.7细胞内免疫荧光化学的表达 各组细胞经PBS清洗3次后加入4%多聚甲醛固定10 min,PBS清洗3次,每次5 min,然后用含有0.25%TritonX-100的PBS透化20 min,再用PBS清洗3次,每次5 min,之后加入正常山羊血清封闭 30 min,甩掉溶液后,加入鼠抗人ABCA1或者兔抗人ABCG1一抗在4℃孵育过夜,PBS清洗3次,再加入TRITC或者FITC标记的二抗(1∶100稀释),室温下孵育1 h,PBS清洗3次,每次5 min,再用免疫荧光显微镜观察细胞荧光情况。ABCA1和ABCG1主要在细胞浆内表达,通过荧光显微镜观察:TRITC标记的ABCA1显示为红色荧光,FITC标记的ABCG1显示为绿色荧光。
1.8Western印迹法检测ABCA1和ABCG1蛋白表达 收集不同条件处理的各组细胞,BCA法测定蛋白质浓度,9%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行蛋白分离,每孔上样量50 μg,转膜后取出含有目的蛋白的硝酸纤维素膜,将膜放入自制的密封袋中,加入鼠抗人ABCA1一抗(1∶200稀释)、兔抗人ABCG1一抗(1∶200稀释)、兔抗人β-actin一抗(1∶1 000稀释),置于摇床上4℃孵育过夜;漂洗后分别加入辣根过氧化物酶标记的羊抗鼠和羊抗兔(1∶1 000稀释)二抗,室温孵育90 min,将膜与ECL液发光试剂盒发光显影,凝胶成像。Quantity One软件对ABCA1及ABCG1蛋白与β-actin蛋白的光密度比值做定量分析。
1.9统计学方法 采用SPSS13.0软件进行t检验。
2 结 果
2.1油红O染色结果 LDL组胞质内红色脂质很少,visfatin组细胞质内可见有大量红色脂质,不同浓度GW96625组细胞质内红色脂质的含量较visfatin组逐渐增多,并随着GW96625浓度的增加,细胞质内脂质的含量明显增多,见图1。

1:visfatin组;2:1 μmol/L GW9662+visfatin组;3:5 μmol/L GW9662+visfatin组;4:10 μmol/L GW9662+visfatin组;5:20 μmol/L GW9662+visfatin组;6:LDL组,下图同图1 各组巨噬细胞泡沫化(油红O染色,×400)
2.2泡沫细胞计数 visfatin组与1、5、10、20 μmol/L GW9662+visfatin组及LDL组对应的油红O染色阳性的泡沫细胞计数显示依次为:(43.67 ±1.25)个,(49.33±2.36)个,(59.67±1.70)个,(64.67±2.05)个,(65.33±3.09)个,(5.67 ±0.47)个。LDL组油红O染色阳性的泡沫细胞数目很少,visfatin组和不同浓度GW9662组油红O染色阳性的泡沫细胞数目较LDL组显著增多(P<0.05)。并且随着GW9662浓度增加,与visfatin组比较,不同浓度GW9662组泡沫细胞数目显著增多(P<0.05)。
2.3细胞内CE与TC比值 LDL组细胞内CE与TC比值低,visfatin组和不同浓度GW9662组CE/TC比值较LDL组显著增加(P<0.05)。并且随着GW9662浓度增加,与visfatin组比较,不同浓度GW9662组CE/TC比值显著增加(P<0.05),见表1。

表1 各组细胞内CE与TC比值
2.4细胞内免疫荧光化学表达 LDL组胞质中红色和绿色荧光含量降低,visfatin组和不同浓度GW9662组胞质中红色和绿色荧光含量逐渐降低。并且随着GW9662浓度增加,与visfatin组比较,不同浓度GW9662组胞质中红色和绿色荧光含量逐渐降低,见图2。
2.5ABCA1和ABCG1 蛋白表达 visfatin组与1、5、10、20 μmol/L GW9662+visfatin组及LDL组ABCA1对应的光密度比值显示依次为:(3.45±0.06),(2.68±0.06),(2.21±0.04),(1.65±0.04),(1.46±0.02),(3.90±0.02);以上各组ABCG1对应的光密度比值显示依次为:(2.19±0.05),(1.98±0.02),(1.88±0.03),(1.12±0.04),(0.88±0.03),(2.65±0.04)。与LDL组相比,visfatin组和不同浓度GW9662组细胞ABCA1和ABCG1蛋白表达显著降低(P<0.05)。并且随着GW9662浓度增加,与visfatin组比较,不同浓度GW9662组ABCA1和ABCG1 蛋白表达显著下降(P<0.05)。见图3。
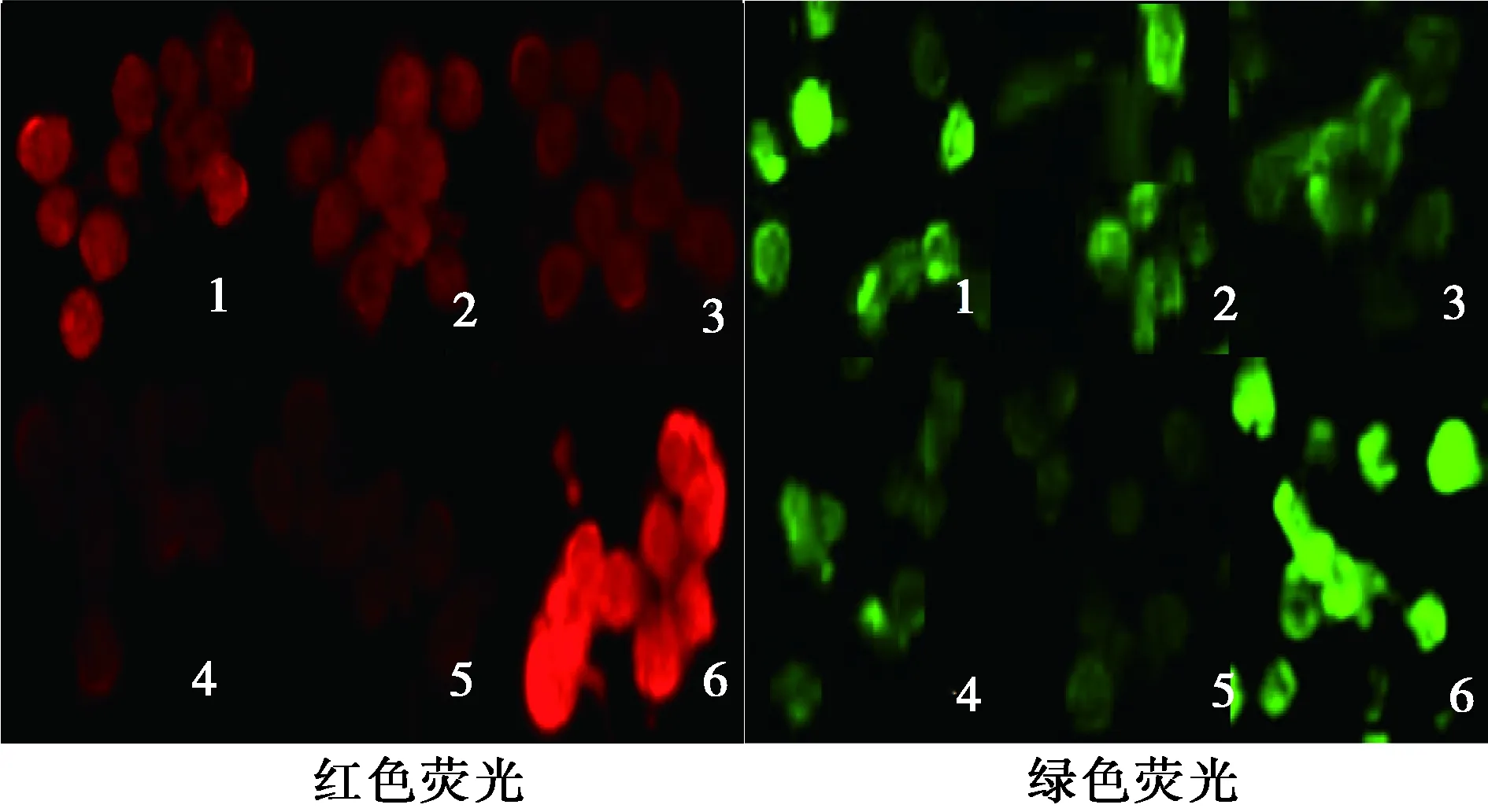
图2 各组免疫荧光表达(免疫荧光染色,×200)

图3 各组ABCA1和ABCG1蛋白表达
3 讨 论
visfatin称为烟酰胺磷酸核糖转移酶(NAMPT)或前B细胞集落增强因子(PBEF),是新发现的一种主要由脂肪组织分泌的脂肪因子〔5〕,首次被鉴定为来自人外周血淋巴细胞cDNA文库的PBEF,随后发现其是一种多效性蛋白质。作为一个重要的中介,脂肪组织中的巨噬细胞是visfatin主要来源〔6〕,具有至少3种已知的特定功能特性:在催化烟酰胺产生烟酰胺腺嘌呤二核苷酸(NAD+)的限速步骤中起酶的作用;是一种新型胰岛素脂肪分泌因子;是促炎和免疫调节过程中的调节因子,其涉及许多疾病过程,包括AS。
visfatin在AS中具有促炎和促血管生成的特性,据报道在AS不稳定斑块处的泡沫细胞和巨噬细胞可表达这种特性〔7〕。Dahl等〔2〕发现AS不稳定斑块中巨噬细胞visfatin mRNA水平增加,表明visfatin在炎症和斑块不稳定中起作用。有研究发现血清visfatin水平升高〔8〕与慢性血液透析患者的AS〔9〕和代谢综合征患者颈动脉AS有关。细胞内visfatin和PPARγ表达与人类AS具有强相关性,而与正常的动脉并无相关性〔10〕。在血管壁损伤处聚集大量可释放的CE和FC的泡沫细胞,形成了AS斑块脂质核心〔11〕。visfatin具有促进细胞内CE蓄积、抑制FC流出而导致巨噬细胞泡沫化的作用。胆固醇输出主要由几种细胞膜胆固醇转运蛋白介导,包括ABCA1和ABCG1。超过50%的胆固醇通过ABCA1从巨噬细胞中排出,而在晚期斑块中,ABCA1的表达下降导致胆固醇外流减少80%。ABCA1和ABCG1的AS保护功能取决于它们动员细胞内胆固醇的能力。ABCA1可介导胆固醇和磷脂向脂质缺乏受体如载脂蛋白(apo)A-Ⅰ的输出,而ABCG1可介导甾醇输出至脂质受体如高密度脂蛋白(HDL)。ABCA1和ABCG1一起能介导大多数细胞胆固醇输出。肝脏X受体(LXRα)和PPARγ作为胆固醇传感器而发挥作用,通过ABCA1、ABCG1和B类1型清道夫受体(SR-B1)刺激胆固醇从细胞外流到HDL,可以防止胆固醇过量蓄积〔12〕。
本文证实PPARγ信号通路参与了visfatin双重调控脂质稳态的机制。visfatin作为人巨噬细胞中的PPARγ靶基因,活化PPARγ诱导人巨噬细胞中的visfatin基因和蛋白分泌〔13〕。激活PPARγ通路能减轻一系列的炎症反应〔14〕,减少白细胞介素(IL)-6和肿瘤坏死因子(TNF)-α的分泌〔15〕,并能增强胰岛素敏感性,阻断TNF-α激活的胰岛素信号通路。PPARγ能抑制泡沫细胞的形成〔16〕,PPARγ在巨噬细胞中对visfatin的诱导有助于增强细胞内NAD+浓度。有研究显示在特异性敲除PPARγ的巨噬细胞中大量的炎症基因表达会加重炎症反应程度。PPARγ配体可促进visfatin基因表达〔14〕,visfatin下调PPARγ水平进而促使AS斑块的形成,可能激活炎症反应诱导泡沫细胞形成。THP-1源性巨噬细胞经PPARγ阻断后胆固醇流出水平进一步降低,胆固醇蓄积细胞内诱导泡沫细胞形成。PPARγ和LXRα都是转录因子,可被ox-LDL激活,活化的LXRα直接增加ABCA1和ABCG1的水平,可将胆固醇泵出巨噬细胞〔17,18〕。当存在凋亡细胞时,活化的PPARγ进一步增加LXRα的表达水平并协同ABCA1和ABCG的胆固醇流出功能。激活LXRα可降低人巨噬细胞中PPARγ诱导的visfatin基因和蛋白质分泌〔10〕。巨噬细胞中的PPARγ-LXRα-ABCA1和ABCG1途径在调节胆固醇流出中起重要作用〔10〕。研究证明体外和体内敲除visfatin后可激活PPARα-LXRα-ABCA1和ABCG1途径促进胆固醇流出和巨噬细胞胆固醇逆转运而发挥抗AS作用〔19〕。提示PPARγ信号通路参与了visfatin对巨噬细胞源性泡沫细胞形成。综上,PPARγ拮抗剂GW9662能促进大量的脂质蓄积在泡沫细胞中,使visfatin干预负荷LDL的THP-1源性巨噬细胞进一步通过下调PPARγ来减少胆固醇流出从而诱导泡沫细胞形成。

