鸡、鸭肉中金刚烷胺、金刚乙胺、索金刚胺间接竞争ELISA检测方法研究
崔乃元,刘怡菲,王 萍,武侠均,刘 薇,邢维维,马立才,*
(1.北京维德维康生物技术有限公司,北京100095;2.河北省兽药监察所,河北石家庄050051)
金刚烷胺(Amantadine,AMD)、金刚乙胺(Rimantadine)和索金刚胺(Soramantadine)均属于金刚烷胺类药物(结构式见图1),是一类抗病毒药物[1],也可以有效缓解帕金森病患者的症状[2]。早期应用于抑制人类流感病毒,具有价格低廉、药效明显等特点,对于流感的预防和治疗效果较好,该类药物在禽类流感的治疗上也得到了广泛的应用,但是禽类体内过量残留的金刚烷胺类药物会对其神经系统产生较大危害。2012年的“速成鸡”事件中检测出鸡肉中残留有金刚烷胺类等抗病毒药物,给我国家禽类养殖业带来严重的负面影响[3]。该药物的滥用不仅会造成鸡肉风味和品质下降,还会导致病毒抗药性与药物残留的产生,然后通过食物链影响消费者健康[4]。
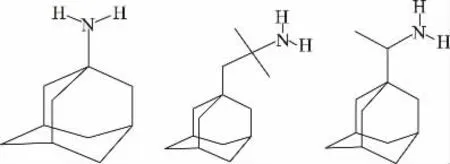
图1 金刚烷胺类药物化学结构式Fig.1 Chemical structural formula of amantadines
美国FDA于2006年禁止金刚烷胺类抗流感病毒药物用于禽类[5],我国农业部2005年在《关于清查金刚烷胺等抗病毒药物的紧急通知》要求禁止生产、经营和使用金刚烷胺等抗病毒药物[4,6-7]。因此,为确保动物源性食品的安全和对外出口贸易的发展,建立准确可靠,灵敏度高的禽肉中金刚烷胺类药物的定性定量检测方法是十分必要的。
已有文献报道的金刚烷胺、金刚乙胺和索金刚胺的检测方法可分为物理化学法和免疫化学法。前者包括高效液相色谱法[8]、液相色谱-质谱联用法(HPLC-MS)[9-11]、亲水相互作用色谱-串联质谱法[12]等。后者主要包括酶联免疫吸附法[13-18]、免疫层析法[15-16,19]、免疫比色分析[20-21]等。色谱方法虽然准确度高,但前处理复杂且检测成本高,不适合高通量快速筛选。酶联免疫分析法是一种易操作、速度快、成本低廉且检测通量高的检测方法,被广泛应用于食品安全检测中[22-26]。Wu等[16]建立了金刚烷胺间接竞争ELISA快速定量检测方法,其IC50为11.93 ng/mL,检测限为1.18 ng/mL,线性范围为2.5~100 ng/mL;使用ELISA方法检测金刚烷胺残留的报道很多[27-28],但检测鸡肉、鸭肉中金刚烷胺类药物(金刚烷胺、金刚乙胺、索金刚胺)的研究甚少。
本研究设计并合成了一种新型的金刚烷胺抗原,通过免疫动物获得了金刚烷胺特异性抗体,进而建立了一种检测鸡肉、鸭肉中金刚烷胺、金刚乙胺和索金刚胺的残留量的间接竞争ELISA分析方法,该方法具有灵敏度高、特异性强的特点,为禽肉中金刚烷胺类药物的检测和监管提供一种重要的技术手段。
1 材料与方法
1.1 材料与仪器
乙腈、辣根过氧化物酶(HRP)、高碘酸钠(NaIO4)、碳酸钠(Na2CO3)、硼氢化钠(NaBH4)、硫酸铵((NH4)2SO4)、牛血清蛋白(BSA)、卵清蛋白(OVA)购自美国Amresco公司;金刚烷胺、金刚乙胺、索金刚胺、弗氏完全佐剂、弗氏不完全佐剂等药物 购自Sigma公司;6~8周龄Balb/c(巴比赛)雌鼠、SP2/0小鼠骨髓瘤细胞 北京维德维康生物技术有限公司制备;鸡肉、鸭肉样品 购自于北京市海淀区的上庄水乡农贸市场和前沙涧农贸市场及物美温泉品超市,每个农贸市场/超市分别购买鸡肉、鸭肉各10份,共60份样品。
微量移液器 德国Eppendorf公司;ES120电子天平 天津德安特传感技术有限公司;Sorvall ST 8冷冻离心机 德国Thermo Fisher Scientific;KQ-100E超声波清洗仪 昆山市超声仪器有限公司;TSQ Fortis液相色谱-串联质谱仪 美国Thermo Fisher Scientific公司;MK3酶标仪 美国Thermo Fisher Scientific公司;N-EVAP氮吹仪 美国Organomation公司。
1.2 实验方法
1.2.1 溶液的配制 包被缓冲液:pH9.6,0.05 mo1/L的碳酸钠缓冲液;封闭液:每1 L封闭液按照如下方法配制:将5 mL马血清、1 g叠氮化钠、30 g酪蛋白混合,用磷酸盐缓冲液(PBS浓度为0.02 mol/L,pH为7.2)溶解并定容至1000 mL;底物显色液:由A液和B液组成,A液为2%过氧化脲的水溶液,B液为1%四甲基联苯胺(TMB)的水溶液;终止液:0.2 mol/L硫酸水溶液;浓缩洗涤液:将10 mL吐温-20、5 g叠氮化钠和990 mL磷酸盐缓冲液混合。
1.2.2 金刚烷胺半抗原的制备 称取0.94 g金刚烷胺盐酸盐溶于30 mL无水吡啶,加入马来酸酐(MAH)0.49 g,溶解后,加入4-二甲氨基吡啶10 mg,70℃回流反应3 h,旋蒸除去吡啶,加去离子水10 mL,冰醋酸调pH5.0,析出大量沉淀,过滤,水洗沉淀,干燥后得半抗原AMD-MAH。
1.2.3 免疫原和包被原的制备 称取5.57 mg半抗原溶于1 mL N,N-二甲基甲酰胺(DMF),加入碳化二亚胺(EDC)4.3 mg,N-羟基琥珀酰亚胺(NHS)5.2 mg,室温搅拌反应2 h;50 mg BSA溶于5 mL 0.1 mol/L碳酸氢钠缓冲液,将上述活化药物逐滴加入到5 mL含有1%BSA(包被原:1%OVA)的碳酸氢钠缓冲溶液中(0.1 mol/L),室温搅拌过夜,PBS 4℃透析72 h,期间换透析液6次,即得到免疫原AMD-MAH-BSA和包被原AMD-MAH-OVA。将透析液在无菌条件下过0.22μm孔径的滤膜,分装于安培瓶中,-20℃保存。采用MALDI-TOF/MS对所合成免疫原的偶联比进行测定[29]。
1.2.4 单克隆抗体的制备 用上述制备出的免疫原按100μg/只,以生理盐水溶解免疫原与弗氏完全佐剂等体积混匀,颈背部皮下注射免疫6~8周龄Balb/c雌鼠,初次免疫后第7、14、28 d以免疫原与弗氏不完全佐剂等体积混匀,各追加免疫1次,融合前3 d以免疫复合物100μg/只,不加弗氏佐剂再追加免疫1次。将免疫小鼠的脾细胞与小鼠骨髓瘤细胞(SP2/0)混合,然后于37℃、5%CO2培养箱中培养,5 d后用HT培养基半换液,9 d时进行全换液。全换液后采用间接ELISA方法,选择和标记效价高、抑制率高的阳性杂交瘤细胞。若经金刚烷胺阻断后的OD450nm值下降到对照孔的50%以下,则判为阳性,经2~3次检测都为阳性的孔,立即用有限稀释法进行亚克隆化。将2~3次亚克隆建株后的杂交瘤细胞扩大培养,收集上清液用间接ELISA测定效价,冻存;并将杂交瘤细胞接种于小鼠腹腔,制备腹水,测定效价,并-20℃冻存备用。
1.2.5 特异性 选择与金刚烷胺、金刚乙胺和索金刚胺具有类似结构或功能的几种药物美金刚胺、氧氟沙星、环丙沙星进行ELISA测定,通过各种药物的标准曲线分别得到其IC50,根据公式:

式中:IC50(金刚烷胺)为引起50%抑制的金刚烷胺浓度(μg/kg),IC50(类似物)为引起50%抑制的结构类似物浓度(μg/kg)
1.2.6 ic-ELISA 包被AMD-MAH-OVA的聚苯乙烯酶标板:用0.05 mol/L的碳酸盐溶液将抗原稀释至2.5μg/mL,包被96孔聚苯乙烯酶标板,每孔100μL,37℃温育2 h,倾去包被液,用洗涤液洗涤3次,每次10 s,拍干,然后在每孔中加入150μL封闭液,37℃温育2 h,倾去孔内液体,干燥后用铝膜真空密封保存。竞争反应:加入50μL金刚烷胺类标准品或样品溶液;然后在每孔中加入50μL酶标抗体工作液;盖好盖板膜,轻轻振荡酶标板10 s,充分混匀,室温下(25±2)℃,避光反应30 min;揭开盖板膜;倒掉板孔中液体,在每孔加260μL洗涤工作液,充分洗涤4次,每次浸泡15~30 s;倒掉板孔中液体,将酶标板倒置于吸水纸上,拍干;立即在每孔中加入100μL A、B混合液;盖好盖板膜,轻轻振荡酶标板10 s,充分混匀,室温下(25±2)℃,避光反应15~20 min;揭开盖板膜,在每孔中加入50μL终止液,轻轻振荡酶标板10 s,充分混匀;终止后5 min内用酶标仪在双波长450、630 nm下读取酶标板吸光度[30]。
1.2.7 样品前处理方法 准确称取(3±0.05)g均质后的鸡肉、鸭肉样品于50 mL离心管中;加入6 mL酸化乙腈(含1%乙酸),充分涡动5 min;室温(25±2℃)下4000×g离心5 min;取3 mL上清液40~50℃水浴氮气吹干;加入2 mL正己烷充分涡动30 s,再加入1.0 mL 10 mmol/L PB(含1%BSA,0.5%Tween-20,1%蔗糖),充分涡动30 s;4000×g以上离心5 min;弃去上层正己烷及中间层杂质;取50μL进行检测。
1.2.8 准确度和精密度分析 向均质后的鸡肉、鸭肉空白样品中添加梯度浓度的金刚烷胺、金刚乙胺、索金刚胺溶液,使其终浓度分别为1和2μg/kg,将每个浓度梯度添加3个平行;然后按照1.2.6进行前处理和检测,利用平均值计算添加回收率,公式如下:
添加回收率(%)=检测值/添加值×100
上述实验在不同工作日内重复3次,分别统计日内变异系数和日间变异系数。
1.2.9 与仪器方法比较 取鸡肉和鸭肉样品各25份,同时使用本研究所建立的icELISA方法和GB 31660.5-2019《动物性食品中金刚烷胺残留量的测定》液相色谱-串联质谱法[31]进行检测,以评价方法的可靠性。
1.3 数据处理
在标准曲线制作过程中,以样本中添加的金刚烷胺质量浓度(μg/kg)的自然对数值为X轴,吸光度OD值为Y轴,采用Origin 8.0软件拟合四参数竞争标准曲线。
2 结果与分析
2.1 半抗原合成的鉴定
采用基质辅助激光解析串联飞行时间质谱法(MALDI-TOF-MS)鉴定免疫原(AMD-MAH-BSA)的结果如图2和图3所示。载体蛋白BSA的分子质量为67485.901,AMD-MAH-BSA经MALDI-TOFMS测定的分子质量为73828.009。经计算可知,半抗原AMD-MAH与BSA的偶联比为25.40。

图2 BSA的MALDI-TOF-MS图谱Fig.2 MALDI-TOF-MSspectrum of BSA
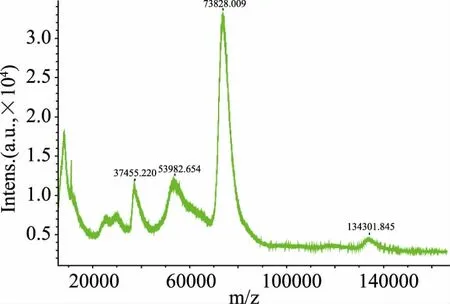
图3 AMD-CMO-BSA的MALDI-TOF-MS图谱Fig.3 MALDI-TOF-MSspectrum of AMD-CMO-BSA
金刚烷胺半抗原结构如表1所示。Wu等[16]直接采用戊二醛的醛基与金刚烷胺和载体蛋白氨基缩合成Schiff碱而进行共价交联合成金刚烷胺全抗原,检测方法的IC50为11.93μg/L。Peng等[13]加入丁二酸酐与金刚烷胺氨基结合生成酰胺作为金刚烷胺半抗原,测得其检测方法的IC50为15.8μg/L。与本文所建立的ic-ELISA方法相比,上述两种方法所制备的抗体灵敏度均较低,这可能因为其半抗原分子极性低不利于产生高亲和力的抗体导致的。
由于金刚烷胺烷烃分子间作用力少,不利于产生抗体,因此本研究通过引入马来酸酐作为碳链,使电子云密度加大有利于金刚烷胺产生抗体。同时最大限度的保留了金刚烷胺的结构,以利于产生具有高特异性的抗体。
2.2 特异性
用建立的方法对缓冲体系中金刚烷胺、金刚乙胺、索金刚胺及其他临床常用药物进行测试,本研究所制备单克隆抗体的灵敏度和交叉反应率如表2所示。金刚烷胺、金刚乙胺和索金刚胺的IC50依次为0.316、0.136和0.131 μg/kg,但 是 与 美 金 刚 胺(<1%)、氧氟沙星(<0.1%)和环丙沙星(<0.1%)的交叉反应率均较低。由此可见,本研究所制备的单克隆抗体具有良好的灵敏度和特异性。
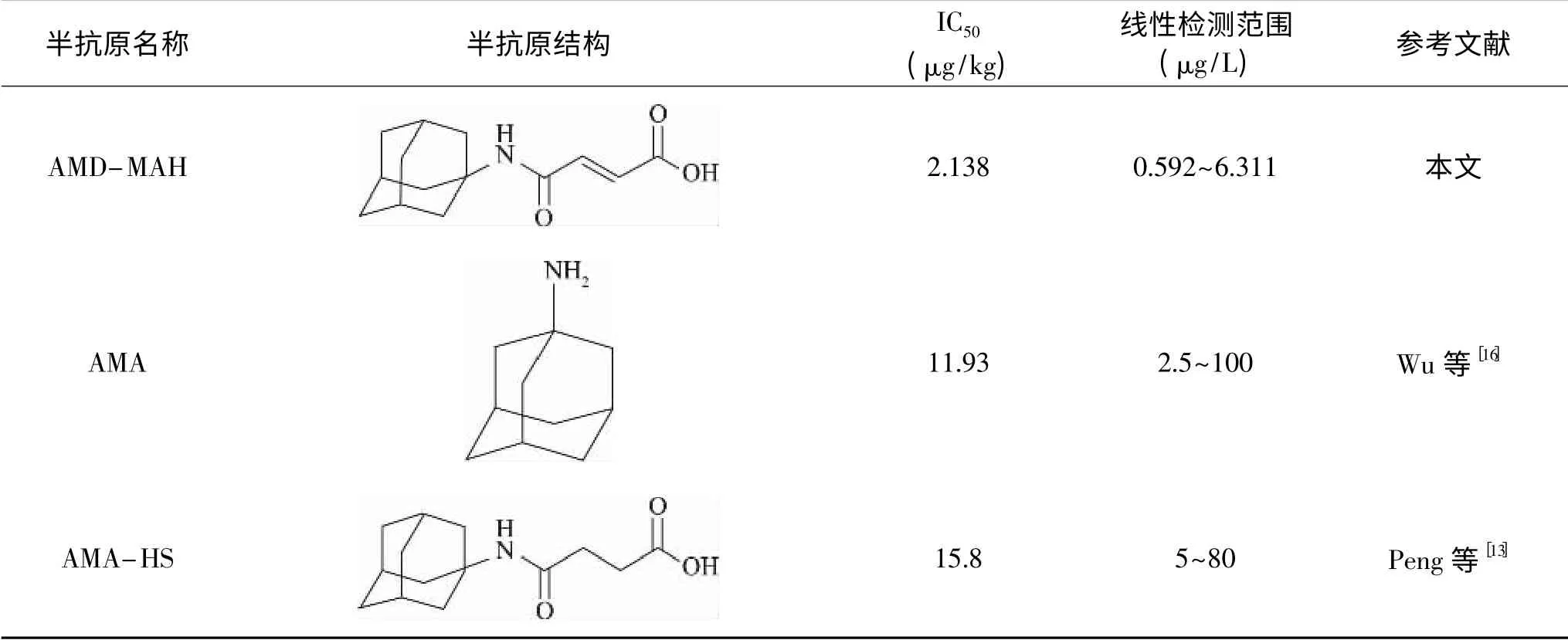
表1 金刚烷胺半抗原结构对比Table 1 Comparison of the haptens structure for determination of AMA
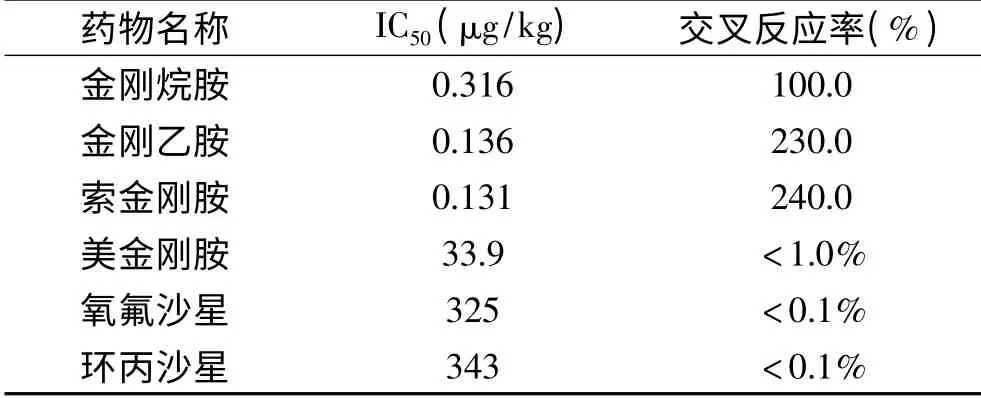
表2 用间接竞争ELISA测得金刚烷胺、金刚乙胺、索金刚胺交叉反应率Table 2 Cross reaction rate of amantadine,amantadine and soamantadine measured by indirect competitive ELISA
2.3 标准曲线的建立
分别取鸡肉和鸭肉样本,向其中添加金刚烷胺标准溶液使其质量浓度分别为(0、0.1、0.3、0.9、2.7和8.1μg/kg),按照1.2.6和1.2.7节所述进行样本前处理及分析检测,并依据1.3节拟合标准曲线(图4)。结果显示,其曲线回归方程为:鸡肉:Y=0.071+(2.336-0.071)/(1+(x/0.333)1.257),线性决定系数R2为0.9958,线性范围为0.603μg/kg~3.104μg/kg;鸭肉:Y=-0.487+(2.039+0.487)/(1+(x/0.878)0.499),线性决定系数R2为0.9990,线性范围为0.592~6.311μg/kg。
2.4 检测限和定量限
按照农业部规定的方法[32]:分别测定20份空白鸡肉、鸭肉样品,取其平均值,加上3倍标准差来确定试剂盒的最低检测限,加上10倍标准差来确定试剂盒的定量限。具体数据如表3所示,金刚烷胺、金刚乙 胺、索 金 刚 胺 的 检 测 限 分 别 为:0.57、0.42、0.41μg/kg(鸡肉)和0.59、0.40、0.38μg/kg(鸭肉);定量限分别为0.85、0.63、0.69μg/kg(鸡肉)和0.94、0.68、0.52μg/kg(鸭肉)。
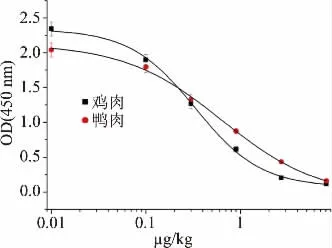
图4 ic-ELISA检测金刚烷胺类的标准曲线Fig.4 Standard curve for detection of amantadine by ic-ELISA
2.5 准确度和精密度
在3个批次的鸡肉、鸭肉样品中依次添加终浓度为1、2μg/kg金刚烷胺标准物质进行添加回收测定。结果如表4所示,本方法鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺的回收率为67.0%~117.9%;日内变异系数在6.3%~12.7%,日间变异系数在8.1%~14.5%之间,均小于15%,表明该方法具有较好的准确度和精密度。
2.6 与国标方法比较
为了验证酶联免疫法在实际工作中对真实样品中金刚烷胺、金刚乙胺、索金刚胺测定的准确性,采用本方法与HPLC-MS[30]方法分别对25份鸡肉和25份鸭肉盲样进行测定,比较测定结果。由表5可知,两种方法检测鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺残留的结果一致性较高,与仪器方法相比,本文建立的ic-ELISA方法具有灵敏度高,检测时间短,稳定性好等优点,可应用于批量样本的快速筛查,具有良好的实际应用价值。
3 结论
综上所述,本文采用ic-ELISA技术建立了一种检测鸡肉、鸭肉中金刚烷胺、金刚乙胺和索金刚胺残留的方法,其金刚烷胺、金刚乙胺、索金刚胺的检测限分别为:0.57、0.42、0.41μg/kg(鸡肉)和0.59、0.40、0.38μg/kg(鸭 肉);定 量 限 分 别 为0.85、0.63、0.69μg/kg(鸡肉)和0.94、0.68、0.52μg/kg(鸭肉),而且与其他几种临床常用药物交叉反应率低,说明方法具有良好的特异性。鸡肉、鸭肉中金刚烷胺、金刚乙胺和索金刚胺的添加回收率在67.0%~117.9%之间;日内变异系数为6.3%~12.7%,日间变异系数为8.1%~14.5%,均小于15%,且实际样品检测结果与HPLC-MS一致性较高(R2=0.9990)。由此表明,本研究所建立的检测鸡肉、鸭肉中金刚烷胺、金刚乙胺和索金刚胺残留的icELISA测定方法具有灵敏,准确精密的特点,具有较高的实际应用价值。

表3 金刚烷胺类药物检出限和定量限验证(n=20)Table 3 Verification of detection and quantitation limits for amantadines(n=20)
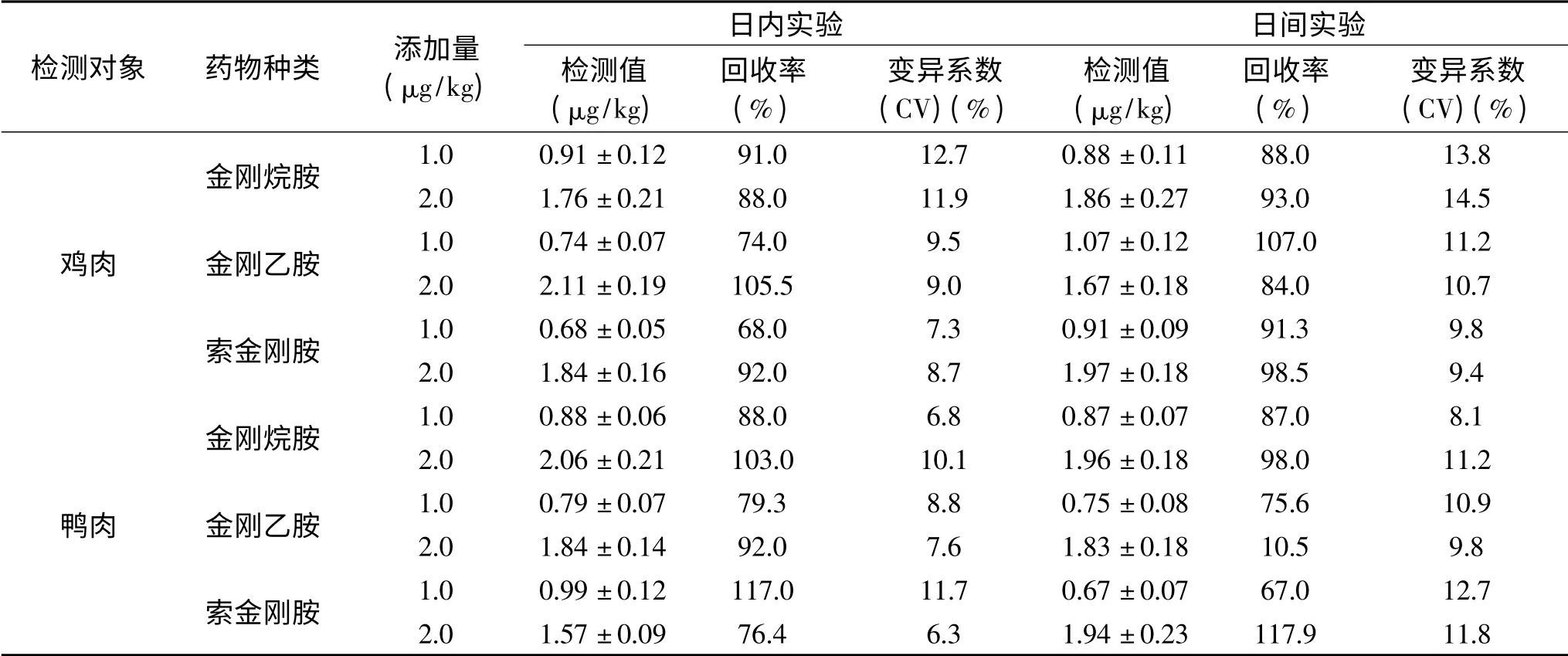
表4 日内、日间变异系数Table 4 Intra-and inter-day coefficient of variation
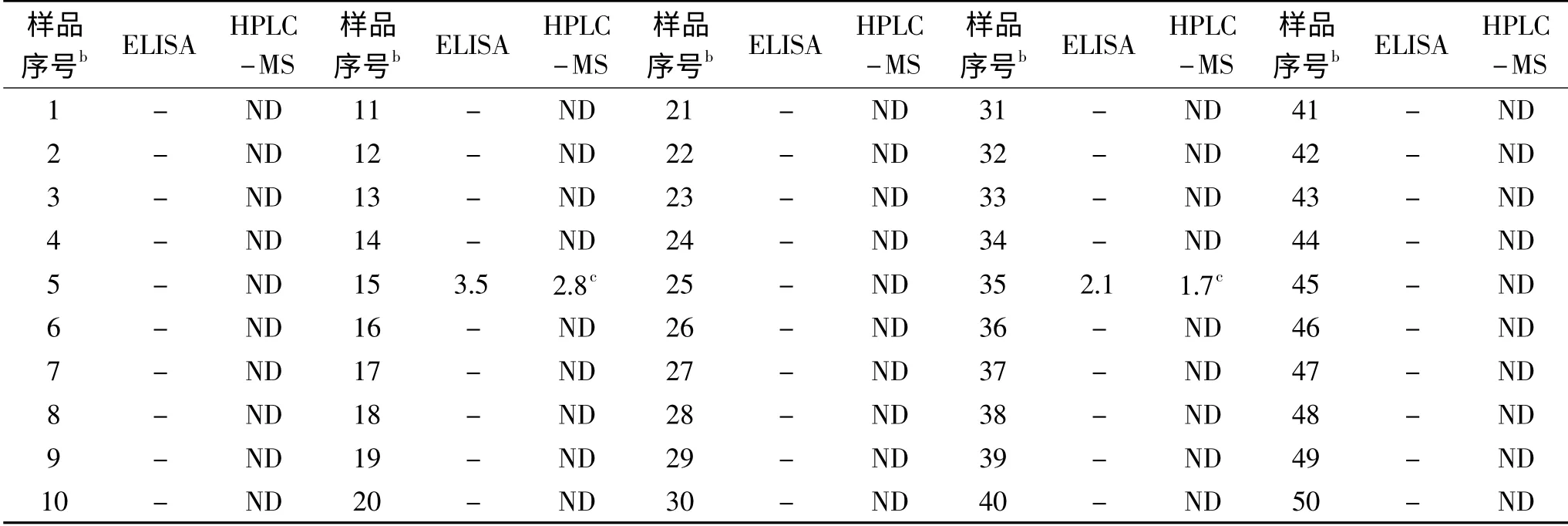
表5 检测金刚烷胺与仪器方法比较结果(μg/kg)aTable 5 Comparison results with instrument methods(μg/kg)

