表没食子儿茶素没食子酸酯稳定性研究
郝 静,杨太琴,2,+,王 晗,2,汪 旭,2,倪 娟,2,*
(1.云南师范大学生命科学学院,云南昆明650500;2.云南师范大学生物能源持续开发与利用教育部工程研究中心,云南昆明650500)
表没食子儿茶素没食子酸酯[(-)- epigallocatechin-3-gallate,EGCG],是儿茶素中含量最高活性最强的成分,也是绿茶利好人体健康的主要承担者[1-2]。儿茶素的结构特征是B-环上有二个或三个羟基基团和A-环上的5,7-二羟基基团,因此具有抗氧化活性。EGCG除上述两个环上的羟基外,还在D-环上带有三个羟基,在四种主要的儿茶素中,其抗氧化活性最强[3-4]。EGCG不仅可以直接清除胞内活性氧/氮离子,还能螯合几种具有强正电荷的金属离子(Fe3+、Al3+和Gu2+);其可使铁离子失活,抑制超氧化物驱动的芬顿反应(Fenton reaction);抑制H2O2形成和脂质过氧化。因此,大多研究认为EGCG对人体健康的利好效应源于其卓越的抗氧化能力[5]。
然而,由于EGCG特殊的化学结构特征,稳定性较差,可发生自动氧化和异构反应,根据所处条件(EGCG浓度、pH、温度和含氧量等)其反应取向不同。当EGCG自动氧化形成多聚物时,可能产生如H2O2一类的活性氧(reactive oxygen species,ROS)[6],表现出促氧化活性。有研究发现,50μmol/L EGCG在无细胞的McCoy’s 5A培养基中120 min,培养基中的H2O2达到峰值25μmol/L。用相同的条件处理HT-29细胞30 min后培养体系中的H2O2水平达到最高水平10μmol/L[7]。在活体中,也观察到了EGCG的促氧化效应,用高剂量的EGCG喂食小鼠,出现剂量依赖的肝脏毒性[8]。但EGCG的促氧化效应在不同的细胞和动物模型中并没有得到一致的结论。Sheng等[9]发现200μmol/L的H2O2能显著诱导正常人心脏成肌细胞H9c2凋亡,而EGCG可抑制H2O2介导的H9c2凋亡,用EGCG单独处理H9c2时并未观察到胞内外的H2O2水平的变化。
因此,本文解析EGCG氧化聚合的环境条件,及其稳定性变化对受试细胞氧化还原平衡的影响,为进一步探讨EGCG在细胞培养体系及活体中的作用机制奠定基础。
1 材料与方法
1.1 材料与仪器
人正常结肠上皮NCM460细胞 购自中科院昆明动物所细胞库;EGCG粉末 购自sigma公司;过氧化氢检测试剂盒(S0038)购自上海碧云天公司。
MCO-5AC培养箱 SANYO;318C酶标仪 上海三科仪器;NanoPhotometer N60分光光度计 IMPLEN;VANOX-S显微镜 OLYPUS。
1.2 实验方法
1.2.1 主要试剂配制
1.2.1.1 EGCG溶液 0.15 g EGCG粉末融入10 mL的三蒸水中搅拌均匀配制成32 mmol/L的EGCG溶液,在超净工作台利用0.2μm针头滤器进行无菌过滤。待实验开始前将EGCG溶液储存液稀释至如表1所需浓度。
1.2.1.2 细胞培养基 RPMI1640或DMEM培养液Gibco,含10%胎牛血清Gibco;0.1%双抗(10万单位/mL)Gibco;1%L-谷氨酰胺(200 mmol/L)Gibco。
1.2.1.3 其他 细胞磷酸缓冲液(PBS)Gibco;0.4%台盼蓝Solarbio,0.25%胰蛋白酶Gibco。
1.2.2 影响EGCG氧化聚合的环境因素分析
1.2.2.1 溶液环境对EGCG聚合的影响 实验选择了H2O、RPMI1640、DMEM(pH=7)三种溶液体系,分别加入不同浓度的EGCG(0、20、40、80、320μmol/L),置于37℃培养箱恒温反应24 h后,吸取三个重复的150μL溶液置于96孔板中,检测578 nm的OD值,以确定溶液体系对EGCG氧化聚合的影响。
1.2.2.2 温度环境对EGCG聚合的影响 实验以RPMI1640(pH=7)为溶液体系,分别加入不同浓度的EGCG(0、20、40、80、320μmol/L),置于37℃培养箱和74℃的水浴锅中恒温反应24 h后,吸取三个重复的150μL溶液置于96孔板中,检测578 nm的OD值,以确定温度对EGCG氧化聚合的影响。
1.2.2.3 时间对EGCG聚合的影响 实验以RPMI1640(pH=7)为溶液体系,加入320μmol/L的EGCG,置于37℃培养箱恒温反应3、6、12、24 h后,各组吸取三个重复的150μL溶液置于96孔板中,检测578 nm的OD值,以确定时间对EGCG氧化聚合的影响。
1.2.2.4 pH对EGCG聚合的影响 实验选用RPMI1640和H2O为两种溶液体系,分别设置不同的pH(p H=5和9),加入不同浓度的EGCG(0、20、80、320μmol/L),分别置于37℃培养箱中恒温处理24 h后,各组吸取三个重复的150μL溶液置于96孔板中,检测578 nm的OD值,以确定pH对EGCG氧化聚合的影响。
1.2.3 EGCG在培养系统中对NCM460细胞的胞内、外H2O2浓度影响 接种6个含NCM460的6孔培养板,待细胞贴壁生长后,更换含有不同浓度EGCG(0、20、40、80μmol/L)的RPMI1640培养液,每个6孔板培养时间分别为1、2、3、6、12、24 h,在对应的时间节点先取各孔上层培养液50μL,用于胞外H2O2浓度检测。之后,弃去含EGCG培养基,胰酶消化后用1 mL RPMI1640培养基吹打混匀形成细胞悬液,计数,吸取5×105个细胞,用于胞内H2O2浓度检测。
1.2.4 H2O2浓度检测 按照过氧化氢检测试剂盒操作步骤,检测不同浓度EGCG处理各时间点的培养上清及细胞内H2O2浓度。
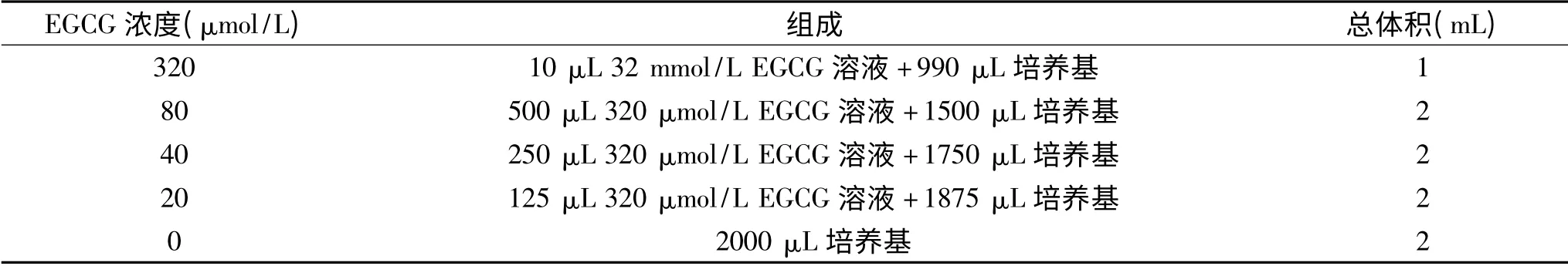
表1 不同浓度EGCG溶液的配制Table 1 Preparation different concentrations of EGCG solution
1.3 统计学分析
实验均重复三次,对数据进行整理归纳,利用SPSS 17.0统计软件进行单因素方差分析,采用GrahPad Prism 5制图软件作图分析。
2 结果与分析
2.1 环境因素对EGCG氧化聚合的影响
2.1.1 溶液体系对EGCG氧化聚合的影响 实验设置了H2O、RPMI1640、DMEM(pH=7)3种溶液体系,比对不同的溶液对EGCG氧化聚合的影响。如图1所示,在相同EGCG浓度下,RPMI1640、DMEM两种培养基的OD578值极显著高于H2O(P<0.001);对比两种培养基,DMEM的OD578值高于RPMI1640,即三种溶液体系促进EGCG氧化聚合率的排序为:DMEM>RPMI1640>H2O。

图1 EGCG在不同溶液环境中OD值比较Fig.1 Comparison of OD value of EGCG in different solution environments
2.1.2 温度对EGCG氧化聚合的影响 实验设置了37和74℃研究温度对EGCG氧化聚合率的影响。如图2所示,在以RPMI1640为溶液体系下,除最高EGCG浓度320μmol/L外,各浓度组74℃的氧化聚合率均显著高于37℃(P<0.05),即高温促进EGCG的氧化聚合。
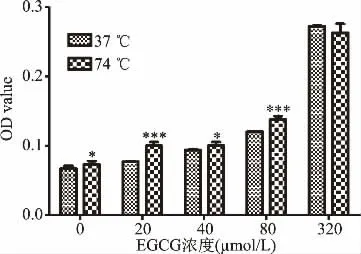
图2 EGCG在不同温度条件下OD值比较Fig.2 Comparison of OD value of EGCG in different temperatures
2.1.3 EGCG浓度对自身氧化聚合的影响 不同浓度的EGCG(0、20、40、80、320μmol/L)分别以H2O、RPMI1640、DMEM(pH=7)三种溶液体系,反应3、6、12、24 h。结果显示,以H2O为溶液的各EGCG浓度组间无显著差异(图3i,j,k,l);以RPMI1640和DMEM为溶液体系的3 h组,各浓度间也无显著差异(图3a,e),其余各组均随着EGCG浓度的升高,OD578显著上升(P<0.05)(图3b,c,d,f,g,h),即高浓度促进EGCG的氧化聚合。
2.1.4 反应时间对EGCG氧化聚合的影响 实验设置了4个反应时间,探讨时间对EGCG氧化聚合的影响。通过EGCG浓度及溶液环境对其自动氧化影响的结果显示,培养液及高浓度的EGCG促进其氧化聚合,因此,对比了320μmol/L的EGCG在RPMI1640培养基中各时间点OD578的变化。如图4显示,12和24 h的OD578极显著高于3 h(P<0.001),即在高浓度下,随着作用时间延长,EGCG氧化聚合率显著增加。
2.1.5 pH对EGCG氧化聚合的影响 实验设置了pH=5和9探讨pH对EGCG氧化聚合的影响,选用RPMI1640和H2O两种溶液条件,37℃时分别比较了不同pH条件下的OD值变化。如图5a所示,以RPMI1640作为溶液环境,各浓度下两种p H的OD578均有极显著差异(P<0.001),pH=5时各浓度组OD578变化不显著(P>0.05);p H=9时OD578随着EGCG浓度的升高显著增大(P<0.05)。当以H2O作为溶液环境,p H=5各浓度OD57值均极显著低于pH=9的OD578值(P<0.001),如图5b,综合各组结果,碱性环境较酸性环境促进EGCG的氧化聚合。
2.2 EGCG稳定性的改变对NCM460细胞的胞内、外H2 O2浓度影响
2.2.1 细胞内H2O2水平的检测 对比不同处理时间点发现,胞内H2O2浓度呈现先上升后下降的趋势;与对照组0μmol/L相比,H2O2浓度1 h内出现了短暂增高,其中80μmol/L组极显著增高(P<0.001)(图6a),处理3 h后,与对照组相比高浓度EGCG中的H2O2浓度出现显著下降(P<0.05)(图6c),这种现象在处理12 h后更显著(P<0.001)(图6d)。
2.2.2 胞外H2O2水平的检测 结果显示,随着处理时间的延长,培养体系中H2O2浓度呈现上升趋势;对比相同时间不同浓度组发现,处理2、3、6、12 h后,20、40、80μmol/L的处理体系H2O2浓度显著高于对照组(P<0.05),即培养体系中的H2O2浓度随时间延长和EGCG浓度的增加而显著上升,处理24 h后胞外的H2O2水平出现明显降低,见图7。
3 讨论
EGCG的多种生物活性已在细胞培养模型中得到证实,其中最显著的为抗氧化、抗炎和抗癌作用[2,10-12],这表明EGCG很可能成为因ROS增加和/或细胞抗氧化能力不足引发的退行性疾病的临床药物。然而,EGCG在相应动物实验中的结果是存在争议的[13-14]。依据EGCG结构特征,其在细胞培养物中和整个生物体中的活性不一致可能归因于EGCG分子的稳定性不足,EGCG不受控的降解或聚合[15-16],不仅会导致体外研究结论不准确,还会限制EGCG在体内的生物利用度。
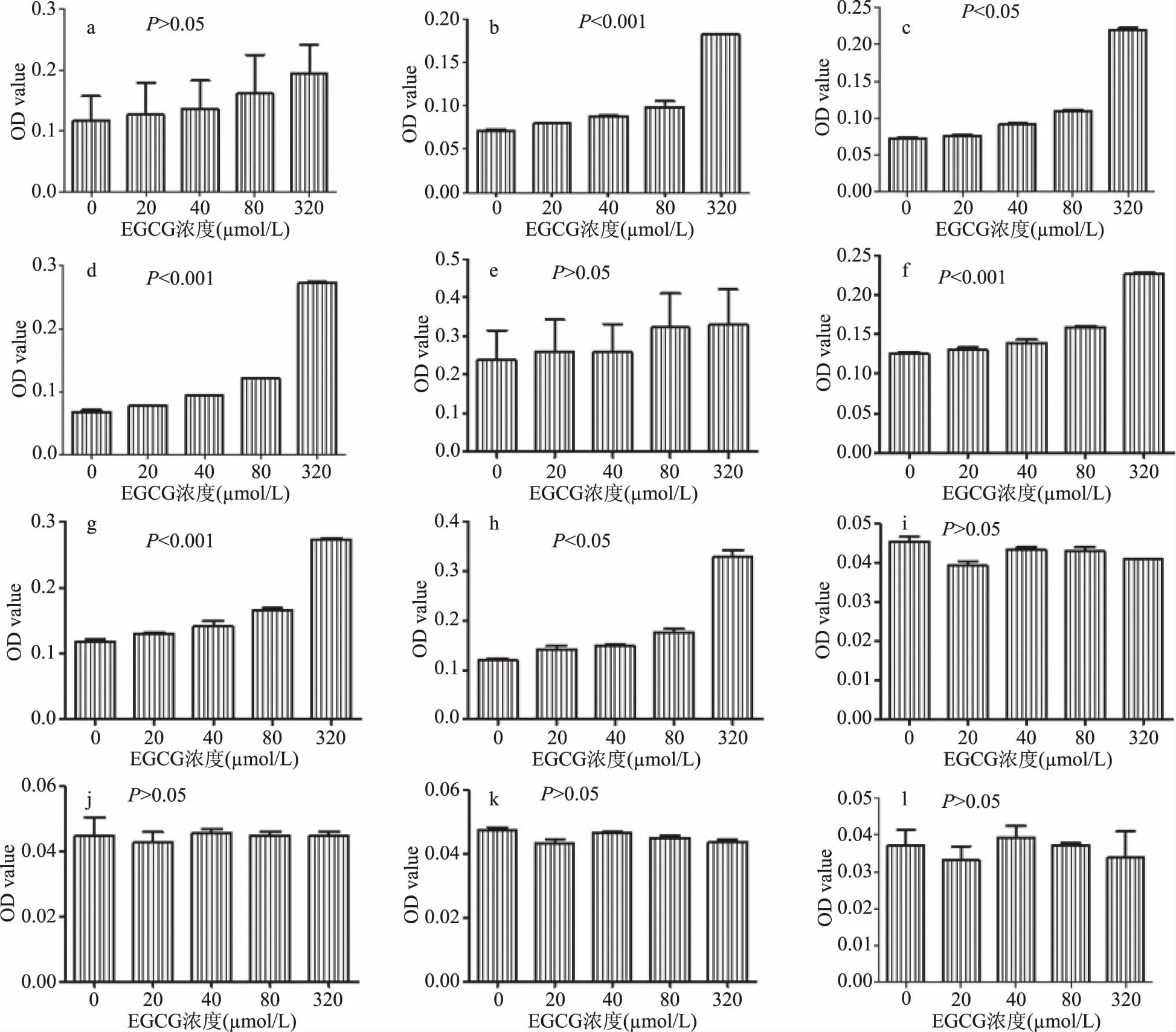
图3 不同浓度EGCG在各溶液环境及反应时间下OD值比较Fig.3 Comparison of OD values of different concentrations of EGCG in each solution and reaction time
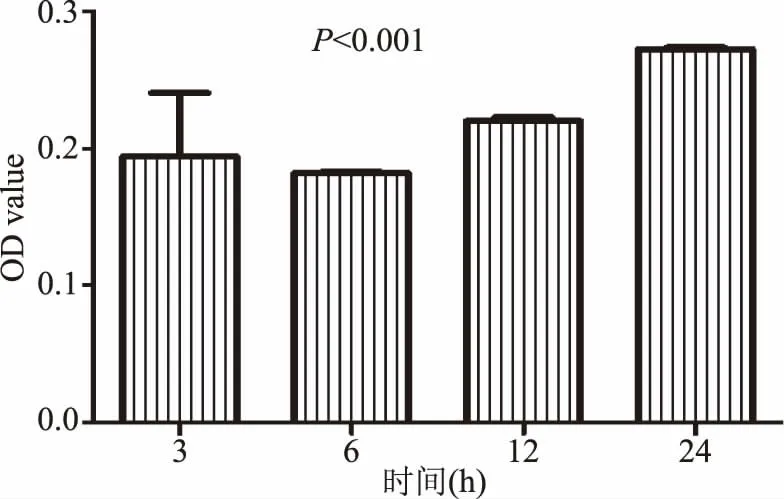
图4 320μmol/L的EGCG在不同反应时间下OD值比较Fig.4 Comparison of OD value of 320μmol/L EGCG in different time
本实验发现不同的溶液环境对EGCG的氧化聚合有较明显影响,在DMEM培养液中EGCG的聚合效率更高,而H2O的影响较小,这与Krupkova等[17]的研究结果吻合;高温促进了EGCG的自动氧化,Krupkova等[17]也证实低温可以保持EGCG的稳定性;不同EGCG浓度下EGCG的氧化聚合程度不同,高浓度促进EGCG的聚合,同时,随着反应时间的增长,EGCG的聚合物增多;溶液pH对EGCG的稳定性也有较明显影响,EGCG在酸性环境中更加稳定(pH<6),这与相关研究相符[17-18]。由此可见,溶液环境、温度、反应时间、EGCG浓度和溶液pH等因素均会影响EGCG的稳定性,在相关实验条件下应给予考虑。已有研究证实,环境是确定EGCG抗淀粉样蛋白功效的关键因素[19],因此,解析EGCG稳定性的环境条件对于进一步研究其在机体中发挥功效的机制有重要意义。
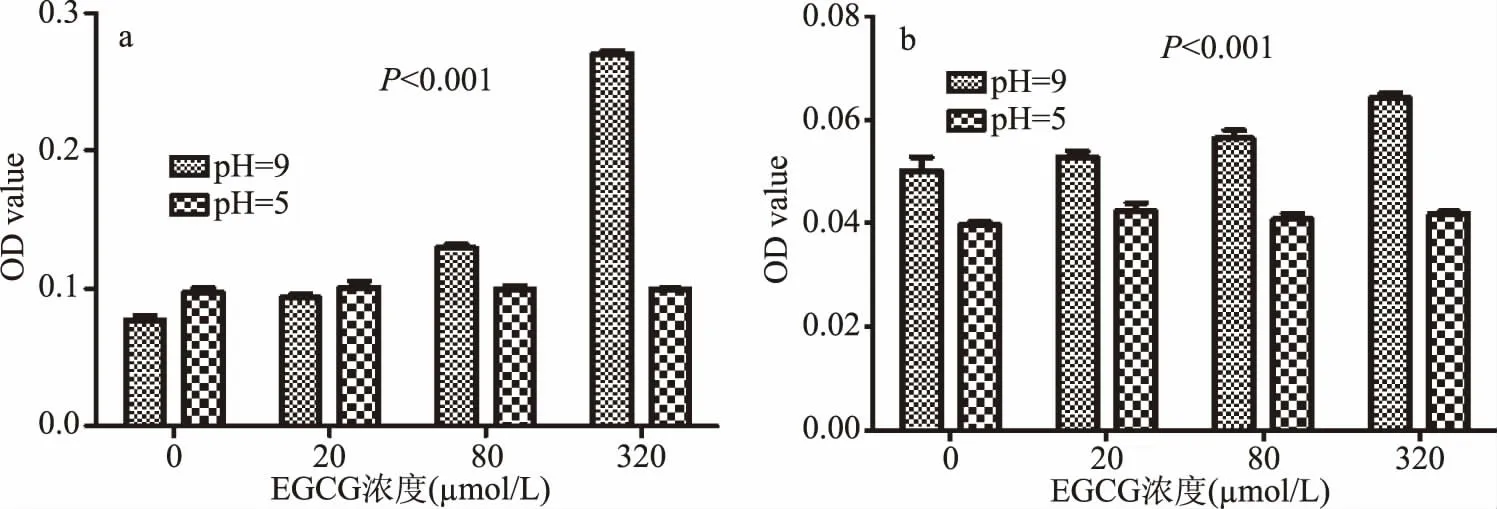
图5 EGCG在不同pH条件下以RPMI1640为溶液环境(a)和H2 O为溶液环境(b)的OD值比较Fig.5 Comparison of OD values with RPMI1640 as solution environment(a)and H2 O as solution environment(b)under different pH conditions
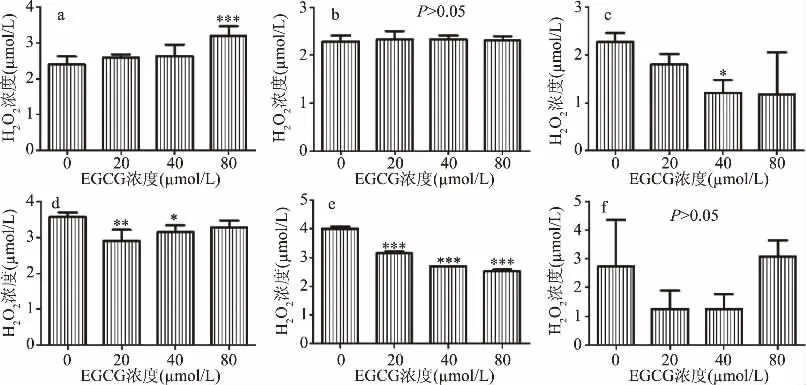
图6 不同浓度EGCG处理后NCM460胞内过氧化氢浓度变化图Fig.6 Changes of intracellular hydrogen peroxide concentration in NCM460 treated with different concentrations of EGCG

图7 不同浓度EGCG处理下NCM460胞外过氧化氢浓度变化图Fig.7 Changes of extracellular hydrogen peroxide concentration in NCM460 treated with different concentrations of EGCG
在正常培养细胞体系中探讨了EGCG的稳定性对其抗氧化能力的影响,发现胞外H2O2水平在时间和浓度效应上与对照组相比呈上升趋势,而胞内出现先上升后下降的趋势。研究分析,EGCG在培养体系中会发现氧化聚合反应,生成H2O2;随后,H2O2进入细胞,使胞内H2O2水平迅速上升,给细胞造成氧化胁迫[20],激活胞内的抗氧化系统应对胁迫[21-22],随着抗氧化酶系的积极响应,胞内H2O2水平出现短暂上升然后开始下降,最终表现为EGCG处理后,细胞内H2O2浓度低于未处理细胞,表现为抗氧化效应,特别是20μmol/L组,这一过程可能是EGCG发挥生物活性,特别是在抗增殖和癌症治疗中的潜在作用[23]。如20μmol/L的EGCG是其通过预警响应发挥抗氧化活性的最适浓度,随着EGCG浓度的升高,氧化聚合反应产生的H2O2水平超过细胞氧化应激范围,可能对细胞造成氧化损伤,详细分子机制有待进一步验证。
4 结论
RPMI1640和DMEM培养基较H2O更促进EGCG的氧化聚合,低温低EGCG浓度及酸性条件利于EGCG的稳定,同时EGCG的氧化聚合随反应时间延长而加剧。在含有细胞的培养体系中,EGCG也会发生自动氧化聚合并产生H2O2,导致细胞内外的H2O2浓度升高,但胞内H2O2浓度呈现先上升后下降的趋势。研究结果提示,一定浓度的EGCG在培养细胞中可能通过氧化聚合产生H2O2,形成氧化胁迫,进而激活细胞内抗氧化防御系统,使细胞内H2O2浓度随后降低,表现出抗氧化效应。

