一株内生菌对香菇和灵芝菌棒病原菌的生防潜力研究
曾 茜, 陈 旭, 杨 雨, 王晓敏, 李玉平
(1.贵州中医药大学基础医学院, 贵阳 550025; 2.贵州省农业科学院农业资源与环境研究所, 贵阳 550006;3.贵州大学农学院食用菌研究院, 贵阳 550006)
食用菌营养丰富,健康美味,市场前景广阔,成为最具发展优势的产业之一,具有“短平快”和“长远稳”等特点,特别是利益联结机制紧密,能有效实现农民增收,提升农村产业可持续发展能力,扶贫效益显著。食用菌产业在我国极具特色经济发展潜力,受到各界高度关注,在全国592个国家级贫困县中约占72%,即426个县选择发展食用菌产业,其中有三成的贫困县年产值超过1亿元,解决了2 000余万的农村人口就业问题[1-2]。香菇(Lentinulaedodes)的人工栽培起源于我国,是世界第二大生产菇类,2018年全国出产香菇突破1 000万t,占食用菌总产量1/4以上,远超于其他种类食用菌[3]。灵芝(Ganodermalingzhi)作为我国的名贵中药材,广谱的药用价值及显著生物活性已获得消费者普遍认可,灵芝入药首载于公元前二世纪的《神农本草经》,书中将收载的365种药品分为上、中、下三品,上品药皆为有效无毒者,灵芝位列上品[4]。贵州立体多样的气候优势为发展食用菌产业提供了有利条件,特别是实现香菇不同区域周年化供应,并且2019年国家卫健委和国家市场监管局将灵芝列为既是食品又是中药材物质进行管理,贵州作为生产试点之一,对本地灵芝产业化发展具有重要意义。然而,在上述两种食用菌生产规模不断壮大的同时,病虫害的频繁发生与传播,特别是发展林下经济仿生态种植模式中菌棒及子实体污染问题,严重制约了产业的持续健康发展[5-6]。
植物内生真菌(Plant endophytic fungi)是指在植物宿主中度过全部或近乎全部生活周期而不使寄主表现任何症状的一类真菌,它是生活在植物组织内的一类微生物,具有极其丰富的多样性,并能与宿主协同进化,是植物微生态系统的重要组成部分[7]。Strobel[8]总结多年对内生菌的研究发现,在特殊微环境中生长的内生菌往往能够产生结构更为新颖且具有特殊生物活性的化合物,是一个丰富的,非常有价值的资源宝库。近年来,随着对不同植物内生真菌资源的不断开发和探索,越来越多结构新颖、活性多样的次级代谢产物被实际应用到医药和农业等方面,并且利用植物内生真菌本身及其次生代谢产物作为农业病虫害生物防治的新方法正在逐渐成为研究热点[9-10]。因此,以前期对贵州地区小白及内生真菌资源的分离鉴定和活性初筛为基础,选择表现出广谱抗病活性的菌株GZFJ 015,进一步对香菇和灵芝菌棒病原菌的抑制活性进行研究,以期为食用菌病害生物防治新途径的开发利用提供参考。
1 材料与方法
1.1 材 料
1.1.1试验菌株
内生菌GZFJ 015,结合形态学和分子生物学鉴定为毛壳属(Chaetomiumsp.)真菌。采集分离自贵州铜仁梵净山国家自然保护区野生小白及植株的根部,现保存于贵州中医药大学基础部微生物实验室。
1.1.2供试病原菌
3株香菇病原菌采集分离自铜仁市印江县仿生态种植香菇发病菌棒,分别为XG 1(Pyriculariasp.)、XG 2(Alternariasp.)、XG 3(Phytophthorasp.);3株灵芝病原菌采集分离自黔东南州丹寨县仿生态种植灵芝发病菌棒,分别为LZ 1(FusaHumsp.)、LZ 2(Alternariasp.)和LZ 3(Thanatephorussp.),以上病原菌均保存于本实验室。
1.1.3主要培养基
马铃薯葡萄糖琼脂培养基(PDA培养基),内生真菌发酵培养基(改良沙氏培养基)均参照Zheng等[11]的方法配制。
1.1.4主要试剂
50%多菌灵可湿性粉剂。
1.2 方 法
1.2.1内生菌GZFJ 015液体发酵
配制内生真菌发酵培养基,取规格为500 mL三角瓶装液200 mL。在超净台中接入大小为5 mm的试验菌株菌饼,置于28 ℃条件下摇床震荡培养10 d,转速150 r·min-1。将获得的发酵物5 000 r·min-1离心5 min,弃去菌丝体,取上清液,备用。
1.2.2内生菌GZFJ 015抗食用菌病原菌活性测定
检测方法参照何劲等[12]的抑制菌丝生长速率法。将离心后的发酵上清液用0.22μm无菌滤膜过滤除菌,再以无菌发酵液∶PDA培养基=0.5∶9.5(体积比)的比例充分混匀,倒入平板培养皿中制成5%的带药培养基;采用未接入试验菌株的发酵培养基与PDA混合制得空白对照平板,设为ck组。在超净工作台上进行无菌操作,利用打孔器取直径5 mm的供试食用菌病原菌的菌块接种于培养皿中央,置于28 ℃下培养10 d,每个处理设置5个平行对照,观察各组病原菌菌丝生长情况,利用十字交叉法测量菌落直径(D),计算菌丝生长抑制率。
抑制率(%)=[(Dck-D实验)/(Dck-5)]×100%。
1.2.3内生菌GZFJ 015发酵液毒力(EC50)测定
利用抗菌活性测定方法,取GZFJ 015菌株发酵液,制成含发酵液浓度分别为0、1.00、5.00、25.0、125.0、300.0、602.5μL·mL-1的PDA平板,计算抑制率。利用DPS和SPSS统计软件,采用剂量对数-抑制率机值法计算EC50,即根据设定的发酵液浓度对数(x)和对应的菌丝生长抑制率的概率值(y),获得发酵液对食用菌病原菌菌丝生长的毒力回归方程y=a+bx以及相关系数(r),从而计算抑制菌落扩展的有效中浓度EC50,同时以50%多菌灵可湿性粉剂作为阳性对照,设置浓度分别为0、1.00、5.00、25.0、100.0、1 000.0μg·mL-1[13]。
1.2.4内生菌GZFJ 015发酵液稳定性测定
以灵芝菌棒病原菌LZ 2作为指示菌,参照何爱莲等[14]的方法,对菌株GZFJ 015发酵液热稳定性进行检测,将发酵滤液分别在40 ℃、60 ℃、80 ℃、100 ℃和120 ℃条件下处理30 min,以常温下保存的发酵滤液作为ck,参照何劲等[12]的方法进行抗菌活性的检测。同时,对菌株GZFJ 015发酵液的酸碱度稳定性进行检测,利用适宜浓度的HCl和NaOH溶液,将发酵滤液pH值调至3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00和11.00,检测不同酸碱度条件下发酵液的抗病原菌活性,方法同上。
2 结果与分析
2.1 对食用菌病原菌菌丝的抑制作用
如图1所示,与ck培养基平板相比,带药培养基(5%发酵液)平板对食用菌菌棒的6种病原菌菌丝生长均表现出较强的抑制作用,可观察到带药培养基上的病原菌菌丝稀疏、萎缩,甚至逐渐凋亡。其中,菌株XG 2、LZ 2和LZ 3表现为菌丝边缘产生纯白色粉末或颗粒状物质,而菌株XG 1、XG 3和LZ 1则是菌丝顶端或周围产生透明气泡。通过计算,带药培养基对几种病原菌菌丝生长抑制率均达到66.4%以上,LZ 2和XG 1的作用最强,分别为85.1%和83.8%,且相互间差异不显著(p<0.05),LZ 1和XG 2的效果次之,抑制率均超过70%。
2.2 内生菌GZFJ 015发酵液毒力(EC50)
采用生长速率法测定了小白及内生菌GZFJ 015发酵上清滤液对6种食用菌菌棒病原菌菌丝生长的毒力(见表1)。结果表明,发酵液作用于不同供试病原菌均表现出较强的抑制活性且有所差异,其浓度与菌丝生长毒力呈正相关关系,对病原菌XG 1、XG 2、XG 3、LZ 1、LZ 2、LZ 3的EC50分别为11.84、77.91、6.28、29.65、13.72、48.23μL·mL-1。其中,以抑制香菇菌棒病原菌XG 3的毒力最大,为香菇菌棒病原菌XG 2的12.41倍,表明不同病原菌对发酵液中抗菌物质的敏感性存在显著差异。并且,与ck多菌灵相比,内生菌GZFJ 015发酵液对病原菌XG 3、LZ 1、XG 2和LZ 3具有更强毒力。
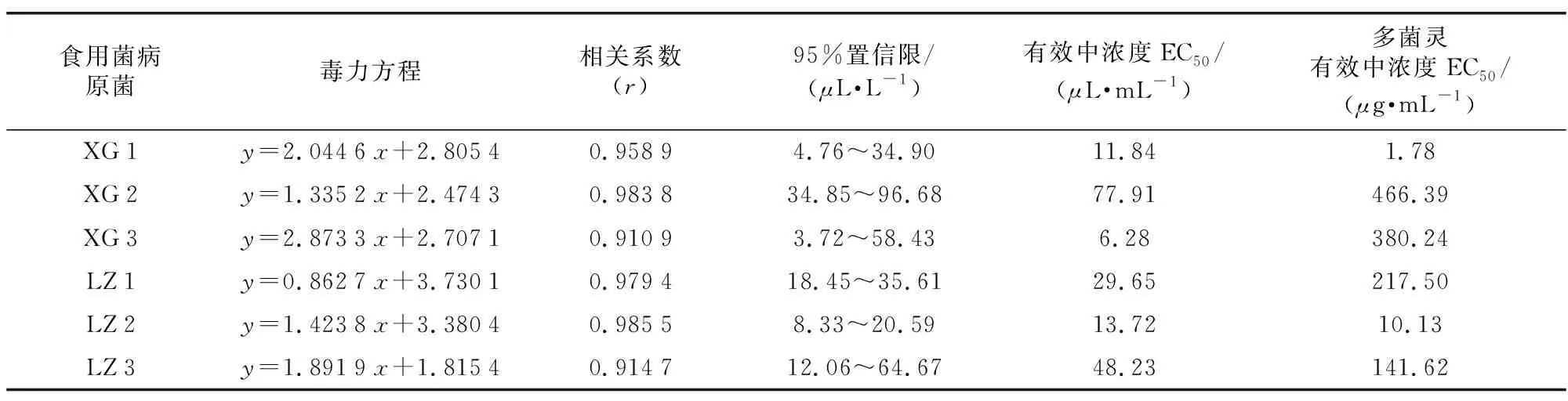
表1 内生菌GZFJ 015发酵液对6种食用菌病原菌菌丝的室内毒力Table 1 Effects of GZFJ 015 fermentation broth on the indoor virulence of hyphae of pathogens from 6 kinds of edible fungi
2.3 内生菌GZFJ 015发酵液稳定性
2.3.1内生菌GZFJ 015发酵液热稳定性
内生菌GZFJ 015发酵液经40 ℃、60 ℃、80 ℃、100 ℃和120 ℃条件处理,以常温下的发酵液作为ck,检测其对香菇菌棒病原菌GX 3菌丝生长的抑制率,分别为75.5%、69.3%、72.3%、27.9%、3.1%及ck组72.6%(见图3)。其中,100 ℃处理下的发酵液抑制率显著降低(p<0.05),在120 ℃时基本失去活性,说明高温处理对发酵液中抑菌物质的影响较大。但在80 ℃以下时,发酵液的抑菌活性趋于稳定,保持在72.3%~75.5%之间,相互间差异不显著,表明抑菌物质对中低温不敏感。
2.3.2内生菌GZFJ 015发酵液酸碱度稳定性
内生菌GZFJ 015发酵液在pH值为6.0~11.0范围内对香菇菌棒病原菌GX 3菌丝生长抑制效果较好且相对稳定,抑制率在70.6%~74.1%之间(见图4),说明其中抗菌活性物质的酸碱耐受范围较广,且略偏碱性。而当pH值在3.0~5.0范围内,随着酸性增强其发酵液抑菌活性显著下降(p<0.05),pH值为4.0和3.0时,抑制率分别降至44.3%和8.9%,表明其中抗菌物质对中强酸环境敏感。
3 结论与讨论
植物内生真菌作为一个发现时间短,生境特殊的微生物类群,存在许多尚未被鉴定的新种。由于内生真菌长期生活在植物体内的微环境中,与之发生协同进化,在演化过程中两者形成了互惠关系,一方面植物为内生真菌提供了生长发育所需的营养物质,另一方面内生真菌的代谢产物能刺激宿主植物生长发育,提高宿主植物对生物胁迫和非生物胁迫的抵抗能力。因此,内生真菌不仅能参与植物次生代谢产物的合成或转化,而且自身还拥有独特的代谢系统和防御体系,具备产生新颖结构和特异功能活性物质的潜力。因此,植物内生真菌作为一个天然活性产物筛选的巨大宝库越来越引起人们关注[15-16]。同时,处于生物多样性丰富、竞争激烈环境下的植物内生真菌产生活性次级代谢产物的可能性更大,通过适当筛选,植物内生真菌亦能成为农业病害生物防治的重要资源库,极具开发价值及应用前景[17-18]。
我国是农业大国,微生物源的病害每年都使农作物产量遭受巨大损失,尽管控制的措施和方法多种多样,但以化学药物为主的杀菌剂在作物病害综合防治中仍占主导地位。在实际生产中,采用农业防治和生物防治病虫害具有一定的局限性,由于资源条件有限、宣传普及力度不够、见效时间长等原因,综合导致我国3 R(Resistance、Resurgence、Residue)问题日趋严重。因此,有针对性地开发更多具有抗病活性的微生物资源,拓宽作物病害生物防治新途径,具有重要的理论意义和实际价值。本研究以内生真菌GZFJ 015作为抗性筛选菌株,对分离获得的香菇病原菌XG 1、XG 2、XG 3及灵芝病原菌LZ 1、LZ 2、LZ 3进行生防评价。结果表明,该菌株5%发酵液对各病原菌菌丝生长均具有较强的抑制作用,抑制率依次为83.8%、66.4%、71.5%、78.1%、85.1%及69.4%。通过观察发现,带药培养基上的病原菌菌丝稀疏、萎缩,部分呈现凋亡现象;其中,菌株XG 2、LZ 2和LZ 3表现为菌丝边缘产生纯白色粉末或颗粒状物质,而菌株XG 1、XG 3和LZ 1则是菌丝顶端或周围产生透明气泡。分析其原因,前者可能是菌落边缘菌丝形态发生畸变,聚集成簇,出现扭曲集结的现象[19],而后者则可能是病原菌细胞壁或膜结构发生解体,原生质渗漏,细胞产生自溶现象[20]。通过进一步毒力测定,获得发酵液有效中浓度EC50值依次为11.84、77.91、6.28、29.65、13.72、48.23μL·mL-1,其中对病原菌XG 3、LZ 1、XG 2和LZ 3毒力效果优于对照多菌灵。并且,发酵液的抑菌活性在80 ℃以下和pH值为6.0~11.0范围内相对稳定,高温或中强酸性环境易导致活性下降。
综上所述,小白及内生菌GZFJ 015对仿生态栽培香菇和灵芝菌棒病害表现出较好的生物防治潜力,本研究已初步完成其发酵液对6种食用菌病原菌的毒力检测以及部分稳定性试验。需进一步富集发酵产物,分离鉴定其中的有效活性成分,探索抗病机理,从而为生物农药资源的开发和新型抗生素的筛选奠定基础。

