不同氧浓度下甲烷氧化耦合反硝化及微生物协作机制研究
赖生平,杨洪伟,徐志磊,聂明建,*
(1.重庆德润环境有限公司,重庆 400000;2.中国市政工程中南设计研究总院有限公司,湖北 武汉 430000)
0 引言
随着城市化和经济水平的不断提升,城市人口数量快速增长,随之而来的城市生活垃圾的污染问题日益严重,如何妥善处置城市生活垃圾是世界各国面临的难题。我国城市生活垃圾的主要处置方法有焚烧、堆肥和卫生填埋。卫生填埋是20年前垃圾处置的最主要方法,但由于其选址十分严苛,并且对地下水、土壤、大气等均具有较大的污染,给生态系统带来了极大的威胁(王传英等[1])。为使填埋技术成为减少垃圾污染的一种技术方案,可采用准好氧填埋技术来改造老式厌氧填埋场或新建准好氧填埋场,更好地抑制垃圾填埋场中液体和气体污染物的产生。“准好氧填埋”的概念最初是由日本学者Hanashima教授提出的(Lee等[2]),近年来在中国得到广泛推广(Wu等[3])。这项技术从填埋场的结构设计出发,通过改造填埋场使内部存在好氧、微氧、厌氧并存的环境,促使垃圾能在不同条件下实现不同途径的污染物降解。准好氧填埋场中,空气可以通过渗滤液导排管扩散入填埋场中,使填埋场从上自下形成好氧-微氧-厌氧-好氧的分布。填埋场中厌氧层是形成甲烷和氨氮的最主要场所,而甲烷在向上扩散的过程中,在经过微氧和好氧层时,好氧甲烷氧化菌会利用其代谢特性来氧化甲烷,是垃圾填埋场中最重要的甲烷减排生物活动。氨氮在向下渗流的过程中,经过准好氧填埋场的底层好氧层,易被硝化细菌氧化为硝酸盐,渗滤液中的有机物也会部分被好氧降解。然而,渗滤液中的有机质和氮源尚未彻底去除,因此,通过渗滤液回灌的形式,将填埋场视作大型生物反应器而进一步去除污染物。回灌渗滤液中的氨氮进一步在表层好氧层中被氨氧化,和填埋场中扩散的甲烷将有可能在缺氧和微氧层相遇,实现甲烷氧化和反硝化的耦合。
不同类型的甲烷氧化耦合反硝化作用可能在不同的氧气条件下发生:(1)在含氧量约为5%的微好氧层中(Huang等[4]),好氧的甲烷氧化菌通过有氧呼吸氧化甲烷并产生中间有机物,进一步作为反硝化菌的电子供体来实现反硝化,这个过程称为微好氧甲烷氧化耦合反硝化(MAME-D);(2)在微好氧和缺氧层界面(IMAN),有限的氧气通过甲烷发酵或以硝酸盐为直接电子受体,执行缺氧甲烷氧化耦合反硝化(HYME-D)。
因此,本研究在实验室模拟了准好氧填埋场中的微好氧和缺氧环境,探究了甲烷氧化与反硝化是否耦合发生,并分析了参与这些过程的主要微生物。
1 材料和方法
1.1 垃圾样品
本研究使用的垃圾样品采集自中国重庆长生桥垃圾填埋场,在5个不同的地点随机采集两个深度的样品,深度约为70 cm和120 cm。来自同一深度的样本被混合在塑料密封袋中,立即运回实验室。在整个实验过程中,对不同深度的样品分别进行处理。
1.2 培养基和实验用气
本实验使用的培养基为硝酸盐无机盐培养基(NMS),其组成为:KH2PO4200 mg/L、K2HPO4400 mg/L、CaCl2·2H2O 500 mg/L、MgSO4·7H2O 1 000 mg/L、FeSO4·7H2O 9.1 mg/L、NaNO3浓度在200~400 mg/L之间(Huang等[4])。
进口气体大约由70%的甲烷和0~30%的二氧化碳组成。微好氧反应器添加5%的氧气,缺氧反应器添加1%的氧气,对照组反应器不加入氧气(Huang等[4]),剩下的气体比例用氩气填充。
1.3 浸出床生物反应器(LBB)的设置和运行
用于序批实验的三个等尺寸反应器主要由直径13 cm的柱子、上流式气体分配系统和下流式液体渗滤系统构成,反应原理见图1。从取样深度70 cm的样品中取出4 kg的样品接种到LBB2中,富集MAME-D相关微生物。从取样深度120 cm的样品中取出4 kg的样品接种到LBB3中,富集HYME-D相关微生物。对照试验中,将70 cm深度的2 kg样品和120 cm深度2 kg样品混合后加入LBB1中。将接种物在浸出床生物反应器中驯化培养60 d,使可溶性有机物消耗尽。在此之后,用氩气吹脱浸出床生物反应器中的空气,并通入设置比例的甲烷/二氧化碳/氧气,正式进行序批实验,实验运行参数设置详见表1。根据200~400 mg/L的进水硝酸盐负荷设置三个实验阶段,总共运行近50 d,每天6个循环,每个循环包括2 min的同时进水和曝气,56 min的渗滤和2 min的出水。培养基进水为2 L/d。温度控制在30±1 ℃。压力保持在大气压力。每天收集一次气体和液体样本。
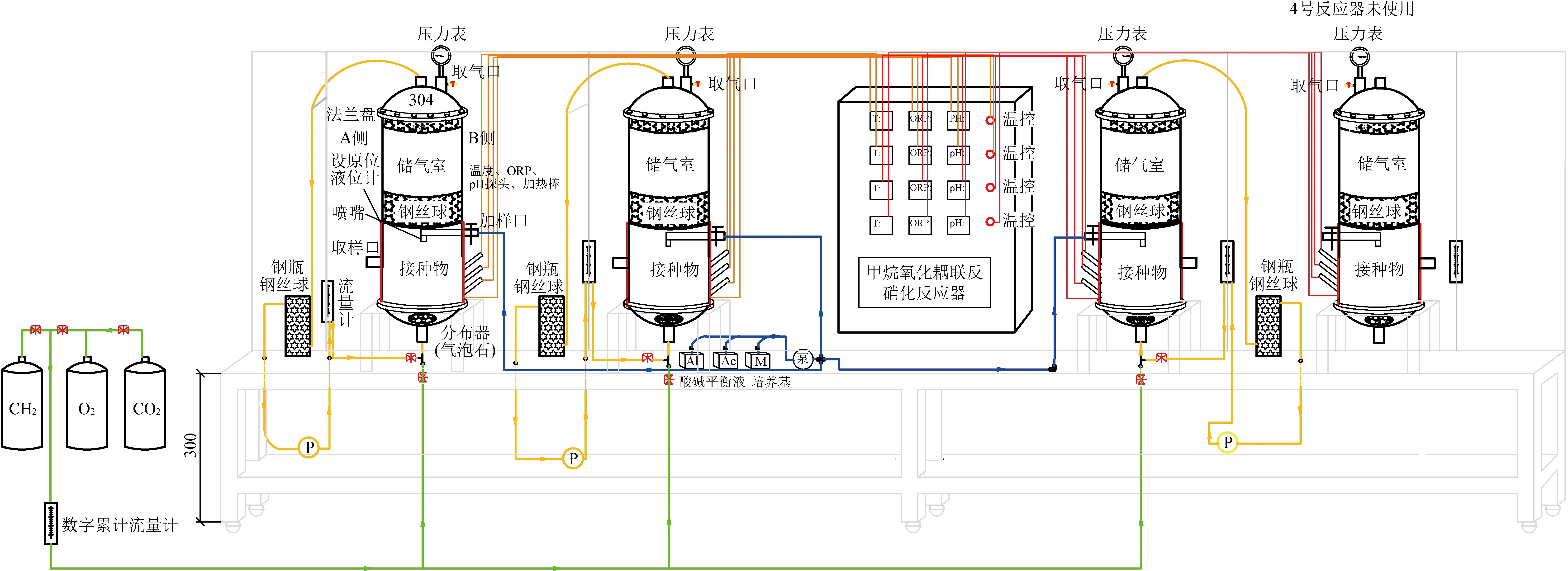
图1 生物反应器设计图Fig.1 Design drawing of bioreactors
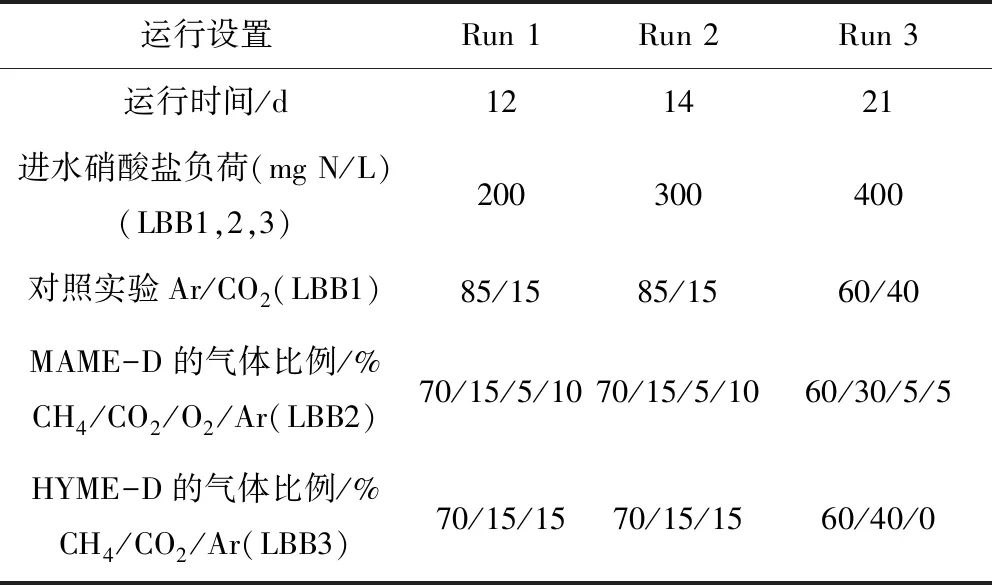
表1 实验各阶段运行参数设置
1.4 分析方法

1.5 DNA提取、PCR扩增以及高通量测序
从序批实验开始到结束,分别取三个反应器各阶段样本各一个进行DNA分离。使用TOYOBO KOD-Plus-Neo DNA聚合酶和细菌通用引物515F(5'-GTGYCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')进行PCR扩增细菌16S rRNA基因。最后,用罗宁生物有限公司高通量测序仪对文库进行配对测序(2×250 bp)。
2 结果与讨论
2.1 甲烷氧化与反硝化耦合的证据
三阶段运行期间三套反应器中硝酸盐和甲烷浓度变化如图2所示。总体来说,在LBB2和LBB3中成功地实现了甲烷氧化耦合硝酸盐反硝化。在LBB2中,观察到大量的甲烷消耗,并且硝酸盐的消耗程度与甲烷消耗程度保持一致。每阶段运行的反硝化率均达到100%,并且第三阶段运行的反硝化效率达到最大,其效率为16.54 mmol/d。运行过程中检测到少量亚硝酸盐,范围为0.01~0.98 mmol,在每阶段的初期少量累积,后期下降。在MAME-D系统中,最大反硝化效率为16.54 mmol/d,相当于4.82 mg N/(L·d),高于许多报导的MAME-D体系中的反硝化率(Houbron等[6],Thalasso等[7],Waki等[8],Werner和Kayser[5])。然而,本系统的反硝化率低于Werner和Kayser[5]报导的流化床生物反应器的反硝化率。在LBB3中也观察到甲烷和硝酸盐的消耗,最大反硝化率和反硝化效率分别为85.67%和9.88 mmol/d。亚硝酸盐的积累在第二阶段开始时最高(约为0.42 mmol),然后慢慢下降到0。在不含甲烷的对照试验组LBB1中,由于接种剂中的有机残渣和硝酸盐的同化作用导致硝酸盐浓度有少量的下降。

图2 三阶段运行期间LBB1、LBB2和LBB3中硝酸盐和甲烷的浓度变化Fig.2 Concentration changes of nitrate and methane in LBB1,LBB2 and LBB3 during three operation phases
与对照组LBB1相比,微氧和缺氧反应器均表现出较高的甲烷氧化和反硝化活性。此外,MAME-D比HYME-D具有更高的甲烷氧化和反硝化活性。这可能是由于氧气比硝酸盐具有更低的氧化电位,使其能够更快更容易地实现电子传输。
2.2 CO2对pH的影响
在实验中还观察到了反硝化作用引起的pH升高和CO2调节pH的缓冲作用,结果如图3所示。在LBB2的第二阶段运行中,当混合气体中的CO2浓度在600 mmol/L以下时,由于反硝化作用pH迅速上升到8。第二阶段运行到21天时,pH开始下降(从7.97到7.77),应该是由于硝酸盐的消耗殆尽导致反硝化停止。在LBB3的第二阶段运行中,由于反硝化作用持续到第二阶段运行结束,pH从7.38一直增加到7.88。可见,反硝化作用与pH值变化呈明显的负相关性。据报道,MAME-D和HYME-D的最佳pH值为7~8(He等[15],Sun等[16])。因此,持续的反硝化作用可能导致pH超出最佳反应pH范围。CO2是垃圾填埋场厌氧发酵的天然产物,占准好氧垃圾填埋场沼气成分的19%~28%(Huang等[5])。因此,二氧化碳可以是一个重要的反硝化pH缓冲物。从第三阶段运行可以看出,当CO2的浓度从250 mmol/L提高到1 297.31 mmol/L(LBB2)和从590 mmol/L提高到1 552.69 mmol/L(LBB3)时,pH出现明显下降,在LBB2中从7.77下降到7.21,在LBB3中从7.88下降到6.91。在第三阶段运行中,虽然LBB2和LBB3的pH值仍有明显的上升,但在后期稳定在7.6和7.4的水平,说明CO2有很好的缓冲作用。
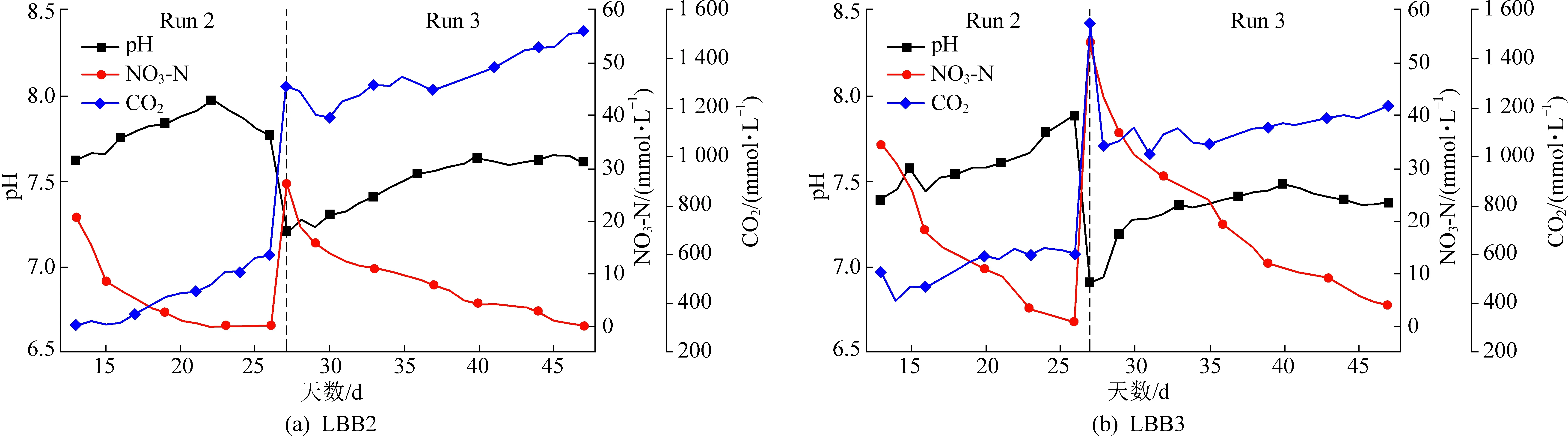
图3 LBB2和LBB3中第二和第三阶段的pH、硝酸盐浓度和二氧化碳浓度变化Fig.3 Changes of pH,nitrate and CO2 concentrations in LBB2 and LBB3 during the second and third stages
2.3 MAME-D和HYME-D的群落多样性和功能微生物
从LBB1、LBB2和LBB3的富集培养物中提取全基因组DNA,构建16S rRNA基因克隆文库。图4系统发育树显示了丰度较高的前28个菌株。由图4可知,大多数菌株种类属于变形杆菌门。γ-变形杆菌门中的甲基双球菌科(Methylococcaceae)和β-变形杆菌门中的Methylophilaceae在科水平上分别在LBB2和LBB3中占优势。此外,Methylophilaceae中的甲基菌属(Methylobacillus)在LBB2和LBB3的末期分别占有1 646和11 051个OTUs,相对丰度分别为6.3%和10.05%。甲基杆菌属(Methylobacter)属于甲基双球菌科(Methylococcaceae),OTUs分别为1 172和8 475,在LBB2和LBB3中分别占末期相对丰度的4.11%和7.55%。甲基单胞菌(Methylomonas)在甲基双球菌科(Methylococcaceae)中,共有1 250和8 747个OTUs,最终分别占LBB2和LBB3中相对丰度的4.78%和8.0%。这三种细菌在两种体系中均显著富集,在LBB3中更为丰富。

图4 富集培养样品的系统发育关系Fig.4 Phylogenetic relationships of enrichment culture samples
Wei等[17]报道甲基杆菌属是低氧(O25%~20%)环境中最重要的甲烷氧化菌之一。甲基单胞菌还具有将甲烷好氧氧化或缺氧氧化成有机化合物的重要潜力(Ogiso等[18])。甲烷氧化产生的主要有机中间体有甲醇、乙酸盐(Costa等[19])、柠檬酸盐和蛋白质(Eisentraeger等[20])。据报道,甲基菌属可以利用甲基营养物的甲醇基和甲胺基作为碳源来进行硝酸盐反硝化作用(Doronina等[21])。因此,可以确定甲基杆菌、甲基单胞菌和甲基菌属的结合可以实现微氧环境下的甲烷氧化耦合反硝化。此外,有多项研究报导,在甲烷和硝酸盐充足的情况下,甲基单胞菌在好氧和厌氧环境的界面处(IMAN)丰富而活跃,这与在LBB3中观察到的现象一致。它们在缺氧条件下丰富的原因可能是甲烷发生了发酵,为甲烷氧化菌的生存提供了能量。甲烷发酵产生的中间体比甲烷氧化产生的中间有机物更加丰富(Kalyuzhnaya等[13])。因此,大量的电子供体被运送到甲基营养性反硝化菌(如甲基菌属),从而发生反硝化作用。这也可以解释为什么甲基菌属在LBB3中的相对丰度高于LBB2。
2.4 准好氧垃圾填埋场碳氮共循环系统假设
研究结果表明,气体扩散、液体渗滤、反硝化和甲烷氧化之间存在相关性,这在准好氧垃圾填埋场具有很好的适用性,详见图5。这些过程还可能与氨氧化、硝化、有机降解和厌氧消化有关。
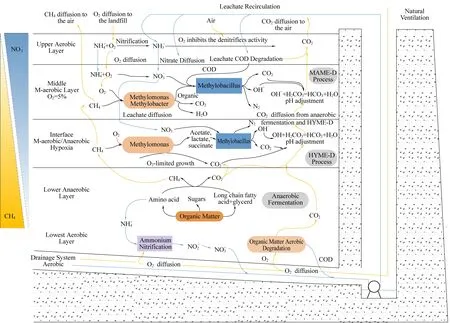
图5 准好氧垃圾填埋场氮碳共循环系统假设Fig.5 Hypothesis of nitrogen and carbon co-cycling system in semi-aerobic landfills
由图5可以看出,在准好氧垃圾填埋场中,空气被动扩散到渗滤液排水系统,导致COD下降,氨氮被硝化。因此,低COD负荷和高硝酸盐浓度的再循环渗滤液渗透到上部好氧区。在这一领域,有机残留物可以进一步降解,但高氧浓度抑制反硝化菌的活性。因此,硝态氮不能在表层土壤中被反硝化。
在中微好氧层中,LBB2中发现的甲基单胞菌和甲基杆菌属等细菌在5%的氧条件下将甲烷氧化为有机化合物。随后,本研究鉴定的甲基杆菌将硝酸盐和有机化合物转化为CO2、N2和OH-。在IMAN层中,厌氧层中产生的甲烷和残留的硝酸盐可以通过甲基单胞菌甲烷发酵和甲基菌属还原硝酸盐发生HYME-D。这两个过程都会产生二氧化碳和OH-,它们同时起缓冲作用,维持系统的中性条件。
3 结论
采用MAME-D和HYME-D系统在浸出床生物反应器中进行了脱氮、甲烷氧化的实验研究,得出以下结论:
(1)与HYME-D工艺相比,MAME-D工艺具有更高的反硝化效率和甲烷氧化效率;
(2)注入体系的CO2作为良好的缓冲液维持pH的稳定;
(3)细菌群落系统发育分析揭示了甲基杆菌属和甲基单胞菌分别在微氧和缺氧条件下的甲烷氧化和甲烷发酵功能。同时,甲基菌属消耗中间有机物并完成反硝化;
(4)基于上述结论,在准好氧垃圾填埋场中提出了一种基于MAME-D和HYME-D的新型氮碳循环系统:在准好氧填埋场微好氧层中,甲烷氧化的有机物供给反硝化菌碳源发生反硝化作用;在缺氧层,甲烷通过甲基单胞菌发生甲烷发酵作用,并和甲基菌属作用进行反硝化。

