感染坏死性胰腺炎在CT影像学上的临床分型
涂玉亮,蔡守旺,刘志伟,王大东,谭向龙,宦宏波,冯健,辛先磊,王鹏飞,韩明明,张卓超
(中国人民解放军总医院 肝胆胰外科医学部,北京 100048)
急性胰腺炎是较常见的急腹症,病情变化快,其中有15%~20%为重症急性胰腺炎(severe acute pancreatitis,SAP),而并发胰腺或胰腺周围组织感染的感染坏死性胰腺炎(infected necrotizing pancreatitis,INP)病情更凶险,与无并发感染的SAP比较,其病死率更高[1],常常需要外科处理。随着微创理念和微创技术的发展,INP的微创治疗有了较大发展。“渐进式”微创外科技术(step-up approach)是治疗INP的一种有效方法[2-3]。微创外科治疗首先要对感染灶行经皮穿刺置管引流(percutaneous catheter drainage,PCD)。由于INP感染灶周围存在不同脏器,穿刺过程中可能损伤感染灶周围或穿刺通道周围的脏器[4-5]。而且,不同位置的感染灶,如果穿刺引流的位置和方向不正确,可能导致感染灶引流不充分。如果能将INP根据感染灶扩散范围进行分区和分型,在PCD之前更加清晰地了解感染灶的解剖位置及其与周围脏器的解剖关系,则可能减少周围脏器损伤,并提高PCD引流效果。近年来,INP的内镜治疗也受到越来越多的重视[6-8]。对于不同部位的坏死感染灶,可以采用不同的治疗方式,如果能将INP根据感染灶扩散范围进行分型,可能对不同类型的INP的治疗方法的选择有一定的指导作用。但目前没有一种INP的分型方法能指导INP治疗方式的选择。为此,本文回顾性分析112例INP患者CT影像学表现,根据INP胰腺周围感染灶的影像学解剖位置进行分型,为INP治疗方案的选择和操作步骤的优化提供解剖学的依据。
1 资料和方法
1.1 一般资料
回顾性分析2008年6月6日至2014年12月31日解放军总医院第一医学中心和第四医学中心收治的INP病例112例。年龄22~93岁,平均(48.2±14.1)岁;男女比例79:33。病因:胆源性54例(48.2%),高脂血症28例(25%),酒精性21例(18.8%),ERCP术后、胰十二指肠切除术后、外伤、慢性胰腺炎急性发作等其他原因9例(8%)。所有病例符合《1993年急性胰腺炎分类的亚特兰大国际共识》[9]和《2012 版急性胰腺炎分类:亚特兰大国际共识的急性胰腺炎分类和定义的修订》[10]诊断标准,胰腺及胰腺周围组织坏死感染的诊断依赖于典型症状和CT扫描可见坏死液化有气体,或细针穿刺活检细菌培养来确定。
1.2 INP分区和分型方法
回顾每一例患者的CT资料,由两名医师同时分析,总结归纳感染灶的位置。根据腹膜后解剖特点、感染灶的延续性和完整性、有利于PCD穿刺的最佳位置选择[11],将感染灶的解剖位置分为5 个不同区域:(1)胰腺区域,包括胰腺实质组织、胰腺包膜周围脂肪组织、胰腺下沿肠系膜根部脂肪组织坏死感染灶;(2)网膜囊区域,包括小网膜囊和大网膜囊;(3)脾胃间隙;(4)左侧腹膜后间隙,位于胰尾-脾肾间隙-左肾前/后间隙-降结肠后间隙-左髂窝轴区域;(5)右侧腹膜后间隙,位于胰头后-十二指肠后-肝肾间隙-右肾前后间隙-升结肠后间隙-右髂窝轴区域。
INP感染以胰腺为中心,向胰腺周围,尤其是腹膜后间隙扩散。根据感染灶扩散范围将INP分为三种不同类型(见表1)。I型,感染灶仅局限于胰腺区域。II型,感染灶扩散至胰腺周围区域,包括:IIa型,网膜囊区域(+/-胰腺区域);IIb型,脾胃间隙(+/-胰腺区域);IIc型,网膜囊+脾胃间隙(+/-胰腺区域)。III型,感染灶扩散至侧腹膜后区域,包括:IIIa型,左侧腹膜后间隙(+/-胰腺周围区域);IIIb型,右侧腹膜后间隙(+/-胰腺周围区域);IIIc型,左、右侧腹膜后间隙(+/-胰腺周围区域)。IIIc型包含两种特殊类型,即:马蹄型和哑铃型。马蹄型,感染灶位于胰腺周围区域+网膜囊/脾胃间隙+左右腹膜后间隙;哑铃型,感染灶位于左、右侧腹膜后间隙感染灶,经脊柱前疏松结缔组织间隙相通。
2 结果
112 例INP病例总共有204 个感染灶位置区域,胰腺区域、网膜囊、脾胃间隙、左侧腹膜后间隙、右侧腹膜后间隙五区域的感染灶例数分别为42例、43例、16例、68例、35例,其中以左侧腹膜后间隙感染灶最多(68/204)。每例患者的感染灶位置可以是单一区域,也可以是混合型多区域,大多数INP病例为两个以上区域的混合型多区域感染。
INP分型见表1,I型12例(见图1);II型14例(见图2),其中IIa型8例,IIb型5例,IIc型1例;III型,86例,其中IIIa型51例(见图3),IIIb型18例(见图4),IIIc型17例。IIIc型的两种特殊类型,即马蹄型7例(见图5)和哑铃型2 例(见图6)。INP分型中III型最多,86 例(76.8%),其中IIIa型最常见,51例(45.5%)。胰腺区域感染灶有42 例,但单纯I型病例仅有12 例,大多数胰腺区域感染灶伴随其他区域的感染灶存在,形成其他类型的INP。
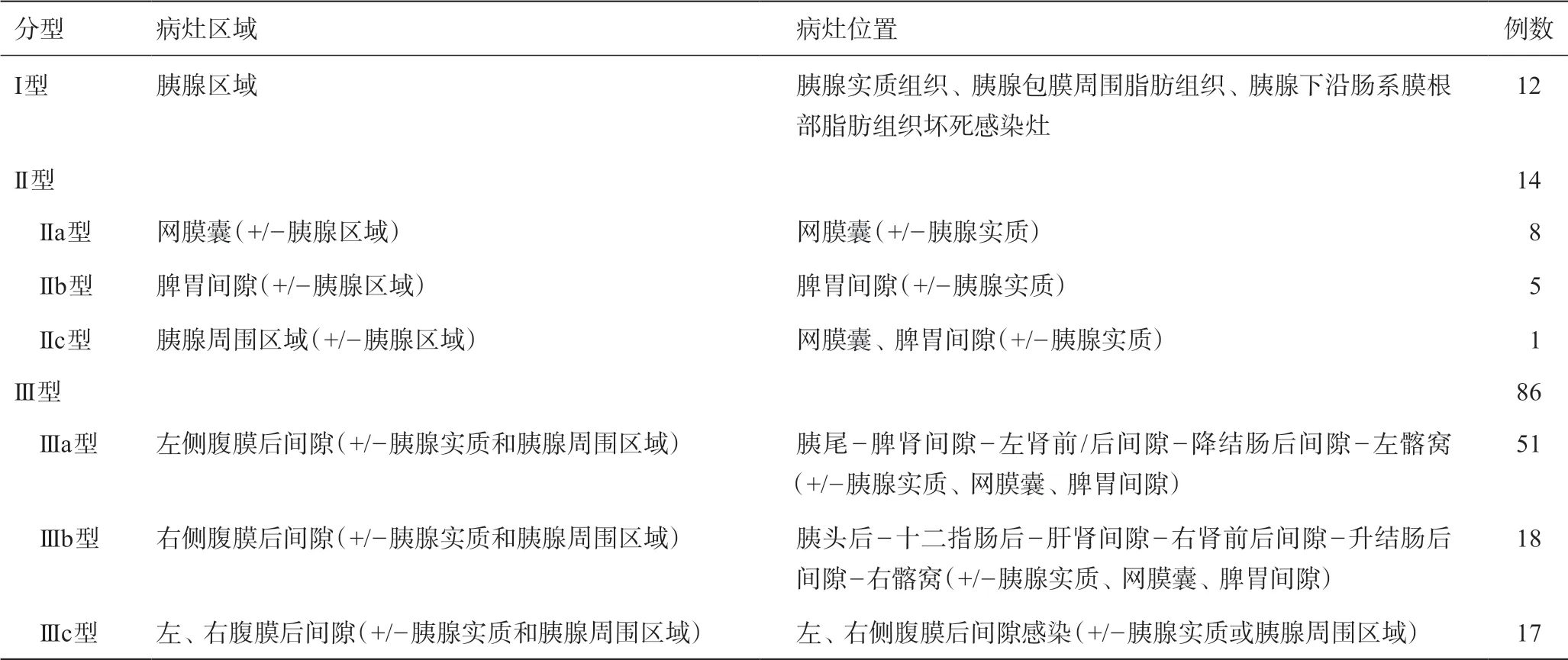
表1 本组病例INP分型

图1 I型INP:胰腺坏死感染伴有胰腺周围小范围感染
3 讨论
3.1 根据感染灶扩散范围的INP分型
INP感染灶包括胰腺组织坏死感染及其周围脂肪组织坏死感染。胰腺作为腹膜外位脏器,感染灶可以沿胰腺周围及腹膜后间隙扩散,以腹膜后间隙扩散为主,形成不同位置的感染灶。当坏死和感染灶仅局限于胰腺实质及其包膜周围,感染未扩散至网膜囊和更远的腹膜后间隙,则形成胰腺区域局部感染灶,我们称之为I型INP,包括胰腺实质、胰腺包膜周围组织、肠系膜根部脂肪组织等胰腺区域的感染灶。单纯的胰腺区域局部坏死感染者较少,INP患者中大多数是与其他腹膜后间隙坏死感染同时存在。本组病例中,有42例(37.5%)胰腺区域感染灶,其中仅有12例是I型INP。
当胰腺及其周围的积液聚集增多,扩散至网膜囊,使网膜囊大量积液、坏死,当这些积液和坏死组织出现感染,则形成网膜囊内坏死组织感染(见图2A)。正常情况下大网膜前后两层腹膜常常紧密相贴,但SAP患者胰腺周围积液可以延伸扩散到横结肠以下网膜囊,在大网膜前后两层腹膜间和网膜组织内形成大量积液、坏死(见图2E)。胰尾部的积液逐渐增多后可以扩散至胃脾韧带,在胃脾韧带内形成大量积液,胃脾韧带坏死感染后在脾胃间隙形成感染灶。所以,胰尾部坏死感染,可以扩散到胃脾韧带,形成脾胃间隙感染灶(见图2C),部分脾胃间隙感染灶可以向上扩散至左膈下。当胰腺周围感染灶扩散至网膜囊和脾胃间隙,我们称之为II型INP。本研究结果显示,112例INP患者中有网膜囊区域感染灶43例(38.4%)、脾胃间隙感染灶16例(14.3%),这两区域的感染灶也常与其他区域感染灶同时存在,属于II型的INP仅有14例(12.5%)。
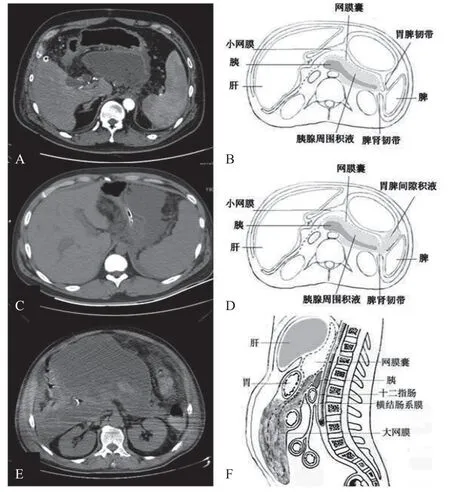
图2 II型INP:A、B为IIa型,小网膜囊区域感染灶,由胰腺坏死感染直接扩散形成;C、D为IIb型,感染灶多由胰尾部经胃脾韧带扩散至脾胃间隙区域,形成脾胃间隙感染灶;E、F为IIa型,感染灶扩散至大网膜囊,形成大网膜囊内的感染灶。
胰腺作为腹膜后间隙中的腹膜外位器官,与腹膜后的各个间隙通过疏松结缔组织相通。Thornton等[12]将8具尸体的腹膜后间隙内注入造影剂,CT扫描后发现腹膜后间隙的造影剂均通过腹膜外脂肪层进入盆腔腹膜外间隙和骶前间隙。Gore等[13]研究认为腹膜后疾病可以从肠系膜后平面扩散至盆腔腹膜外间隙。Goenka等[14]认为,腹膜后间隙可以从横膈膜向下延伸到盆腔边缘。胰尾部沿脾肾韧带后方的疏松结缔组织,与左侧肾旁前/后间隙相连,下行至左结肠后间隙、左髂窝,形成胰尾-脾肾间隙-左肾筋膜前/后间隙-左结肠后间隙-左髂窝通道轴。INP胰尾部感染灶通过此轴型通道进入左肾前/后间隙,并沿左肾筋膜前/后间隙向下,沿左结肠后间隙向左髂窝扩散(见图3)。在右侧腹膜后间隙,胰头周围的感染灶可以通过胰头、十二指肠后间隙、肝肾韧带,扩散至右肾筋膜前/后间隙,并向下扩散至右结肠后间隙和右髂窝,形成胰头-十二指肠后间隙-肝肾间隙-右肾筋膜前/后间隙-右结肠后间隙-右髂窝感染通道轴(见图4)。我们将胰腺周围感染灶扩散至左右腹膜后间隙,称之为III型INP。本组病例中,INP感染灶最多见于两侧腹膜后间隙,III型侧腹膜后间隙型86例(76.8%),其中IIIa型即左侧腹膜后间隙型最多见,51例(45.5%)。左侧腹膜后间隙感染灶常与脾胃间隙感染灶同时存在(见图3),而右侧腹膜后间隙感染灶常与网膜囊感染灶同时并存(见图4)。如果感染灶自胰腺周围扩散至两侧腹膜后间隙,形成一种特殊的INP即马蹄型INP(见图5)。

图3 IIIa型INP:胰腺坏死,感染灶由胰尾向上扩散至脾胃间隙(B、C),向下扩散至左肾筋膜前间隙(E、F),脓腔内有明显积气(D、E、F)。

图4 IIIb型INP:同时合并有网膜囊感染灶(II型),感染灶由网膜囊(A、B)、肝肾间隙、十二指肠后间隙扩散至右肾前间隙、右髂窝(A~F),部分感染扩散至脊柱前疏松结缔组织间隙(D、E)。
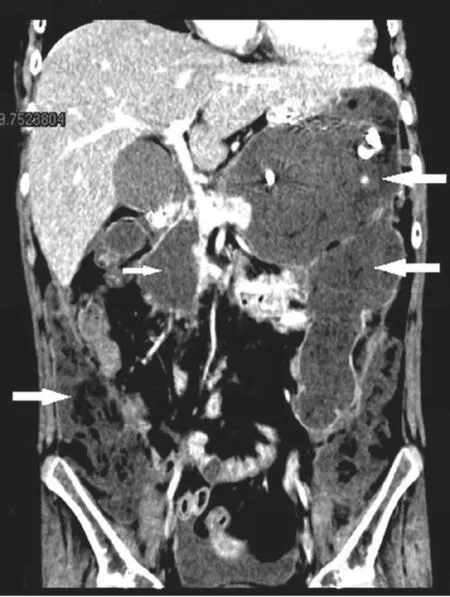
图5 马蹄型INP:感染灶由胰腺周围、网膜囊、脾胃间隙,扩散至左右侧腹膜后间隙。
左、右腹膜后间隙可以通过脊柱前疏松结缔组织间隙相通。姜苏明等[15]将30具尸体做标本观察发现,两侧肾周间隙完全不相通者占30%,相通者占70%,而相通者均在双侧肾门水平有相通,少数还在L3~5和T11~12水平以及主动脉孔前上方经膈前方相通;而在腹腔动脉和肠系膜上动脉起始部之间的区域,由于有致密结缔组织、神经丛和神经节的存在以及肾前筋膜与此相连的紧密连接,此区域不能使两侧连通。Meyers[16]认为由于胰腺特殊的位置,其本身就是潜在的通道,使肾旁前间隙左、右两侧相互通连;肾旁前间隙内注入对比剂后CT扫描也说明两侧是相通的。所以在INP患者中,腹膜后的感染灶可能通过胰腺周围潜在的通道或者脊柱前间隙将左右侧腹膜后感染灶相互连通,形成另一种特殊的III型INP即哑铃型INP(见图6)。
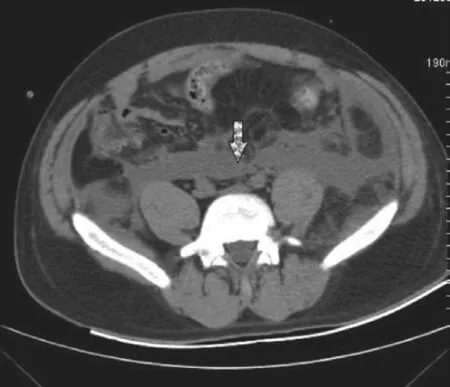
图6 哑铃型INP:左、右侧腹膜后间隙感染灶,经胰腺周围感染灶或脊柱前疏松结缔组织间隙感染灶相通。
3.2 INP分型对INP治疗的指导作用
不同类型的INP,治疗方式需根据患者的病情特点行个体化选择。对于I型INP,由于感染局限,无适当的穿刺路径而无法行PCD和小切口微创治疗,也因感染灶与胃壁之间间隙较大而无法行内镜治疗。这些患者仍以开腹手术行胰腺坏死感染灶的清创引流术为主[17],但需要在积极的抗生素治疗无效后施行。笔者诊治过的两例I型INP患者,均给予广谱抗生素治疗后痊愈。对于II型INP,位于小网膜囊和脾胃间隙的坏死感染灶,可以行内镜下的感染灶清创引流术,也可以行微创外科治疗。与微创外科治疗比较,内镜治疗的胰瘘等并发症更少、住院时间更短[6,18],所以,位于小网膜囊和脾胃间隙的II型INP,可以首先考虑内镜治疗。对于位于大网膜囊的II型INP巨大感染坏死灶,经腹壁的PCD即可起到很好的引流效果。当INP感染灶扩散至两侧腹膜后间隙,形成III型INP,内镜治疗无法达到,此时需要外科微创治疗,先行PCD引流,部分病例通过PCD引流能得到治愈[19]。如果PCD引流效果不佳,则需进一步行小切口微创外科清创引流[2,20]。
INP的微创外科治疗首先需要行PCD穿刺置管引流。PCD穿刺原则是既要能充分引流,又要做到安全,尽量避免穿刺置管过程中的各种脏器损伤,比如结肠损伤、脾损伤、肾脏损伤、肝脏损伤等。INP根据感染灶扩散范围的分型,或许能指导PCD的穿刺位置和穿刺方向,提高PCD的引流效果,减少PCD的脏器损伤风险。
总之,INP感染灶沿着胰腺周围及腹膜后间隙的解剖特点呈特征性扩散分布。笔者所在单位在临床实践中根据INP感染灶的分布特点和感染扩散范围,将INP进行临床分型,并根据该分型指导经皮穿刺轩管引流(PCD)穿刺的位置和方向,取得较好的临床效果。在将来的临床研究中,我们将进一步阐明基于影像学的INP临床分型的临床依据,以及INP分型对INP治疗方案选择和操作步骤优化的指导作用。