基于Sestrin 2通过mTOR信号通路调节胰腺癌上皮-间质转化过程的实验研究
戴胜杰,陈豪,楼彬,孙洪伟
(1.温州医科大学附属第一医院 肝胆胰外科,浙江 温州 325035;2.浙江省杭州市余杭区第三人民医院 普外科,浙江 杭州 311115)
胰腺癌由于其进展迅速、早筛率较低等因素,被认为是恶性程度极高的肿瘤,其5 年生存率不到5%[1-3]。目前胰腺癌的治疗仍以手术治疗为主,而只有不到10%的胰腺癌患者能达到根治性切除的标准,且仍不能保证术后生存期[2-4]。虽然近年来靶向治疗、放疗、化疗、生物治疗等辅助治疗技术取得较大进步,在一定程度上改善了胰腺癌的预后,但这种改善仍不尽人意。因此,寻找有效遏制胰腺癌恶化进程的手段变得极为重要。
众所周知,当肿瘤发生侵袭和转移时,治疗变得更加困难。而上皮-间充质转化(EMT)进程被认为是肿瘤发生转移侵袭的早期阶段,随着EMT进程的推进,细胞骨架发生重塑,细胞的黏附力减弱甚至丧失,细胞极性异常,从而增加转移能力,导致肿瘤的转移扩散。在EMT进程中,上皮细胞特征标志物表达减少(如E-钙黏蛋白,被认为是肿瘤向浸润性癌进展的关键步骤),而间质细胞特征标志物表达相应增加(如N-钙黏蛋白、波形蛋白)[5-6]。Sestrins家族成员主要有Sestrin 1、Sestrin 2和Sestrin 3[7-8]。Sestrin 2(SESN2)主要在细胞增殖分化、凋亡自噬和生长存活中发挥作用,并参与调控mTOR信号通路。Sestrin 2 可通过激活AMP依赖性蛋白激酶(AMPK)和失活Rheb胍三磷酸酶来抑制mTORC1,也可直接抑制RAG GTP酶来影响mTORC1活性,从而调控细胞的生长和分化。同时,mTOR参与了EMT进程中具有不容忽视的作用[9]。已有研究表明,Sestrin 2在结直肠癌、肺癌、黑色素瘤等多种肿瘤中的表达下调可导致mTOR信号通路过度激活,导致细胞代谢和氧化应激失衡,从而促进肿瘤的增殖、生长、侵袭和转移[10-13]。而Sestrin 2 在胰腺癌恶化进程中的作用尚不清楚。因此,本研究将探索Sestrin 2 在胰腺癌EMT进程中的作用,并探究其是否与mTOR信号通路具有相关性。
1 材料和方法
1.1 细胞株和试剂
本研究采用两种人胰腺癌细胞系进行研究,分别为PANC-1 细胞系和CFPAC-1 细胞系(购自中国科学院细胞库)。上述胰腺癌细胞采用标准细胞培养法,相应培养基分别为添加了10%胎牛血清的DMEM培养基和RPMI-1640培养基。抗Sestrin 2抗体购自Proteintech(美国)。抗E-钙黏蛋白抗体、抗N-钙黏蛋白抗体、抗波形蛋白抗体和抗p70S6K抗体均购自Sigma Chemical(美国)。
1.2 病毒转染和分组方法
上述两种胰腺癌细胞株分别进行Sestrin 2 敲减病毒、Sestrin 2 阴性敲减病毒、Sestrin 2 过表达病毒和Sestrin 2 阴性过表达病毒转染,最终将每种胰腺癌细胞株转染培养形成对照组、Sestrin 2 敲减组(Sestrin 2-组)、Sestrin 2过表达组(Sestrin 2+组)、阴性敲减组和阴性过表达组五个模型。
1.3 划痕实验
将不同模型组细胞接种于6孔板上,每孔约2× 105个细胞。当6孔板中细胞覆盖率达80%~100%时,将其原有培养基去除,采用无血清培养基孵育1 h,然后用无菌移液管尖均匀用力划出一道划痕,并将 0 h和48 h后的划痕情况进行拍摄并定量计算,统计实验结果。
1.4 Transwell侵袭实验
首先,将基质胶(BD Biosciences,CA,USA)均匀铺于Transwell板小室底部的聚对苯二甲酸乙二酯膜(8 μm孔径)上,待其凝固成胶冻状后将已经过饥饿处理后的胰腺癌细胞(含有约5×104个细胞的100 μL无血清培养液)接种至小室中,同时在下室加入500 μL含10%胎牛血清的对应培养基。胎牛血清铺垫在下室中可作为趋化因子促进肿瘤细胞的侵袭行为。经过恒温箱24 h的孵育,取出小室置入 4%多聚甲醛中固定15 min,随后用结晶紫试剂染色10 min后冲洗干净,并擦去小室内膜细胞。最后,将小室倒置,随机选取3个视野对小室进行观察,计数外膜细胞数并摄像。
1.5 Western blotting实验
将含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA缓冲液加至培养后的相应模型胰腺癌细胞中使细胞裂解而收集总裂解产物。然后离心总裂解产物,收集离心后上清液,并用BCA法测定蛋白浓度后在10%聚丙烯酰胺凝胶中分离相应蛋白质混合物(包括预染色的蛋白质标志物)。随后,将分离后的蛋白质转移至聚偏二氟乙烯(PVDF)膜上,在室温下把相应PVDF膜放在5%脱脂乳的Tris缓冲盐水(10 mmol/L Tris-HCl,pH 8.0,含有150 mmol/L NaCl和0.1% Tween-20)中封闭2 h后,最后将PVDF膜置于对应一抗溶液中4 ℃孵育过夜。次日,将PVDF膜用TBST 清洗后,放在辣根过氧化物酶(HRP)结合的二抗中室温孵育1 h,使用AlphaEaseFC(STandalone)记录和测量蛋白条带的密度。
1.6 RNA提取和RT-PCR
使用Trizol试剂(Ambion,Carlsbad,California,USA)提取对应胰腺癌细胞组总RNA。然后,将不同组别的总RNA(1 μg)进行逆转录,随后加入SYBR Green Master进行RT-PCR,用7500实时PCR系统进行qRT-PCR定量分析,计算相应ΔCt值,并进行分析。β-actin作为内参。不同PCR引物具体序列见表1。

表1 PCR引物序列
1.7 动物负瘤实验
将约1×107个胰腺癌细胞悬浮液注射于无胸腺裸鼠皮下[BALB/C-nu/nu,6~8周龄,雌性,购自中国科学院动物中心(上海)]。随着肿瘤细胞定植在裸鼠皮下,会在注射部位形成微肿瘤,定期观察各模型组裸鼠的肿瘤情况。相关动物实验伦理已经温州医科大学伦理委员会批准。
1.8 TCGA数据库分析
在癌症基因组图谱数据库(TCGA,https://tcgadata.nci.nih.gov/tcga/)中下载176例胰腺癌患者相关数据并进行分析,相应操作均符合TCGA相关政策。
1.9 统计学分析
采用SPSS 19.0软件(IBM,USA)进行分析,收集3次以上独立实验获得的数据,并用()表示。组间数据比较采用方差分析,而P<0.05 认为差异具有统计学意义。
2 结果
2.1 Sestrin 2在人胰腺癌中呈低表达并与胰腺癌预后密切相关
首先,本研究初步探索了Sestrin 2与胰腺癌的关系。通过分析来自TCGA数据库的176例胰腺癌患者数据,我们发现高表达Sestrin 2组比低表达Sestrin 2 组拥有更长的生存周期(P<0.05,图1A)。其次,我们简单分析了Sestrin 2与KRAS之间的相关性(KRAS作为胰腺癌的四大驱动基因之一,在胰腺癌的发生发展中起着重要作用)。结果表明,Sestrin 2在存在KRAS突变的胰腺癌患者中的表达量显著低于无KRAS突变的胰腺癌患者(P<0.05,图1B)。最后,我们对四组人类胰腺癌组织及其癌旁胰腺组织进行蛋白质定量检测,结果表明Sestrin 2 在胰腺癌组织中呈显著低表达(图1C)。
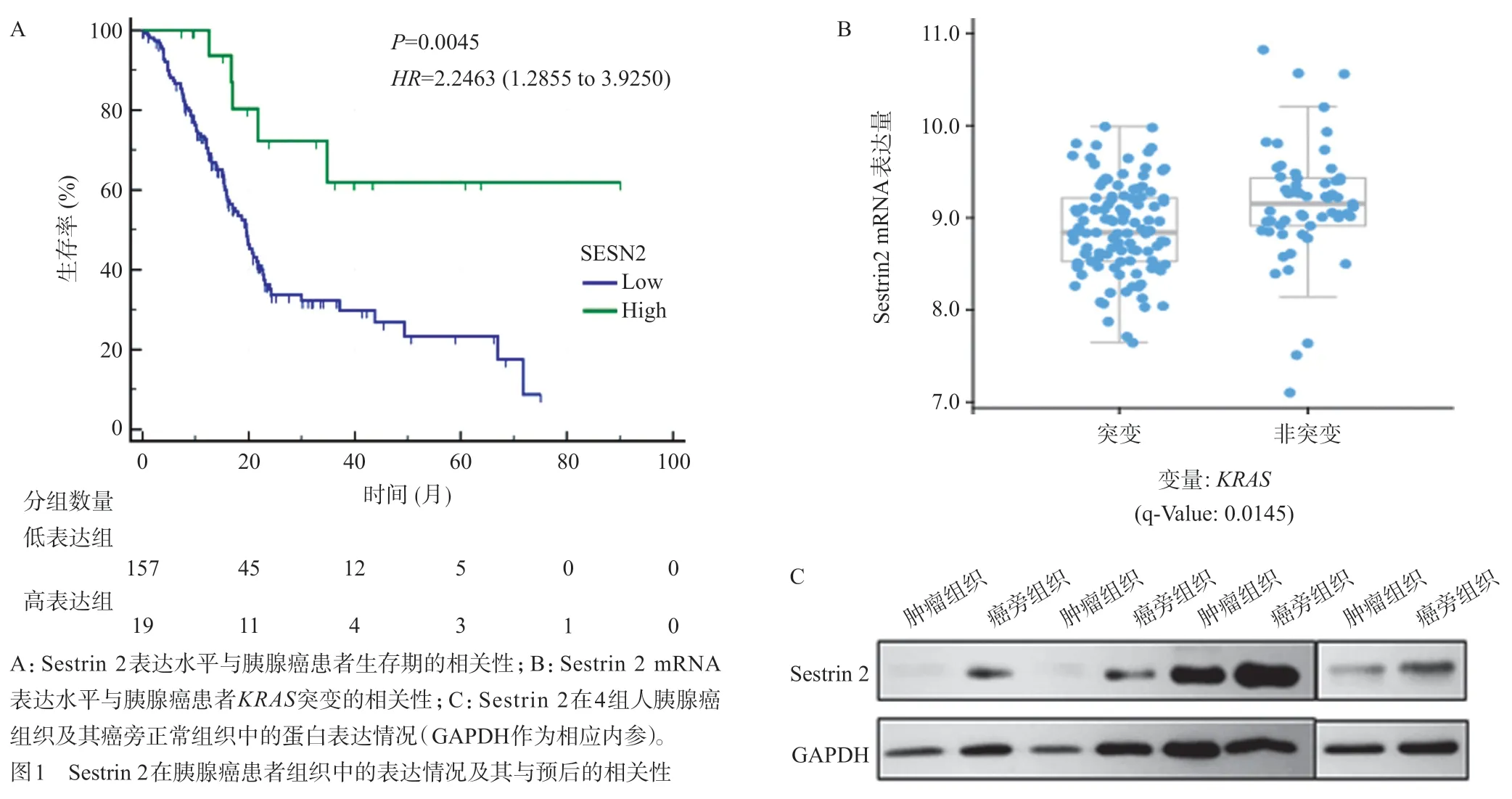
图1 Sestrin 2在胰腺癌患者组织中的表达情况及其与预后的相关性
2.2 Sestrin 2与胰腺癌细胞转移及侵袭能力密切相关
上述结果初步表明Sestrin 2 与胰腺癌之间存在密切相关性。紧接着,我们通过构建不同Sestrin 2表达量的胰腺癌细胞模型,检测在干预Sestrin 2 表达量的情况下,胰腺癌细胞转移侵袭能力变化。结果显示,低表达Sestrin 2的CFPAC-1胰腺癌细胞和低表达Sestrin 2的PANC-1胰腺癌细胞均呈现较强的迁移能力(图2A),而过表达Sestrin 2的相关胰腺癌细胞迁移能力降低(图2B)。同时,通过Transwell侵袭试验,结果显示低表达Sestrin 2 的胰腺癌细胞侵袭能力增强(图3A),而高表达Sestrin 2的胰腺癌细胞侵袭能力降低(图3B)。综上所述,Sestrin 2能抑制胰腺癌的转移侵袭能力。

图3 Sestrin 2调节胰腺癌细胞系的细胞侵袭能力。分别对正常胰腺癌细胞和转染阳性慢病毒细胞的侵袭能力进行检测,并在0 h和48 h进行拍摄(×400)。

图2 Sestrin 2调节胰腺癌细胞系的细胞迁移能力。分别对正常胰腺癌细胞、转染对应阴性慢病毒对照细胞和转染阳性慢病毒细胞的划痕迁移能力进行检测,并在0 h和48 h进行拍摄(×80)。
2.3 Sestrin 2与胰腺癌细胞增殖能力密切相关
本研究通过动物皮下负瘤实验检测不同Sestrin 2 表达水平下胰腺癌细胞的增殖能力。通过构建不同Sestrin 2表达量的CFPAC-1胰腺癌细胞和PANC-1胰腺癌细胞动物皮下负瘤模型,结果显示,敲减Sestrin 2 后的胰腺癌细胞在裸鼠中生长增殖的肿瘤最大,而过表达Sestrin 2组别的瘤体较小(图4),这表明Sestrin 2能抑制胰腺癌的增殖。

图4 Sestrin 2调节胰腺癌细胞系的细胞增殖能力。分别对CFPAC-1和PANC-1胰腺癌细胞进行Sestrin 2敲减与过表达,相应模型细胞动物皮下负瘤实验。
2.4 Sestrin 2与胰腺癌EMT密切相关
随后我们深入探索Sestrin 2 和胰腺癌EMT之间的关系。我们通过在改变Sestrin 2 表达量的情况下,观察E-钙黏蛋白、N-钙黏蛋白和波形蛋白这三个EMT主要标志物的表达量变化。结果显示,当Sestrin 2 表达量降低时,E-钙黏蛋白的蛋白质表达水平(图5E,表2)和mRNA水平(图5A,图5B)均降低,而当Sestrin 2过表达时,E-钙黏蛋白表达水平升高(图5C,图5D,图5F,表3)。相应地,N-钙黏蛋白和波形蛋白的相关表现与E-钙黏蛋白呈相反的变化。这表明,Sestrin 2 在胰腺癌中起着抑制胰腺癌EMT进程的作用。
2.5 Sestrin 2在胰腺癌中可能通过mTOR信号通路调节EMT进程
以往的研究表明,PI3K-AKT-mTOR信号通路激活可触发EMT过程,我们通过观察mTOR信号通路的关键下游分子p70S6k表达量变化来观察mTOR信号通路的变化。结果显示,当Sestrin 2表达量下调后,p70-s6k的表达水平升高(图5A,图5B,图5E,表2),而当Sestrin 2表达上调时,p70-s6k的表达水平下降(图5C,图5D,图5F,表3)。Sestrin 2过表达时所得结果与Sestrin 2被敲减时的结果相反。因此,我们初步得出结论:Sestrin 2通过mTOR/p70s6k途径调控胰腺癌细胞的EMT进展。
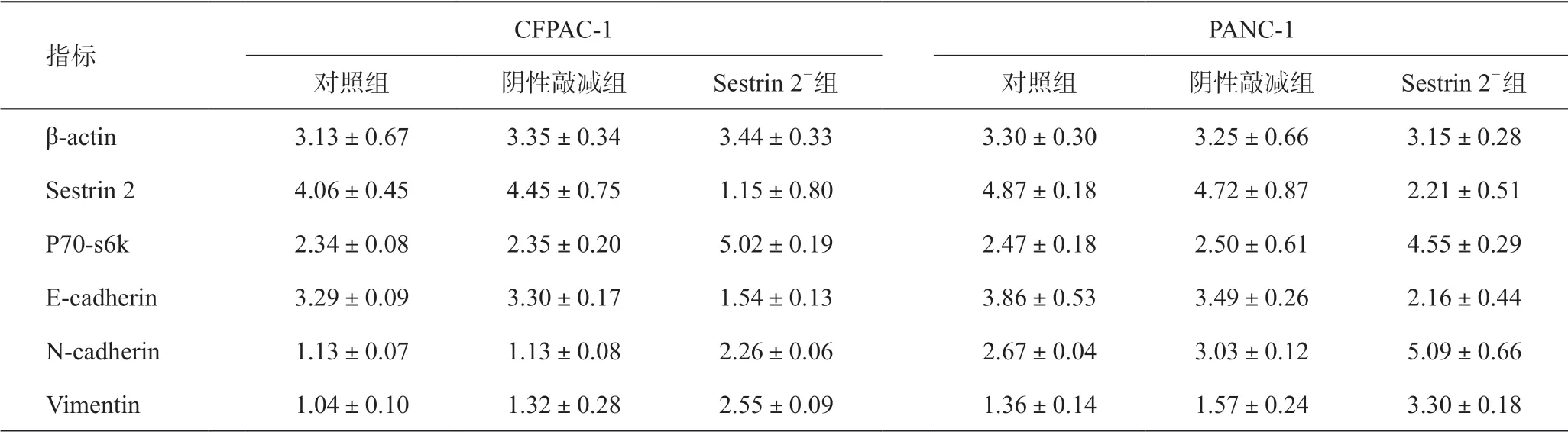
表2 不同胰腺癌细胞Sestrin 2敲减模型中相应指标蛋白条带灰度值变化(×10 000)

表3 不同胰腺癌细胞Sestrin 2过表达模型中相应指标蛋白条带灰度值变化(×10 000)
3 讨论
虽然目前对于胰腺癌的研究已经较为深入,但关于胰腺癌的手术治疗和化疗的效果仍不甚满意,其病死率仍居高不下[1-2]。在如胰腺癌等肿瘤发生发展进程中,会有很多因素(如肿瘤微环境、miRNA、基因突变等)多方面地影响肿瘤的发展进程,因此通过深入研究肿瘤的发生发展机制,进而从不同环节介入干预肿瘤的恶化进程,这将对肿瘤的相关治疗产生巨大帮助[14-17]。本研究主要通过研究上皮-间质转化(EMT)进程在胰腺癌中的作用来研究胰腺癌的生物学行为。
研究表明,EMT主要影响细胞的侵袭和迁移能力[18-20],当肿瘤细胞EMT进程得到促进,其癌症细胞的转运能力变强,进而在宏观上表现为癌症容易全身转移扩散,从而加剧了肿瘤的治疗难度[20-22]。相比较正常细胞,肿瘤细胞的E-钙黏蛋白的表达水平降低,而N-钙黏蛋白和波形蛋白的表达水平升高。因此,在肿瘤的发生发展过程中,抑制或逆转EMT进程对帮助肿瘤患者抑制疾病、治疗疾病等均起着重要作用。
Sestrin 2 的表达水平与肿瘤的发生发展密切相关,同时其能协同mTOR信号通路维持上皮细胞稳态。然而Sestrin 2 在胰腺癌的发生发展过程中尚无相关研究。本研究通过构建不同Sestrin 2 表达水平的人胰腺癌细胞模型,探索Sestrin 2与胰腺癌EMT之间的关系并观察潜在的分子机制。我们发现,随着Sestrin 2 表达水平的升高,胰腺癌细胞的转移侵袭能力降低,增殖能力也被抑制,E-钙黏蛋白的表达水平升高,而N-钙黏蛋白和波形蛋白的表达水平降低。基于上述结果,我们推测Sestrin 2可能通过抑制胰腺癌的EMT进程来抑制胰腺癌的恶性进程。
同时,mTOR信号通路作为肿瘤发生发展过程中的“明星”信号通路,其几乎在所有肿瘤中表现为激活状态[23-24]。而Sestrin 2作为mTORC1的抑制剂,对mTOR信号通路有着显著的抑制作用。本研究显示,随着Sestrin 2表达水平的升高,mTOR信号通路的关键通路分子p70-s6k呈显著抑制状态。结合EMT的相关结论,我们推测,Sestrin 2通过抑制mTOR信号通路进而抑制胰腺癌EMT过程,从而达到抑制胰腺癌相关恶性生物学行为的作用。
本研究我们主要研究了Sestrin 2 在胰腺癌发生发展和EMT过程中所扮演的作用,了解了Sestrin 2起着抑制胰腺癌发生发展的作用。在胰腺癌的恶变过程中,Sestrin 2 的表达量被抑制,这导致胰腺癌侵袭、转移等生物学行为不被抑制,最终导致胰腺癌患者的极速恶化。假如我们能有效地定向诱导Sestrin 2表达,这将有效的抑制胰腺癌的恶化进程,故继续深入研究Sestrin 2 在胰腺癌发生发展进程中的具体机制将对胰腺癌的相关靶向治疗产生巨大的临床应用价值。
4 结论
综上所述,我们得出初步结论:Sestrin 2 可能通过抑制mTOR信号通路抑制胰腺癌EMT进程,从而起到抑制胰腺癌转移侵袭等恶性生物学行为。本研究不仅建立了不同Sestrin 2 表达水平的胰腺癌细胞模型,更是丰富了Sestrin 2在胰腺癌EMT进程和mTOR信号通路中的相关研究。