邻氨基苯甲酸抑制TRPM2 通道对脑缺血再灌注损伤小鼠神经功能及小胶质细胞活化的影响
仇莽莽 , 焦 岩 , 王芳姣 , 张 燕 , 郑乐怡 , 马 康 , 梁雪云 ,文玉军 , 余建强 , 何仲义 , 牛建国 ,
(1.宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004; 2.宁夏医科大学 宁夏颅脑疾病重点实验室,银川 750004; 3.宁夏医科大学总医院干细胞研究所,银川 750004; 4.宁夏医科大学宁夏特色中医药协同创新中心,银川 750004)
脑缺血是中枢神经系统最常见的疾病之一[1],通常由脑内动脉栓塞造成局部供血障碍引起,可导致脑细胞坏死或凋亡等[2-3]。恢复缺血区的血液再灌注是脑缺血的最佳治疗方法,而缺血后血流的再通可导致脑缺血再灌注损伤[4]。探索有效预防脑缺血再灌注损伤的治疗方法仍是目前临床亟待解决的问题。脑缺血再灌注损伤发病机制复杂,炎性反应是其主要病理过程之一,减轻脑缺血再灌注后继发性炎性反应受到人们的广泛关注[5]。当脑缺血再灌注损伤发生后,静息态的小胶质细胞被激活,活化的小胶质细胞通过过度释放炎症因子、蛋白及其他生物活性分子介导炎性反应,引起继发性脑损伤[6]。瞬时受体电位通道M2(transient receptor potential cation channel subfamily member2,TRPM2)是一种非选择性的可通透钙离子的阳离子通道[7],研究[8-10]表明,TRPM2可能与小胶质细胞的活化和炎症因子的分泌有关。N-(对戊基肉桂酰基)邻氨基苯甲酸[N-(pamylcinnamoyl)anthranilic acid,ACA]为 TRPM2非选择性离子通道抑制剂[11],可电压非依赖性地抑制TRPM2 通道。目前抑制TRPM2 通道对脑缺血再灌注损伤影响的研究较少。本研究拟利用小鼠脑缺血再灌注损伤模型,探讨ACA 抑制TRPM2对脑缺血再灌注损伤的作用及其可能的机制。
1 材料与方法
1.1 实验动物
SPF 级 C57BL/6N 雄性小鼠 48 只,体质量 18~22 g,由宁夏医科大学实验动物中心提供,购买于北京维通利华实验动物技术有限公司[合格证号SCXK(京)2016-0006]。小鼠放置在安静环境下饲养,自由摄食和饮水。
1.2 主要试剂及仪器
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazoliumchloride,TTC)购自美国 Sigma 公司,TRPM2 通道抑制剂ACA 购自中国MCE(MedChem-Express),牛血清白蛋白(bovine serum albumin,BSA)购自北京索莱宝科技有限公司,HE、Nissl染色试剂盒购自北京索莱宝科技有限公司,山羊抗离子钙结合衔接分子 1(Iba1)多克隆抗体(ab48004)、小鼠抗诱导型一氧化氮合酶(iNOS)单克隆抗体[EPR16635]-Chimeric(ab210823)均购自美国 Abcam 公司,Cy3AffiniPureDonkeyAnti-Goat-IgG(H+L)、Cy5AffiniPureDonkeyAnti-MouseIgG(H+L)均购自美国Jackson 公司,肿瘤坏死因子-α(TNF-α)酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)试剂盒购自中国博士德生化科技有限公司。激光散斑血流成像仪购自瑞典帕瑞医学公司,线栓购自中国北京西浓科技有限公司,体式显微镜购自中国深圳市瑞沃德生命科技有限公司,全波长酶标仪购自美国热电公司,冰冻切片机购自德国莱卡公司。
1.3 动物分组
48 只雄性C57BL 小鼠随机分为3 组。假手术组(Sham):麻醉小鼠后,游离左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)及颈内动脉(internal carotid artery,ICA)后,逐层缝合。大脑中动脉栓塞再灌注组(middle cerebral artery occlusion/reperfusion,MCAO/R):建立 MCAO/R 模型;ACA 组:建立MCAO/R 模型后,腹腔注射ACA。每组16 只。
1.4 方法
1.4.1 小鼠脑缺血再灌注损伤模型的建立 采用3.5%的水合氯醛麻醉小鼠后,分离CCA,沿CCA 向远心端游离ECA、ICA,活结结扎CCA。在ECA(远离CCA 处)与ICA 交叉处剪小口,将线栓从小口处插入至CCA 近心端,将线栓反转180°与 CCA 平行,接着将线栓插入 ICA 约 1 cm 至有阻力时将线栓固定后剪断多余线栓。逐层缝合后,将小鼠放在37 ℃恒温毯上至其苏醒。1 h 后拔出线栓,小鼠MCAO/R 模型完成。
1.4.2 Bederson 评分评估小鼠神经功能 脑缺血再灌注损伤模型建立1 h 及24 h 后,采用Bederson 评分评估各组小鼠神经功能。0 分:无神经功能缺损;1 分:优先向一侧转弯;2 分:环形转圈;3 分:偏向一侧纵向倾倒;4 分:小鼠无运动;5分:小鼠死亡。本实验采用双盲进行评分。将MCAO/R1 h 后Bederson 评分为2 分的模型纳入后续实验。
1.4.3 给药方法 ACA 组于小鼠脑缺血后约2 h腹腔注射 ACA(25 mg·kg-1)。ACA 用 0.5%的二甲基亚砜(dimethyl sulphoxide,DMSO)新鲜配制。MCAO/R 组腹腔注射0.5%的DMSO。
1.4.4 小鼠大脑皮质脑血流测定 在MCAO/R模型建立24 h 后,麻醉小鼠,剔去小鼠颅脑顶骨部鼠毛,切开皮肤,完全暴露骨膜,并在骨膜上滴加少量生理盐水,将激光散斑血流成像仪扫描器调至小鼠脑正上方处,监测大脑皮质脑血流变化,记录并分析数据。局部脑血流减少率=(ROI1-ROI2)/ROI1×100%(ROI1 表示右侧脑血流量;ROI2 表示左侧脑血流量)。
1.4.5 TTC 染色检测小鼠脑梗死率 在MCAO/R模型建立24 h 后,将各组小鼠断头迅速取出新鲜大脑。用生理盐水冲洗,放入预冷的脑槽中,在-20 ℃冰箱速冻5~8 min,将小鼠大脑冠状切成厚度为2 mm 的脑片5 片,按顺序放入已加入TTC 的反应槽中,在37 ℃孵育箱中孵育12 min,弃掉TTC 溶液,加入4%多聚甲醛溶液,4 ℃过夜,后将脑片按顺序摆放在刻度板上拍照。用Image-Proplus 软件测梗死面积(A)和脑片的总面积(B),脑梗死率=(A1+A2+…+An)/(B1+B2+…+Bn)×100%(公式为最简式,以抵消分子分母所乘的厚度 2 mm)。
1.4.6 脑组织灌注、固定、脱水及切片 在MCAO/R 模型建立24 h 后将各组小鼠麻醉,依次使用预冷的0.9%的氯化钠溶液及4%多聚甲醛溶液灌注,断头取出完整大脑后放置于预冷的4%多聚甲醛溶液中,4 ℃过夜。将脑组织依次转入20%蔗糖溶液及30%蔗糖溶液中进行梯度脱水。冠状冰冻切片,厚度为20 μm。
1.4.7 HE 染色观察小鼠脑组织形态学变化 将冰冻切片在室温条件下复温15 min,4%多聚甲醛中固定5 min,流水冲洗 3 min;苏木素室温浸染 20 min,自来水流水冲洗10 min;分化液分化5 s,流水冲洗2 min;返蓝液返蓝2 min,流水冲洗3 min;伊红染色10 min,流水冲洗7 min;95%乙醇Ⅰ3 s,95%乙醇Ⅱ3 s,100%乙醇Ⅰ3 s;100%乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ中各1 min;透明后用中性树脂封片,室温晾干后正置显微镜拍片。
在中国大陆情境下,国家既直接影响社会工作职业自主性,也通过其他三个层面,即职业、组织、服务使用者的影响间接影响社会工作职业自主性。即在目前语境下,当一线社工面临国家这一层面限制自主性的时候,如何诉诸于职业、组织、服务使用者,获得一种“推力”,以此获得自身发展的独立和自主。作为从事一线服务的社工而言,本身是有自身的能动性,他们对这种复杂情境的反思就是一线社工建构职业自主性的实践策略。
1.4.8 Nissl 染色观察小鼠脑组织神经元丢失情况 将冰冻切片室温复温30 min,用PBS 洗3次,每次 5 min,转入试剂 A(Cresyl violet Stain)染液中,56 ℃浸染 1 h,过水 3 次,每次 2~3 s,后放入试剂 B(Nissl Differentiation)中,孵化 3 min(至低倍镜下透亮,肉眼白底淡紫色),100%乙醇Ⅰ、100%乙醇Ⅱ各1 min,二甲苯Ⅰ5 min、二甲苯Ⅱ中10 min,用中性树脂封片,室温晾干后正置显微镜拍片。
1.4.9 免疫荧光染色检测小鼠脑组织Iba1 与i-NOS 表达 将冰冻切片室温复温15 min,TBS 洗3 次,5 min/次。用 5%BSA 封闭 2 h,分别加入山羊抗 Iba1 多克隆抗体(1∶200)和小鼠抗 iNOS 单克隆抗体(1∶200),4 ℃孵育过夜,TBS 洗 3 次后,分别加入 Cy3 标记驴抗山羊 IgG(H+L)(1∶500)或 Cy5 标记驴抗小鼠 IgG(H+L)(1∶500),室温孵育 3 h,TBS 洗 3 次,10 min/次,用含 DAPI 的抗荧光淬灭封片剂封片,荧光显微镜观察拍照,用图像分析软件Imagine J 分析平均荧光强度。每组取6 只小鼠样本同一区域进行拍照,计算平均荧光强度值,比较组间差异。
1.4.10 ELISA 检测小鼠血清 TNF-α 含量 在MCAO/R 模型建立24 h 后,采用眼眶取血的方法采集各组小鼠血液样本,静置后离心取上层血清。采用ELISA 试剂盒检测TNF-α 含量,具体操作参照说明书方法。
1.5 统计学方法
数据运用SPSS 22.0 统计软件进行分析,计量资料以均数±标准差()表示,组间比较采用单因素方差分析(One-way ANOVA),两两比较采用Dunnett-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 ACA 促进MCAO/R 小鼠神经功能的恢复
与 Sham 组(0.00±0.00)分相比,在脑缺血再灌注损伤 24 h 后,MCAO/R 组小鼠 Bederson 评分[(2.00±0.00)分]升高(P<0.05);在给予 ACA治疗后,ACA 组小鼠 Bederson 评分[(0.83±0.58)分]较 MCAO/R 组降低(P<0.05)。
2.2 ACA 改善了MCAO/R 小鼠大脑皮质脑血流的灌注量
在脑缺血再灌注损伤24 h 后,激光散斑血流成像结果显示,MCAO/R 组小鼠的缺血侧脑血流量减少率[(49.10±4.47)%]较 Sham 组[(2.50±0.42)%]升高(P<0.05),给予 ACA 治疗后,与MCAO/R 组比较,ACA 组小鼠的脑血流量减少率[(24.13±1.49)%]下降(P<0.05),见图 1。
2.3 ACA 可减少MCAO/R 小鼠脑梗死率
TTC 染色结果显示,大脑正常组织被染为红色,脑梗死部分未着色。与Sham 组[(0.00±0.00)%]梗死率相比,MCAO/R 组小鼠脑梗死率[(33.14±6.86)%]增加(P<0.05);与 MCAO/R 组相比,ACA 组脑梗死率[(7.78±3.51)%]降低(P<0.05),见图 2。
2.4 ACA 可减轻MCAO/R 小鼠大脑缺血侧颞侧皮质、海马CA1、CA3 及缺血半暗带区损伤
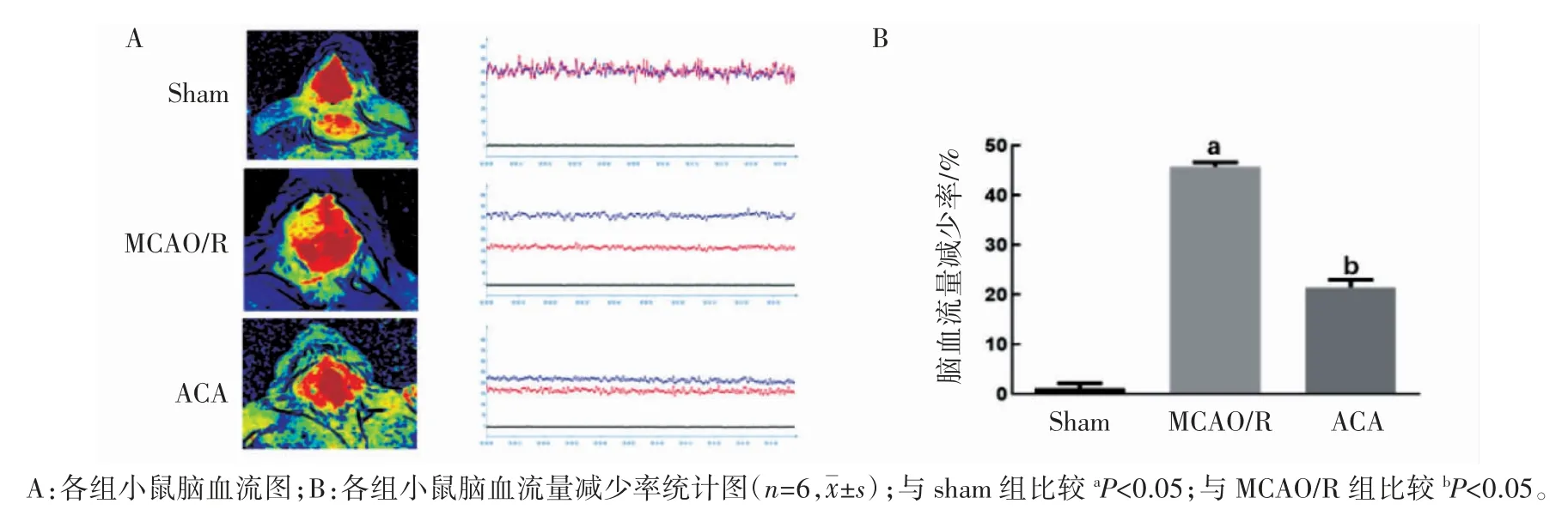
图1 ACA 对MCAO/R 小鼠缺血侧脑血流的影响
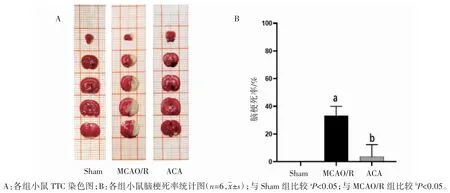
图2 ACA 对MCAO/R 小鼠缺血侧脑梗死率的影响
2.5 ACA 可改善MCAO/R 小鼠缺血侧脑组织神经元的丢失
各组脑冠状切片Nissl 染色结果显示,与Sham 组相比,MCAO/R 组小鼠大脑颞侧皮质、海马CA1、CA3 区及缺血半暗带区神经元数目减少,残留细胞大多表现为核固缩,深染,细胞失去正常结构。与MCAO/R 组比较,ACA 组各区域神经元数量增加,见图4。
2.6 ACA 可减少MCAO/R 小鼠小胶质细胞的活化
脑缺血再灌注损伤24 h 后,免疫荧光染色方法观察Iba-1 表达水平,选取缺血半暗带区域观察,Sham 组阳性细胞胞体较小,突起细小,而MCAO 组阳性细胞胞体明显变大,突起变粗。结果显示,MCAO/R 组小鼠 Iba-1 免疫荧光强度(98.34±8.71)较 Sham 组免疫荧光强度(35.59±10.54)升高(P<0.05),与 MCAO/R 组相比,给予ACA 治疗后小鼠Iba-1 免疫荧光强度(86.02±8.32)减少(P<0.05),见图 5。
2.7 ACA 可减少MCAO/R 小鼠损伤区iNOS 表达
对脑缺血再灌注损伤24 h 后脑片进行免疫荧光iNOS 染色,选取缺血半暗带区域观察ACA对MCAO/R 小鼠iNOS 表达的影响。结果显示,MCAO/R 组小鼠大脑皮质区域iNOS 免疫荧光强度(75.73±6.94)较 Sham 组免疫荧光强度(30.77±1.91)升高(P<0.05),而给予 ACA 治疗后免疫荧光强度(37.86±5.98)减少(P<0.05),见图 6。
2.8 ACA 可下调 MCAO/R 小鼠血清 TNF-α 水平
ELISA 结果显示,MCAO/R 组小鼠血清TNF-α 水平[(9.99±1.03)pg·mL-1]较 Sham 组[(1.59±0.20)pg·mL-1]升高(P<0.05),与 MCAO/R 相比,给予 ACA 治疗后血清 TNF-α 水平[(5.26±4.00) pg·mL-1]降低(P<0.05)。
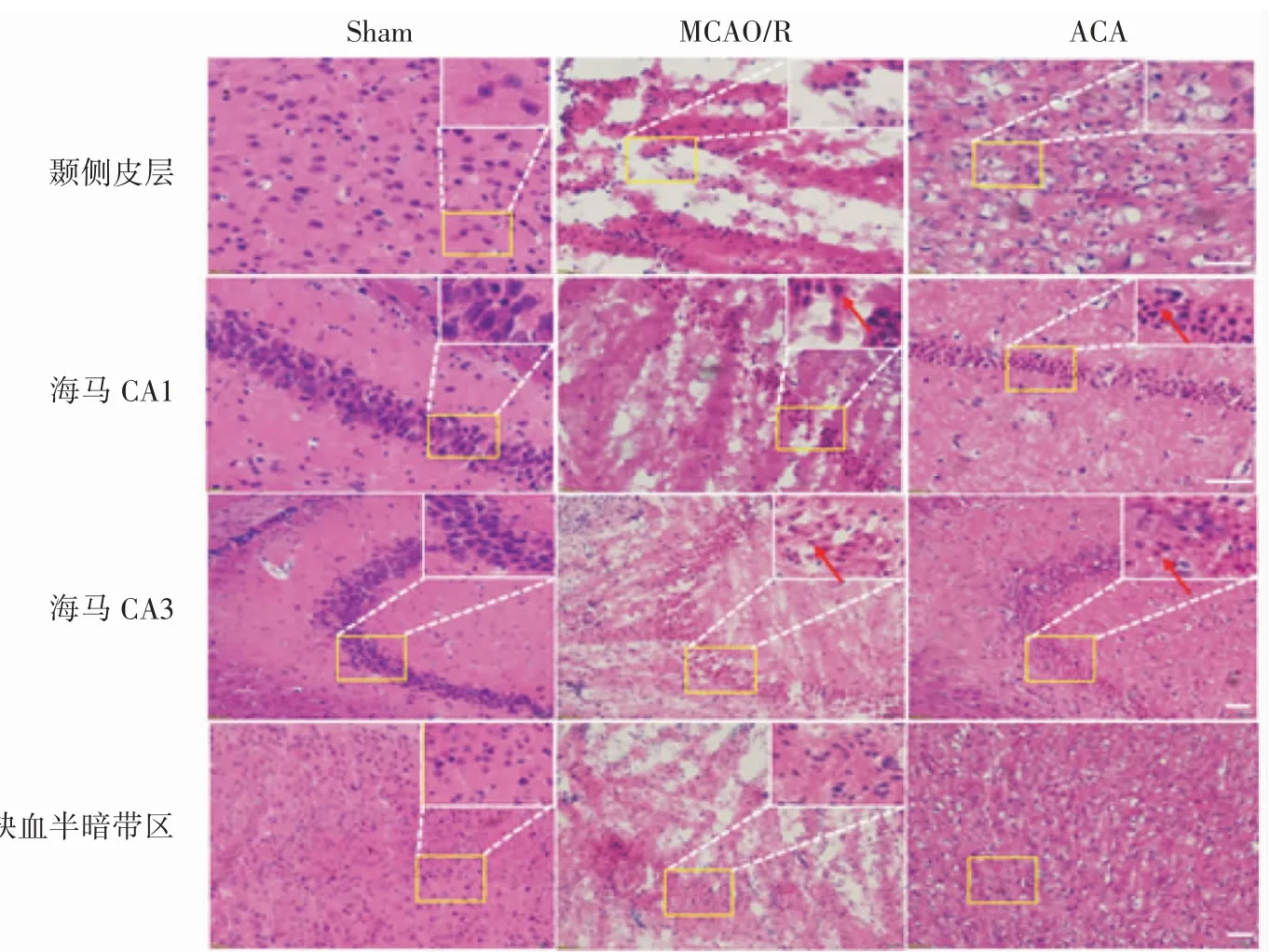
图3 ACA 对MCAO/R 小鼠缺血侧不同区域形态学的影响(↑:嗜酸性粒细胞;bar=50 μm)
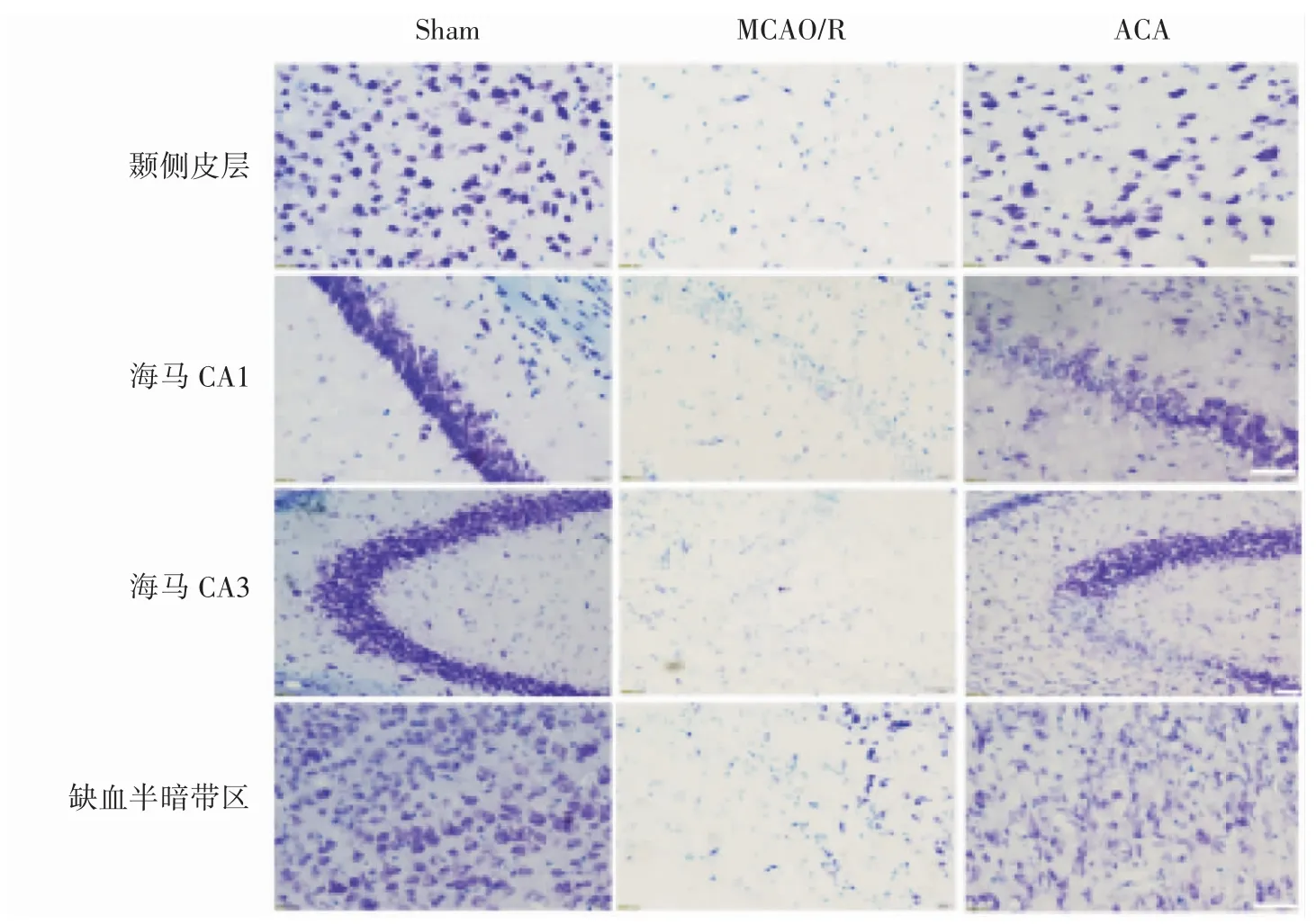
图4 ACA 对MCAO/R 小鼠缺血侧脑组织神经元的影响(bar=50 μm)
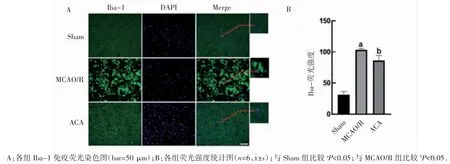
图5 ACA 对MCAO/R 小鼠脑缺血侧Iba-1 表达的影响
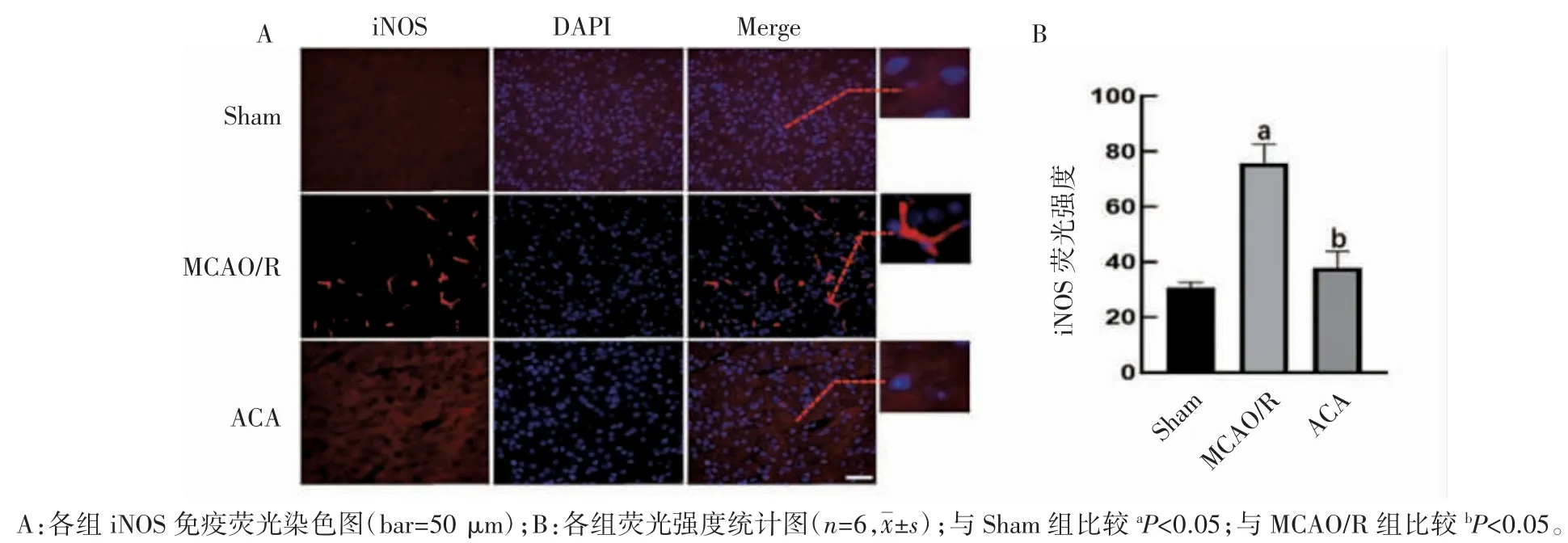
图6 ACA 对MCAO/R 小鼠缺血侧iNOS 表达的影响
3 讨论
本实验采用线栓法建立MCAO/R 模型[12],TTC 染色显示,MCAO/R 模型均出现一致的白色梗死区域,同时,模型建立后,激光散斑血流成像结果显示,MCAO/R 模型小鼠缺血侧脑血流降低,HE 染色显示脑组织形态学的损伤,Nissl 染色呈现出神经元的丢失,结果均证明本实验中脑缺血再灌注模型建立成功。
TRPM2 作为一种活性氧的感受器,参与了一系列的生理病理过程[13]。ACA 可以从胞外以电压非依赖、浓度依赖的方式抑制TRPM2 通道[14]。本文观察了ACA 对脑缺血再灌注小鼠的行为学影响,结果显示,ACA 促进了脑缺血再灌注损伤后小鼠神经功能的恢复。同时,激光散斑血流成像结果显示,ACA 干预24 h 后,小鼠缺血侧脑血流量增加;TTC 染色结果显示,ACA 组小鼠脑梗死率较MCAO/R 组下降;HE 及 Nissl 染色结果发现,ACA 组缺血侧颞侧皮质区、海马CA1、CA3及缺血半暗带区组织结构改善,炎性细胞减少,神经元数目增加。上述结果均证明ACA 对小鼠脑缺血再灌注损伤具有改善作用。
当脑缺血再灌注损伤发生后,静息态的小胶质细胞被激活,活化的小胶质细胞通过过度释放炎症因子、蛋白及其他生物活性分子而介导炎性反应,引起继发性脑损伤[15-16]。抑制小胶质细胞活化已被认为是减轻脑缺血再灌注损伤的治疗方向[17-19]。小胶质细胞内钙离子(Ca2+)的水平控制着多种细胞过程,包括小胶质细胞的激活以及促炎因子和抗炎因子的分泌[20-21]。TRPM2 可调控细胞内Ca2+的稳态[13],有研究[8]报道,在短暂性大脑中动脉梗塞损伤模型中,小胶质细胞中TRPM2mRNA表达上调;过氧化氢和二磷酸腺苷核糖诱导小胶质细胞的Ca2+内流和TRPM2 阳离子电流升高[9]。以上发现均表明,TRPM2 与小胶质细胞的功能密切相关。Iba-1 为小胶质细胞表面标志性蛋白,常被作为小胶质细胞的标记物。当脑缺血再灌注后,小胶质细胞形态变大、突起变粗,Iba-1的表达量上调,小胶质细胞明显活化[18]。使用ACA后,小胶质细胞活化程度受到了抑制。因此推断,抑制TRPM2 可能抑制小胶质细胞的活化。
炎性反应是脑缺血再灌注损伤的主要病理过程之一,因此如何减轻脑缺血再灌注后继发性炎性反应受到广泛关注。有研究[10]显示,TRPM2可促进多种促炎介质如TNF-α 和白细胞介素-6(interleukin-6,IL-6)的分泌增加。脑缺血后外周免疫细胞中TRPM2 被激活,可促进炎性反应,加重缺血性脑损伤[22]。Wehrhahn 等[23]报道,暴露于脂多糖的单核细胞中TRPM2 的表达增加,诱导产生促炎细胞因子如IL-6、IL-8 和TNF-α,加重炎性反应。本实验探讨了ACA 对MCAO/R 小鼠的炎症相关因子iNOS 及TNF-α 表达水平的影响,结果显示,ACA 治疗后可降低缺血再灌注损伤后脑组织中iNOS 表达及血清TNF-α 水平。
综上所述,小鼠脑缺血再灌注后,ACA 抑制TRPM2 通道对脑缺血再灌注损伤小鼠具有保护作用,其机制可能与ACA 抑制小胶质细胞活化并降低炎性因子的分泌有关。ACA 抑制TRPM2通道如何介导小胶质细胞活化并介导炎症通路,还需进一步研究。本研究结果初步表明TRPM2可能成为脑缺血再灌注损伤治疗的潜在靶点之一。

