棕榈酸联合TGF-β1 诱导脂肪性肝纤维化细胞模型
梁涵子 , 李雨涵 , 李家瑞 , 李建宁 , 宋 辉 , 杨 怡
(1.宁夏医科大学基础医学院生物化学与分子生物学系,银川 750004; 2.宁夏医科大学内分泌学研究所,银川 750004; 3.宁夏医科大学基础医学院细胞生物学与遗传学系,银川 750004)
肝纤维化是指因各种慢性肝损伤引起的肝脏内弥漫性细胞外基质(extracellular matrix,ECM)过度沉积,导致肝脏结构和肝功能异常轻度改变的病理过程。目前研究[1]认为,肝纤维化的发病机制主要是在各种损肝因素作用下,组织发生修复时ECM 合成与降解失衡。近年来,随着生活方式的改变,肥胖患者比例大幅度上升,进而导致代谢性肝病发病率迅速增加[2-3],脂肪性肝病进一步发展而来的脂肪性肝炎、肝纤维化等已成为肝癌进一步发展、恶化的重要环节[4]。而肝纤维化作为一种可逆性疾病,给予病因消除并经适当的治疗,其纤维化是可以逐渐被吸收的[5]。由于目前对于脂肪性肝纤维化的发病机制缺乏明确的认识,从而限制了治疗方式的选择。因此,探究脂肪性肝纤维化的发病机制能够为临床脂肪性肝纤维化的治疗提供新的理论基础。
目前认为,肝星状细胞仍是各种临床和实验性肝纤维化模型中肌成纤维细胞(MFs)的主要来源[6]。在肝纤维化疾病进展中,HSCs 发挥着重要作用,HSCs 的活化、增殖及分化是纤维化发生的中心环节[7]。因此研究多集中于以肝星状为靶细胞,利用转化生长因子-β1(TGF-β1)建立肝纤维化模型,从而研究肝纤维化的作用机制[8-9]。但是这种方式并不能完全模拟脂肪性纤维化,为了探究脂肪性肝纤维化的发病机制,本研究选用棕榈酸(palmitic acid,PA)及 TGF-β1 作为诱导手段,分别给予人肝星状细胞(LX-2)及人肝癌细胞(HepG2)不同浓度的 PA 及 TGF-β1 诱导,构建脂肪性肝纤维化细胞模型,以期为后续探究脂肪性肝纤维化疾病的分子机制及治疗手段提供模型基础。
1 材料与方法
1.1 材料与试剂
LX-2 细胞购自上海中乔新舟细胞库;HepG2细胞购自北京肿瘤细胞库;胎牛血清购自美国Gibco 公司(10099-141);DMEM 高糖培养基购自Hyclone 公司(SH30022);PA(P5585)和油红 O染液(O1391)购自美国 Sigma 公司;TGF-β1 购自PEPROTECH 公司;cDNA 反转录试剂盒及qRTPCR 试剂盒购自 TaKaRa 公司;α-SMA(#19245)与 CollagenⅠ(#39952)抗体购自 Cell Signaling Technology 公司,GAPDH 抗体(10494-1-AP)购自PEPROTECH 公司。
1.2 方法
1.2.1 细胞培养 LX-2 细胞、HepG2 细胞以适当密度接种于培养瓶中,使用含有10%胎牛血清,100 U·mL-1青霉素及 100 U·mL-1链霉素的 DMEM培养基,于37 ℃,5% CO2培养箱中进行培养。
1.2.2 主要试剂配方 ①重组人 TGF-β1:将TGF-β1 粉末用10 mmol·L-(1pH 3.0)的柠檬酸钠试剂溶解至 0.5 mg·mL-1,再使用 0.1%BSA 溶液稀释至终浓度为10 ng·mL-1的储备液,分装后于-20 ℃保存。使用时,通过DMEM 完全培养液稀释成为 2、5、10 ng·mL-1的终浓度。②PA 工作液:0.25 g PA,加入1 mL 无水乙醇在热水浴中助溶,用 500 mmol·L-1NaOH 调节 pH 至 7.4,用0.22 μmo·lL-1微孔滤膜除菌后分装,-20 ℃保存。使用时,通过DMEM 完全培养液稀释成为100、200 及 400 μmol·L-1的终浓度。
1.2.3 实验分组 选用 100、200、400 μmol·L-1PA分别诱导LX-2 细胞及HepG2 细胞,选用 2、5、10 ng·mL-1TGF-β1 分别诱导 LX-2 细胞及 HepG2细胞,两种诱导方式均诱导24 h。
1.2.4 MTT 实验检测细胞存活率 将LX-2 细胞、HepG2 细胞分别接种于96 孔板,密度为1×104/孔,分别给予不同浓度PA 及TGF-β1 诱导24 h,随后利用MTT 检测试剂盒检测细胞存活率。计算细胞存活率,细胞存活率=(实验组A 值-空白调零A 值)(/对照组A 值-空白调零A 值)×100%。
1.2.5 油红O 染色法检测脂滴含量 分别接种两种细胞于6 孔板内,密度为2×105/孔,分别给予不同浓度PA 及TGF-β1 诱导24 h 后,使用预冷的PBS清洗3 次,4%多聚甲醛固定细胞10 min,每孔滴加油红 O 染液 1 mL,室温反应 10~15 min,65%的异丙醇快速脱色,使用苏木素染核30 s 后用蒸馏水冲洗2~3 次,于倒置显微镜下进行观察。
1.2.6 qRT-PCR 实验检测 α-SMA、CollagenⅠ的mRNA 表达水平 PA 及 TGF-β1 诱导两种细胞后,采用Trizol 法提取细胞内RNA 并将其逆转录为cDNA,通过qRT-PCR 实验检测各组α-SMA 和CollagenⅠ的mRNA 表达水平。引物序列分别为β-Acting:Forward-CATGTACGTTGCTATCCAGG,Reverse-CTCCTTAATGTCACGCACGAT;α-SMA:Forward-CAGGGCTGTTTTCCCATCCAT,Reverse-G CCATGTTCTATCGGGTACTT;CollagenⅠ:Forward-CATGTACGTTGCTATCCAGGC,Reverse-CTCCTT AATGTCACGCACGAT。
1.2.7 Western blot 实验检测 α-SMA、Collagen Ⅰ的蛋白表达水平 分别收集经PA 及TGF-β1 诱导后的 LX-2 细胞和 HepG2 细胞,蛋白制样后,利用10% SDS-PAGE 垂直电泳进行蛋白分离,随后检测α-SMA 及CollagenⅠ的蛋白表达水平,通过Image J 软件分析条带的灰度值,以目标蛋白灰度值与内参GAPDH 灰度值的比值评价蛋白的相对表达量。
1.3 统计学方法
结果采用SPSS 22.0 统计软件进行分析,计量资料以均数±标准差()表示,组间两两比较采用Dunnett-t 检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 TGF-β1 诱导较PA 诱导细胞存活率更高
MTT 结果显示,100、200、400 μmol·L-1PA分别诱导 HepG2 与 LX-2 细胞 24 h 后,细胞存活率出现不同程度降低(P 均<0.01);TGF-β1分别诱导两组细胞24 h 后,细胞存活率在5、10 ng·mL-1TGF-β1 诱导下出现不同程度降低(P均<0.05),见图 1、图 2。
2.2 PA 诱导组细胞内脂滴增多
油红O 染色结果显示,与对照组相比,不同浓度 PA 诱导 24 h 后,HepG2、LX-2 细胞均随PA 浓度的增大,脂滴形成增多,具有明显的浓度依赖性。不同浓度TGF-β1 诱导24 h 后,HepG2组细胞内未见明显脂滴;2、5 ng·mL-1TGF-β1 诱导后 LX-2 细胞内可见少量脂滴,10 ng·mL-1TGF-β1 诱导后可见LX-2 细胞内脂滴明显增多,见图 3、图 4。
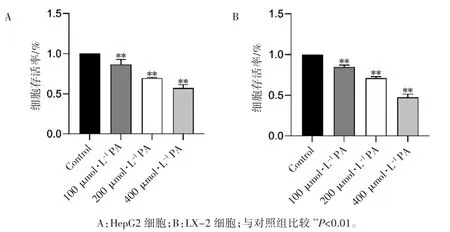
图1 MTT 分析PA 对HepG2 细胞与LX-2 细胞存活率的影响
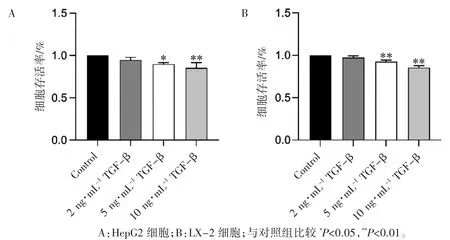
图2 MTT 分析TGF-β1 对HepG2 细胞与LX-2 细胞存活率的影响

图3 油红O 染色法显示不同浓度PA 对HepG2、LX-2 细胞内脂滴形成的诱导效应(×400)

图4 油红O 染色法显示不同浓度TGF-β1 对HepG2、LX-2 细胞内脂滴形成的诱导效应(×400)
2.3 PA 与 TGF-β1 诱导两种细胞内 α-SMA、CollagenⅠ的mRNA 表达增加
qRT-PCR 结果显示,200、400 μmol·L-1PA组诱导 HepG2 细胞内α-SMA、CollagenⅠmRNA相对表达水平均上调(P 均<0.05);200 μmol·L-1PA 诱导LX-2 细胞内CollagenⅠ mRNA 相对表达水平上调(P<0.01),400 μmol·L-1PA 诱导LX-2细胞内α-SMA、CollagenⅠmRNA 相对表达水平均上调(P 均<0.01);10 ng·mL-1TGF-β1 诱导HepG2 组细胞内α-SMA、CollagenⅠmRNA 相对表达水平均上调(P 均<0.05);5、10 ng·mL-1TGF-β1 诱导LX-2 细胞内 α-SMA、CollagenⅠmRNA 相对表达水平均上调(P 均<0.01),见图 5、图 6。
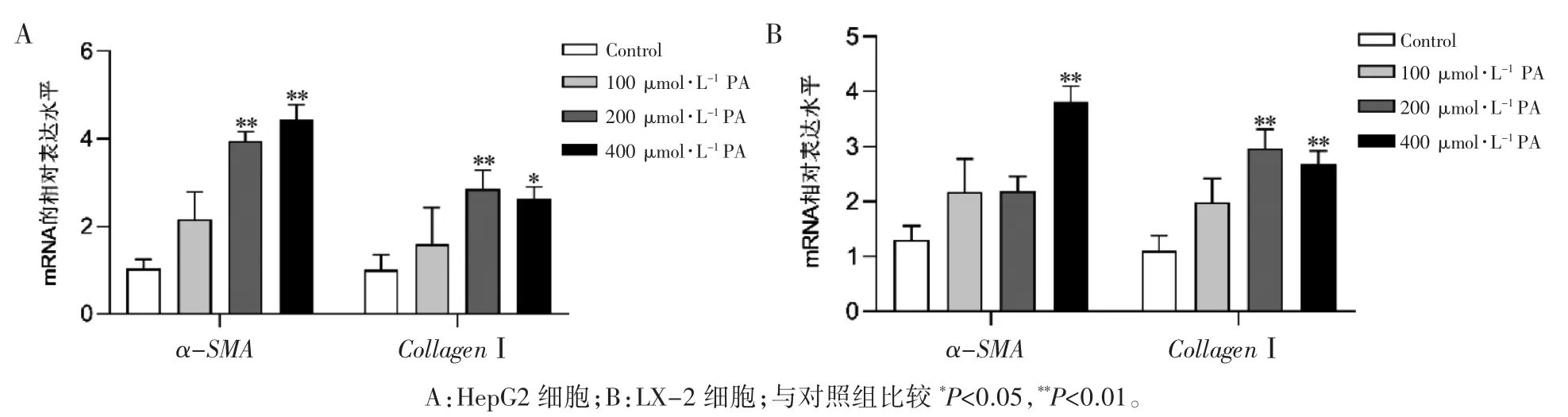
图5 qRT-PCR 检测不同浓度PA 诱导24 h 后α-SMA、CollagenⅠ mRNA 的相对表达水平

图6 qRT-PCR 检测不同浓度TGF-β1 浓度诱导后两组细胞内α-SMA、CollagenⅠ mRNA 的相对表达水平
2.4 PA 与 TGF-β1 诱导两种细胞内 α-SMA、CollagenⅠ蛋白表达增加
Western blot 结果显示,200、400 μmol·L-1PA组诱导HepG2 细胞内α-SMA 及CollagenⅠ的蛋白相对表达水平均升高(P 均<0.05);400 μmol·L-1PA 诱导LX-2 细胞内CollagenⅠ蛋白相对表达水平升高(P<0.01);2、5、10 ng·mL-1TGF-β1 组诱导HepG2 细胞内α-SMA 蛋白相对表达水平均升高(P 均<0.05),10 ng·mL-1TGF-β1 组诱导HepG2 细胞内CollagenⅠ蛋白相对表达水平升高(P<0.05);2 ng·mL-1TGF-β1 组诱导 LX-2 细胞内CollagenⅠ蛋白相对表达水平升高(P<0.01),5、10 ng·mL-1TGF-β1 组诱导 LX-2 内 α-SMA及CollagenⅠ的蛋白相对表达水平均升高(P 均<0.01),见图 7~图 10。
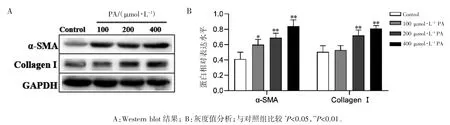
图7 Western blot 检测不同浓度PA 诱导HepG2 细胞24 h 后α-SMA 及Collagen Ⅰ的蛋白相对表达水平
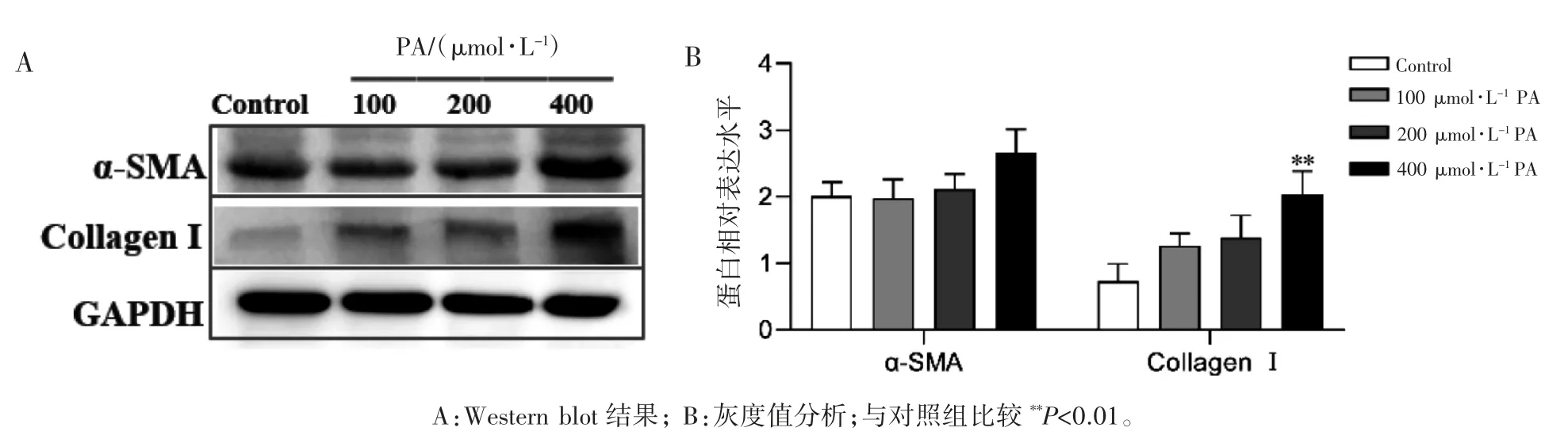
图8 Western blot 实验检测不同浓度PA 诱导LX-2 细胞24 h 后α-SMA 及Collagen Ⅰ的蛋白相对表达水平

图9 Western blot 检测不同浓度TGF-β1 诱导HepG2 细胞24 h 后α-SMA 及CollagenⅠ的蛋白相对表达水平

图10 Western blot 检测不同浓度TGF-β1 诱导LX-2 细胞24 h 后α-SMA 及Collagen Ⅰ的蛋白相对表达水平
3 讨论
目前,非酒精性脂肪肝病(NAFLD)、非酒精性脂肪性肝炎(NASH)的患病率在全球范围内呈上升趋势,据统计,全球24%左右的人口患有NAFLD[10],我国成年人中NAFLD 的患病率高达15%[11],而脂肪肝纤维化是NASH 进展为终末期肝病的重要阶段,晚期肝纤维化最终可导致肝硬化和肝功能衰竭,然而目前除了肝移植外没有其他更有效的治疗策略[12]。因此,预防肝纤维化是阻止该病进展和预后的关键。
肝纤维化作为一种复杂的肝脏疾病,其具体发病机制尚未完全阐明,一般认为遗传因素、环境因素、脂质代谢异常、氧化应激和脂质过氧化损伤、免疫反应损害等可能参与了其发病。脂质代谢紊乱作为重要的致病因素,对于NAFLD、NASH以及肝细胞癌的进展发挥着重要的作用[13]。肝纤维化作为肝脏疾病恶化的关键阶段,其发生、发展中脂质代谢的变化目前尚不清楚,进而限制了由NAFLD、NASH 进展而来的肝纤维化治疗方式的选择。为了更好地研究脂肪性肝纤维发生、发展的分子机制,建立良好的研究模型非常关键。目前对肝纤维化模型的研究多集中于利用能够调节细胞生长和分化的因子TGF-β1 活化肝星状细胞,从而促进胶原基因表达,最终诱导肝纤维化细胞模型[14-15]。PA 是我们日常饮食中最充足的饱和脂肪酸,可通过氧化应激及改变线粒体膜电位等机制引起脂质沉积进而导致脂毒性[16-17],经常用于NAFLD 细胞模型的制备。PA 处理过的肝细胞能够增加外泌体的产生,并将肝纤维化诱导信号转导至肝星状细胞[18]。因此,为了探索脂肪性肝纤维化的最适细胞模型,本文选用PA 与TGF-β1 两种诱导方式进行细胞处理,旨在模拟脂肪性肝纤维化,从而探究脂肪性肝纤维化发展的分子机制。
基于以上实验目的,本文进行了PA 及TGF-β1 实验作用浓度的摸索。首先通过MTT 实验筛选对细胞毒性最小的作用浓度,结果显示不同浓度的PA 及TGF-β1 诱导后,两组细胞的存活率出现不同程度的下降,100 μmol·L-1PA,2、5、10 ng·mL-1TGF-β1 诱导组对 HepG2 细胞、LX-2 细胞的存活率影响较小。随后通过油红O 染色检测细胞内脂滴含量的变化,筛选使得肝细胞发生脂肪性变化的作用浓度,结果显示 200、400 μmol·L-1PA诱导后两组细胞内均见明显脂滴,10 ng·mL-1TGF-β1 诱导LX-2 细胞后细胞内可见明显脂滴。此外,通过检测纤维化标志性因子α-SMA 及CollageⅠ的mRNA 与蛋白表达水平,结果显示400 μmol·L-1PA,5、10 ng·mL-1TGF-β1 诱导HepG2 与LX-2 后细胞内纤维化标志因子表达水平增高。随着浓度的增加,PA 诱导后细胞存活率较低。相比较而言,TGF-β1 是一种更为安全的诱导手段。综合以上实验结果,200 μmol·L-1PA诱导 HepG2 细胞、10 ng·mL-1TGF-β1 诱导 LX-2 细胞与HepG2 细胞24 h 是成功构建脂肪性肝纤维化细胞模型的适宜条件。

