黄体生成素干预大鼠卵巢颗粒细胞的蛋白质组学分析
董玉婷, 陈泰任, 叶晓锋, 黑常春, 蔡玉芳, 孔 斌, 赵承军, 常 青
(1.宁夏医科大学基础医学院人体解剖与组织胚胎学系,生育力保持教育部重点实验室,银川 750004; 2.宁夏医科大学总医院肿瘤医院,银川 750004)
卵巢颗粒细胞(granulosa cells,GCs)是唯一与卵母细胞紧密相互作用的体细胞,广泛参与原始卵泡募集、优势卵泡选择、甾体激素分泌和卵泡闭锁等过程,在卵泡发育和转归过程中发挥重要作用[1-2]。卵泡发育中晚期,卵巢颗粒细胞出现黄体生成素受体(luteinizing hormone receptor,LHR)。LHR属G蛋白偶联受体,黄体生成素(luteinizing hormone,LH)和 LHR 的结合,激活卵巢颗粒细胞 cAMP/PKA、PLC/PKC、ERK1/2 等信号通路,诱导颗粒细胞中表皮生长因子样配体(epidermal growth factor-like ligands,EGF-Ls)、孕激素受体(progesterone receptor,PGR)、前列腺素 E2(prostaglandin E2,PGE2)及活性氧(reactive oxygen species,ROS)等多种分子表达,参与卵母细胞减数分裂的重启动、卵丘细胞的扩散、卵泡破裂、排卵和颗粒细胞黄体化等过程[3-4],LH 或LHR 基因敲除使卵泡发育停滞在窦卵泡阶段[5],不发生排卵从而导致不孕[6];高表达LH 或LHR 则导致颗粒细胞肿瘤的发生[7]。LH 对卵巢颗粒细胞具有多方面的影响,因此全面了解LH 对卵巢颗粒细胞的作用非常必要。
近年来,蛋白质组学技术为卵巢相关研究提供了技术支持,如通过比较多囊卵巢综合征(polycystic ovarian syndrome,PCOS)患者与非PCOS患者血清蛋白表达水平的差异,有助于潜在血清标记物的发现[8]。本实验采用非标记定量(labelfree quantification,LFQ)蛋白质组学技术分析标本蛋白组分,对经LH 干预的原代培养的卵巢颗粒细胞进行蛋白表达谱的分析,以期发现LH 影响哪些颗粒细胞内在的生物学过程和细胞信号通路,并对发现的部分差异表达蛋白进行了验证,为后续的深入研究提供线索。
1 材料与方法
1.1 材料
1.1.1 实验动物 21~25 d 的雌性 SD 大鼠(SPF级)由宁夏医科大学实验动物中心提供[动物合格证号: SCXK(宁)2019-0001]。本实验严格按照中华人民共和国国家质量监督检验检疫总局和中国国家标准化管理委员会发布的《实验动物福利伦理审查指南》进行。
1.1.2 主要试剂 LH 购自 Sigma 公司;孕马血清(pregnant mare serum gonadotropin,PMSG)购自Prospec-Tany 公司;DMEM/F-12 培养基、胎牛血清(fetal bovine serum,FBS)和青链霉素均购自BI公司;兔抗Pard3 多克隆抗体购自Abcam 公司;兔抗Mark3 多克隆抗体购自Cell Signaling Technology(CST)公司;兔抗卵泡刺激素受体(follicle stimulating hormone receptor,FSHR)、Gstp1 及 Nqo1多克隆抗体及兔抗β-Actin 抗体均购自武汉爱博泰克(Abclonal)生物科技有限公司。
1.1.3 分析软件 利用生物信息学手段分析经液相色谱-质谱得到的蛋白质,分析使用的工具及其网址见表1。

表1 生物信息学分析软件
1.2 方法
1.2.1 大鼠原代卵巢颗粒细胞体外培养及鉴定 大鼠原代卵巢颗粒细胞提取借鉴Zhang 等[9]的提取方法,取3 周龄的SD 雌性大鼠腹腔注射PMSG(10 IU/只)36 h 后,用颈椎脱臼法处死,剖取双侧卵巢,采用机械分离方法释放卵巢颗粒细胞,分离出的颗粒细胞按 7×105个/mL 接种到培养皿/瓶中置于37 ℃,5%CO2条件下,用含1%青链霉素和10%胎牛血清的DMEM/F-12 培养基,培养48 h 后以HE 染色观察细胞形态,用FSHR 细胞免疫荧光染色鉴定所提取的颗粒细胞的纯度,细胞纯度=阳性细胞数量/计数细胞总数×100%,纯度到达90%以上进行后续实验。
1.2.2 蛋白提取及重复样品一致性检验 将原代培养的颗粒细胞分为LH 组和对照组,其中LH组培养48 h 后,在培养基中加入0.3 IU·mL-1LH,干预3 h[10],对照组用无菌PBS 代替。每组样品经超声裂解,离心后取上清,使用BCA 试剂盒进行蛋白浓度测定。采用Pearson 相关性和主成分分析(PCA)方法评估重复样本一致性。
1.2.3 液相色谱-质谱(LC-MS)分析 提取出的蛋白酶解成肽段后经超高效液相系统(NanoE-lute)分离、Capillary 离子源电离后,进 tims-TOF Pro质谱,在质荷比100~1700 范围内扫描二级质谱。
1.2.4 数据库检索 二级质谱数据与数据库质谱数据进行匹配分析,得到蛋白鉴定原始结果。
1.2.5 生物信息学分析 用非标定量计算方法计算蛋白在每个样本中的非标记定量强度(LFQ intensity),得到每个样本的相对定量值。通过重复样本的相对定量值得到每个样本的平均值,将两组各样本之间平均值的比值作为最终的差异表达量。基于原始数据P 值和差异表达量筛选差异蛋白,利用GO 注释按照细胞成分、分子功能或生理进程对差异蛋白进行分类。同时,使用KEGG 标注工具KASS 对蛋白通路进行注释,KEGG mapper 将差异蛋白匹配到数据库中相应的KEGG 通路。
1.2.6 Western blot 验证实验 各组蛋白浓度测定后,调整为同一浓度,经SDS-PAGE 凝胶电泳初步分离后,转移到PVDF 膜上,封闭后目的蛋白与其对应一抗(兔抗Pard3、兔抗Mark3、兔抗Gstp1、兔抗Nqo1 和兔抗β-Actin 稀释浓度均为1∶1000)进行孵育,4 ℃过夜。清洗后 PVDF 膜在室温下孵育第二抗体(山羊抗兔1∶5000)1 h,洗膜后用AI600 成像仪曝光后用图像分析软件(Image J 1.8.0.112)进行灰度值的分析。实验重复 3 次。
1.3 统计学方法
1.3.1 差异蛋白筛选 将各个样本的相对定量值取log(2使数据符合正态分布),采用t 检验计算P值,当 P≤0.05 时,以表达变化倍数(fold change,FC)变化>1.5 作为显著上调的阈值,<0.67 作为显著下调的阈值。
1.3.2 生物信息学分析 利用Fisher 精确双端检验方法检测差异表达蛋白对所有鉴定蛋白的富集,P≤0.05 为差异有统计学意义。此时该差异蛋白被认为是显著富集。
1.3.3 Western blot 结果分析 数据采用 SPSS 22.0 统计软件进行分析,组间比较采用t 检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 原代大鼠卵巢颗粒细胞鉴定及蛋白样品一致性检验
大鼠卵巢颗粒细胞体外培养24 h 后贴壁生长,细胞呈星型或梭型(图1A);48 h 后,细胞呈单层生长,伪足相互伸展(图1B);HE 染色显示大鼠卵泡颗粒细胞细胞核清晰,细胞边界分明、形态结构完整(图1C)。FHSR 免疫荧光染色后,镜下可见FSHR 表达在细胞膜和细胞质,呈现绿色细小颗粒,本实验得到的细胞纯度鉴定结果为(92.95±3.4)%,细胞纯度达到后续实验的要求(图2)。蛋白定量主成分分析结果显示,重复样本之间的聚集程度定量重复性良好,且两组间差异较大(图3A),样本间 Pearson 相关系数接近1,表明样本重复性良好(图3B)。
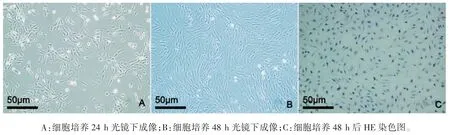
图1 大鼠卵泡颗粒细胞的原代培养及形态观察
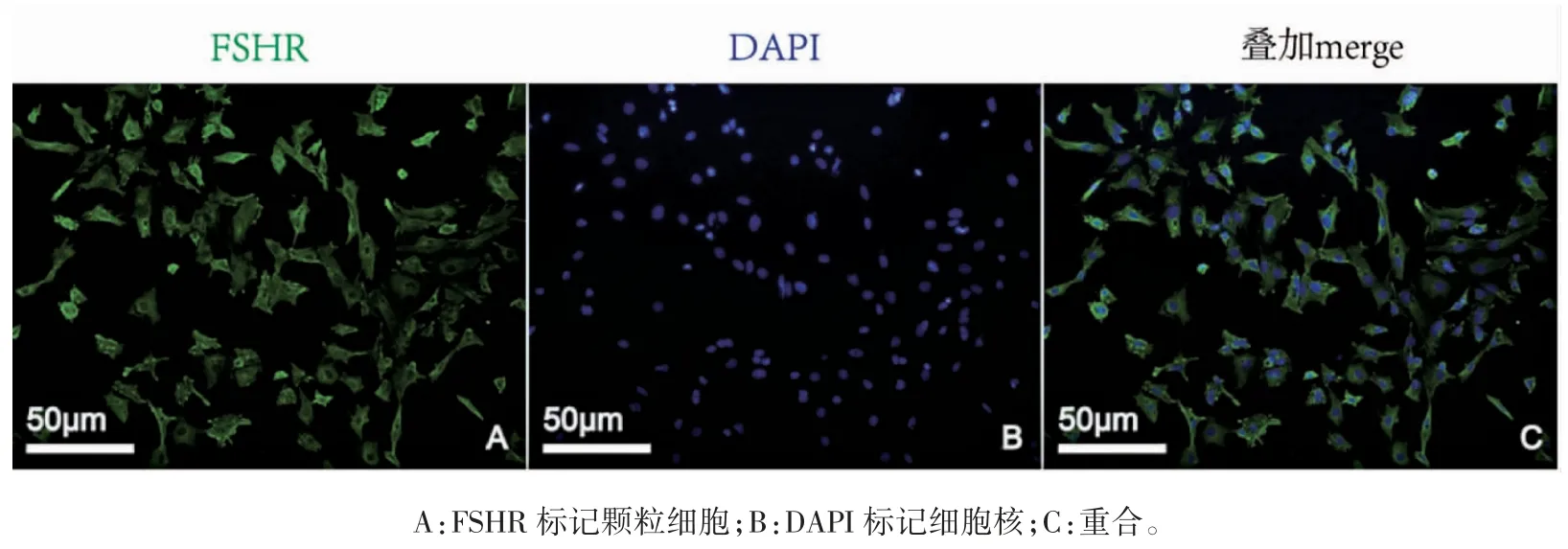
图2 原代大鼠卵巢颗粒细胞FHSR 免疫荧光鉴定
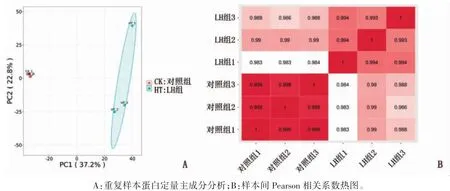
图3 重复实验样本一致性检验
2.2 差异表达蛋白的筛选
与对照组比较,LH 组差异表达蛋白57 个,上调蛋白25 个,包括核糖体蛋白、组蛋白以及 Pard3 等(表 2);下调蛋白 32 个,包括 Crk、Gstp1 和 Nqo1 等蛋白(表 3)。
2.3 差异表达蛋白的GO 分析
57 个差异表达蛋白中54 个的GO 标记可用,GO 二级注释显示,在分子功能(molecular function)层面,大部分差异蛋白具有结合活性与催化活性(图4)。功能富集分析显示,大部分差异蛋白在酶调节相关功能上有显著的富集趋势(图5)。
2.4 KEGG 通路富集
分析差异表达蛋白在某一通路上是否过出现(over-presentation)即为差异表达蛋白的通路富集分析。本次实验部分差异蛋白富集的信号通路包括过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPAR)信号通路、丝裂原活化蛋白激酶(mitogen-activatedprotein kinase,MAPK)信号通路、Hippo 信号通路、胰岛素信号通路及癌症相关信号通路等(图6)。存在于这些信号通路上的差异表达蛋白的具体信息见表4。
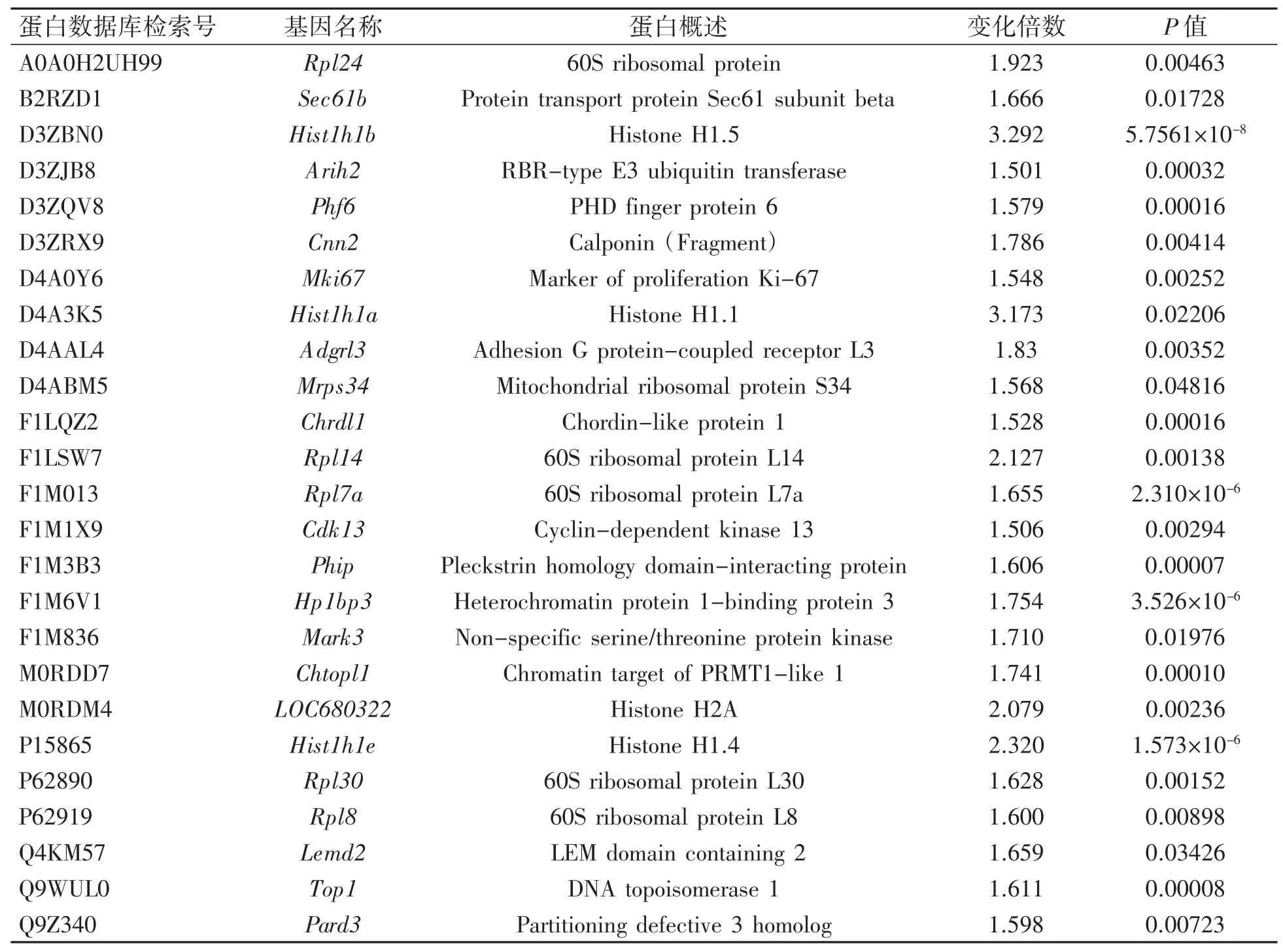
表2 LH 组与对照组间表达上调差异蛋白(n=3)
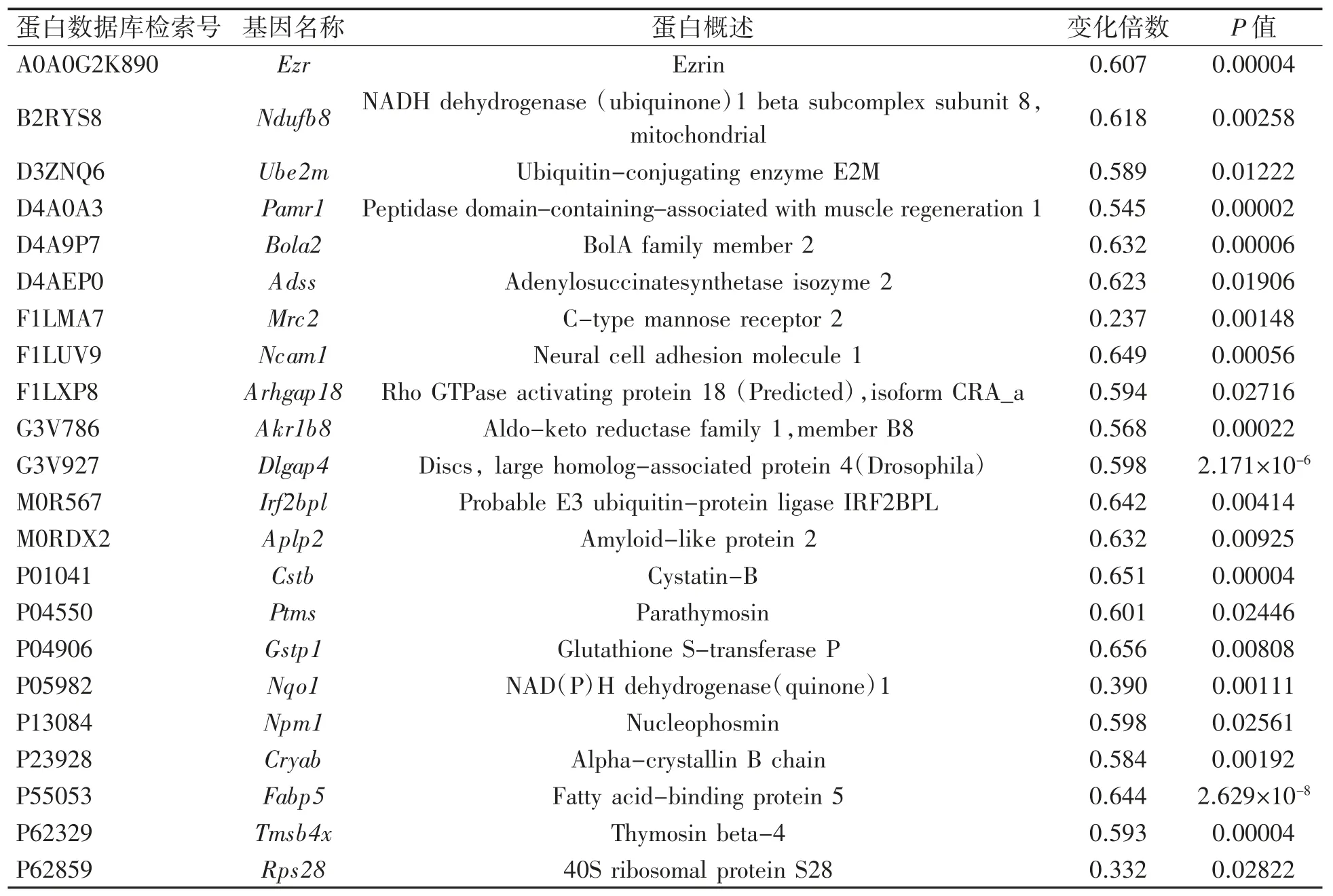
表3 LH 组与对照组间表达下调差异蛋白(n=3)

续表
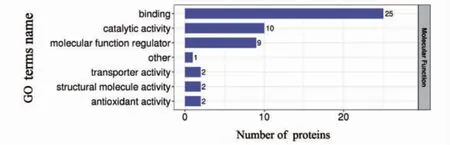
图4 差异表达蛋白在GO 二级分类中统计分布图
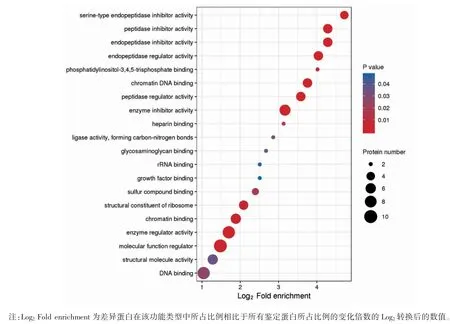
图5 差异表达蛋白在GO 功能分类中富集分布气泡图
2.5 Western blot 验证差异蛋白表达
以上蛋白质组学分析结果表明,与对照组比较,LH 组中 Pard3 和 Mark3 表达上调,Gstp1 和Nqo1 表达下调。Western blot 验证实验结果见图7。
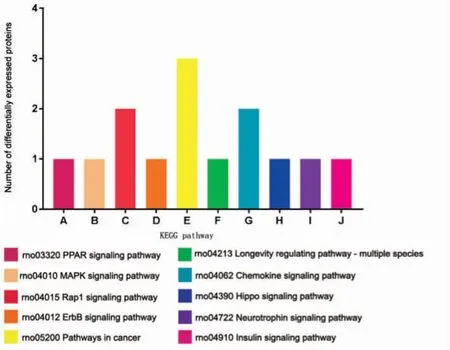
图6 部分差异表达蛋白富集的信号通路
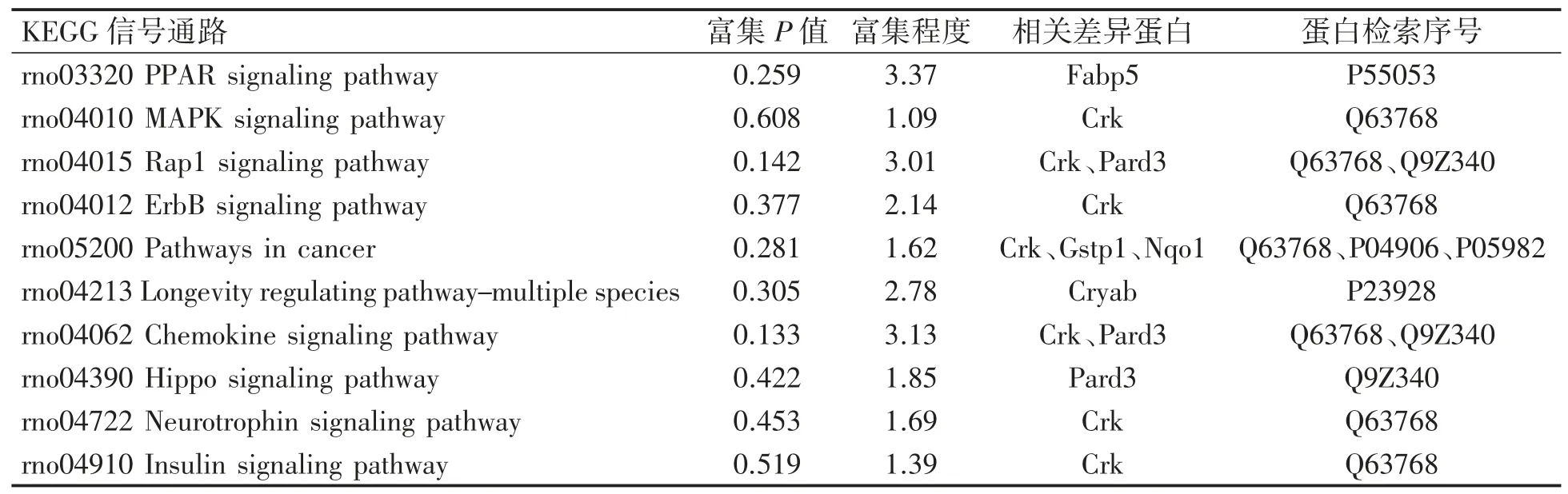
表4 部分差异蛋白富集的信号通路具体信息
3 讨论
卵泡发育过程中,LH 对卵巢颗粒细胞的调控作用至关重要。在稳定可靠的大鼠卵巢原代颗粒细胞培养的基础上,本研究通过蛋白质组学方法发现,LH 干预颗粒细胞后差异表达蛋白共有57 个,其中25个表达上调,32 个表达下调。多个核糖体蛋白表达增高,说明LH 可促进颗粒细胞蛋白质合成功能。同时发现数个组蛋白和细胞增殖的相关分子表达上调,说明LH 可促进DNA的复制和细胞增殖。表达下调的蛋白涉及能量代谢、离子转运、蛋白质降解等过程,这一结果说明,LH 对颗粒细胞相关功能具有抑制作用。
GO 注释及功能富集分析显示,大部分差异蛋白的功能与细胞结合、酶催化能力和分子功能调节有关,说明LH 作用于颗粒细胞,通过相关分子功能的调节,可改变颗粒细胞间相互结合的方式以及激素的合成能力。KEGG 通路富集结果显示,差异表达的蛋白质参与多个细胞信号通路,包括胰岛素信号通路、Hippo 信号通路和MAPK信号通路等。研究[11]表明,小鼠卵巢颗粒细胞产生胰岛素抵抗能够抑制MAPK 信号通路,下调细胞色素 P450c17α(cytochrome P450,family 17,subfamily A,polypeptide 1,CYP17A1)的表达,降低孕酮的产生。Hippo 信号通路在排卵过程中调控卵巢颗粒细胞增殖和分化[12],这些信号通路在调节颗粒细胞功能和卵泡发育中发挥重要的作用。同时也发现了数个在卵巢研究中较少涉及的信号通路,如 PPARs、Rap1 和 Chemokine 等信号通路,为深入研究LH 对颗粒细胞的作用提供了有价值的线索。
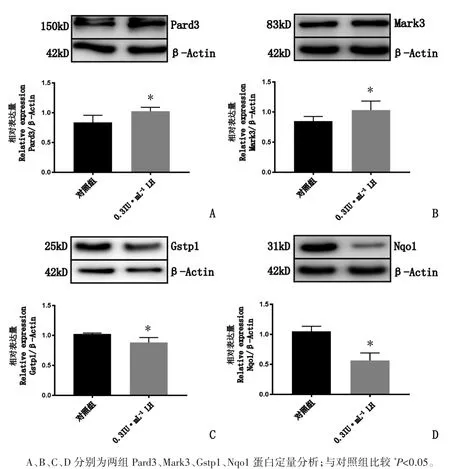
图7 LH 对大鼠卵巢颗粒细胞Pard3、Mark3、Gstp1 以及Nqo1 蛋白表达影响
在本研究验证的4 个差异表达的蛋白中,Pard3 是一种细胞极性蛋白,在维持细胞间紧密连接的同时也控制着细胞的新陈代谢与增殖[13]。结合KEGG 结果,Pard3 参与 Hippo 信号通路的调节。研究[14]发现,Pard3 会导致Hippo 信号通路主要效应分子TAZ 去磷酸化,触发细胞接触和细胞极性信号,从而促进细胞生长。这一结果提示,LH 可通过上调颗粒细胞Pard3 的表达,增强颗粒细胞极性;另一差异表达上调蛋白Mark3 也被证实与细胞极性相关,并参与细胞周期调节和Ras 信号传导[15-16]。有研究[17]发现,Mark3 通过抑制Mst1/2 活性来抑制 Hippo 信号通路,提示LH可通过上调Mark3 的表达抑制Hippo 信号通路继而产生促卵泡生长效应。下调蛋白Gstp1 和Nqo1 被认为是抗氧化标记物,Gstp1 和Nqo1 可减少活性氧的形成,从而抑制氧化应激反应[18-19]。过高的氧化应激反应会引起卵巢颗粒细胞损伤[20],进而诱导颗粒细胞凋亡导致卵泡闭锁[21]。本研究验证的4 个差异表达蛋白,为进一步从颗粒细胞极性、增殖和氧化应激角度深入研究LH的作用提供了基础。
综上,LH 作用于颗粒细胞,可影响细胞极性、蛋白合成及能量代谢等多个相关蛋白表达,涉及MAPK、Hippo 及胰岛素等多条信号通路,提示LH 通过影响颗粒细胞增殖、细胞周期、激素合成能力和抗氧化能力等对卵巢颗粒细胞功能发挥重要作用。

