枸杞多糖促进小肠内分泌细胞分泌肠促胰液素
邓姝颖, 白莉莉, 薛 阳, 陈 康, 蔡慧珍
(宁夏医科大学公共卫生与管理学院营养与食品卫生学系,银川 750004)
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种以葡萄糖依赖的方式增加胰岛素分泌[1],同时还抑制胰高血糖素分泌[2],由此对血糖水平进行调控的内分泌激素。2 型糖尿病(T2DM)患者的主要特征是由肠道L 细胞释放的GLP-1 水平降低。GLP-1 被 Wnt/β-catenin 信号通路下游靶基因GCG 基因编码,其分泌受到Wnt/β-catenin 通路的调控。细胞内第二信使环磷酸腺苷(cAMP)和环腺苷酸结合蛋白(Epac)二者相互作用,在胰岛素分泌调节过程中扮演重要角色[3]。研究表明[4-5],cAMP 与 Epac 蛋白的表达与GCG 基因的转录以及GLP-1 的产生之间也存在某些联系。枸杞多糖(LBP)的降糖作用在本课题组前期实验[6]中已得到证实,但其具体作用机制还有待明确。因此,本实验在GCG 基因转录的水平分别从Wnt/β-catenin 信号通路及cAMP/Epac途径研究LBP 对GCG mRNA 的影响,推测LBP 可能通过这两种途径影响GCG 基因的表达,进而参与GLP-1 的降糖作用。
1 材料与方法
1.1 材料
小鼠小肠内分泌细胞(STC-1)购于上海名劲生物科技有限公司;高糖DMEM、胎牛血清(FBS)、PBS 购于以色列BI 公司;LBP 购于上海源叶生物有限公司;胰酶、双抗购于美国Gibco公司;细胞裂解液NP-40、PMSF 购于上海碧云天生物技术有限公司;细胞核与细胞质蛋白提取试剂盒、BCA 蛋白含量检测试剂盒、SDS-PAGE 凝胶试剂盒购于江苏凯基生物技术股份有限公司;βcatenin、FOXO4、TCF7L2、β-actin 抗体、重组蛋白Wnt3a 购于美国abcam 公司;通用抗体稀释液购于新塞美科技有限公司;二抗、荧光二抗购于北京中杉金桥生物公司;PVDF 膜购于美国Millipore 公司;含DAPI 的抗荧光衰减封片剂购于北京索莱宝科技有限公司;免疫共沉淀试剂盒购于爱必信(上海)生物技术有限公司;β-actin、GCG 基因引物由上海生工生物工程股份有限公司合成;TaKaRa MiniBEST Universal RNA Extraction Kit、PrineScriptTMRT reagent Kit with gDNA Eraser、TB GreenR Premix Ex TaqTMII(Tli RNaseH Plus)购于日本TaKaRa 公司;GLP-1 检测试剂盒购于武汉伊莱瑞特生物科技股份有限公司。
1.2 细胞培养
STC-1 细胞在高糖DMEM 培养基中加入10%FBS 和 1%双抗。在 37°C,5%CO2的条件下培养。
1.3 细胞全蛋白、细胞核蛋白以及细胞质蛋白中β-catenin 蛋白的检测
在75T 细胞培养瓶中将STC-1 细胞培养至60%左右,用无血清的高糖DMEM 培养基培养6 h 使细胞处于同一生长期。不同培养基(分别含有 0、25、50 和 100 μg·mL-1LBP 的 DMEM 培养液,1%双抗,10%胎牛血清)孵育24 h。配制含有1 mmol·L-1PMSF 的 NP-40 裂解缓冲液提取总蛋白。利用核蛋白和胞浆蛋白提取试剂盒提取细胞核蛋白和细胞质蛋白。BCA 蛋白浓度试剂盒测定蛋白浓度。加入70 μg 蛋白样品至8%的SDSPAGE 凝胶电泳,后转移到PVDF 膜上,5%脱脂牛奶(PBST 配制)封闭 1 h 后,加 β-catenin一抗(1∶5000)4 °C 过夜孵育。PBST 洗膜 3 次,1∶4000 稀释二抗室温孵育1 h。滴加ECL 发光显影液,BIO-RAD 成像系统拍照,Image J 分析条带灰度值,计算β-catenin 与β-actin 灰度值的比值。
1.4 Western blot 检测细胞全蛋白中cAMP、Epac蛋白的表达
细胞培养条件同1.2。待细胞长至25T 培养瓶底部60%左右,使用不含血清的高糖DMEM同步细胞6 h,使细胞处于同一生长期。不同培养基(分别含有 0、25、50 和 100 μg·mL-1LBP 的DMEM培养液,1%双抗,10%胎牛血清)孵育24 h。干预结束后,使用含有 1 mmol·L-1PMSF 的 NP-40裂解缓冲液提取总蛋白,BCA 蛋白浓度试剂盒检测蛋白浓度,加入30 μg 蛋白样品至8%的SDS-PAGE凝胶电泳,后转移到0.45 μgPVDF 膜上,5%脱脂牛奶(PBST 配制)封闭 1 h 后,加 β-catenin 一抗(cAMP 1∶20000;Epac 1∶1000)4 ℃过夜孵育。PBST洗膜 3 次,1∶4000 稀释二抗室温孵育 1 h。滴加ECL 发光显影液,BIO-RAD 成像系统拍照,Image J分析条带灰度值,分别计算cAMP 和Epac 与βactin 灰度值的比值。
1.5 免疫荧光法检测细胞中β-catenin 的原位表达
在24 孔板中放入盖玻片,将细胞均匀种板于24 孔板中,加入含10% FBS 的培养基孵育24 h。再用无血清高糖DMEM 细胞同步化6 h 后改为分别含有 0、25、50 和 100 μg·mL-1的 LBP 培养基培养24 h。4%多聚甲醛中固定15 min,然后在室温下用0.5% Triton X-100 处理20 min。PBS浸洗后,山羊血清室温孵育30 min。加入β-catenin一抗(1∶250)后 4 °C 避光孵育一夜。荧光二抗(1∶25) 在室温下孵育 1 h 后,PBS 浸洗 3 次,每次3 min。滴加10 μL 含DAPI 的抗荧光衰减封片剂于载玻片上,将盖玻片有细胞的一侧向下使封片剂充盈于盖玻片与载玻片中间,除尽气泡。最后,在荧光显微镜下观察和收集图像,对βcatenin 蛋白的原位表达进行定性分析。
1.6 免疫共沉淀法检测转录因子FOXO4、TCF7L2与 β-catenin 的结合
将STC-1 细胞分为4 组,分别为空白对照组、重组蛋白 Wnt3a 组(含 50 ng·mL-1重组蛋白Wnt3a)、LBP 组(含 100 μg·mL-1LBP)和 LBP 联合重组蛋白 Wnt3a 组(含 100 μg·mL-1LBP 和50 ng·mL-1重组蛋白 Wnt3a)培养 24 h。用含有1 mmol·L-1PMSF 的 NP-40 裂解缓冲液制备蛋白样品。将蛋白A 和蛋白G 加入蛋白样品中,4°C下孵育 40 min。4 °C 条件下以 12000×g 速度离心1 min 保留上清液。将FOXO4 一抗或TCF7L2 一抗分别加入上清液中,4 °C 下孵育一夜,再次加入蛋白A 和蛋白G,4 ℃过夜。上清液在12000×g速度下离心1 min,弃上清液。用预冷的PBS 重复洗涤沉淀物3 次。用1% SDS 样品缓冲液(Tris-HCl pH7.5,含 0.5 mmol·L-1EDTA 和 1 mmol·L-1DTT)重悬沉淀,100 ℃沸水浴10 min 使蛋白变性。将20 μL 准备好的蛋白样品至8%凝胶中,后续操作同1.3。Image J 分析条带灰度值,计算β-catenin 与 β-actin 灰度值的比值。
1.7 细胞上清液中GLP-1 表达水平的检测
将 STC-1 细胞分为 4 组,分别使用含0、25、50、100 μg·mL-1LBP 的完全培养基对细胞进行干预。根据伊莱瑞特试剂盒中的说明,对GLP-1的浓度进行测试。
1.8 RT-PCR
将 STC-1 细胞分为 4 组,分别使用含0、25、50、100 μg·mL-1LBP 的完全培养基对细胞进行干预。使用TaKaRa RNA 提取试剂盒,采用柱式提取法从细胞中提取总RNA。核酸蛋白仪检测RNA浓度及纯度;根据TaKaRa 反转录试剂盒将一部分RNA 反转录成cDNA,另一部分-80 ℃保存。GCG的引物序列为GCG-F:GCACATTCACCAGC GACTA;GCG-R:TGACGTTTGGCAATGTTC;以β-actin 为内参,其序列为 β-actin-F:GGTCATCACTATTGGCAACG;β -actin -R:ACGGATGTCAACGTCACACT。根据荧光定量PCR 试剂盒中操作步骤配制反应体系,PCR 程序为:Step1:95 ℃,30 s;Step2:95 ℃,5 s;60 ℃,30 s,共 40 个循环 ,95 ℃,5 s;60 ℃,30 s;Step3:溶解曲线。GCG mRNA水平的计算采用相对表达量RQ=2-ΔΔCt值。
1.9 统计学方法
实验数据采用SPSS 24.0 统计软件进行分析,计量资料用均数±标准差()表示,多组样本间均值的比较采用One-Way ANOVA 方法,两两比较采用LSD 法。采用析因方差分析对免疫共沉淀结果进行分析,两组间独立样本采用t 检验,检验水准取α=0.05。
2 结果
2.1 不同浓度LBP 对STC-1 细胞干预后全蛋白、核蛋白、质蛋白中β-catenin 表达水平比较
不同浓度LBP 干预下,STC-1 细胞中全蛋白、核蛋白和质蛋白中β-catenin 的含量差异均有统计学意义(F全=23.622,F核=45.026,F质=305.644,P 均<0.01)。与 0 μg·mL-1组(空白对照组)比较,50 μg·mL-1、100 μg·mL-1LBP 干预下全蛋白、核蛋白及质蛋白中β-catenin 表达均增加(P 均<0.05),见图 1。
2.2 不同浓度 LBP 对 STC-1 细胞中 cAMP、Epac 蛋白表达的影响
由图2 可见,各组 cAMP、Epac 蛋白差异均有统计学意义(FcAMP=46.644,FEpac=268.229,P 均<0.01)。随着 LBP 干预浓度的增加,cAMP、Epac 蛋白表达水平也随之增加。与0 μg·mL-1组(空白对照组)相比,各 LBP 干预组 cAMP、Epac 蛋白表达水平均增高(P 均<0.05)。
2.3 免疫荧光法检测不同浓度LBP 对β-catenin蛋白核转位的影响
由图3 可见,在空白对照组和25 μg·mL-1LBP干预的条件下,Cy3(红色荧光)所标记的β-catenin集中在细胞核周围。在LBP 干预后,细胞中红色荧光强度随LBP 浓度的增加而增强,细胞核内红色荧光Cy3 强度也随之增加,表明LBP 可能刺激了β-catenin 分泌进而迁移到细胞核中。
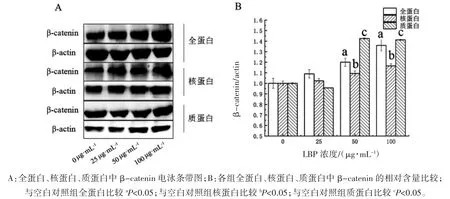
图1 不同浓度LBP 对STC-1 细胞干预后全蛋白、核蛋白、质蛋白中β-catenin 表达水平
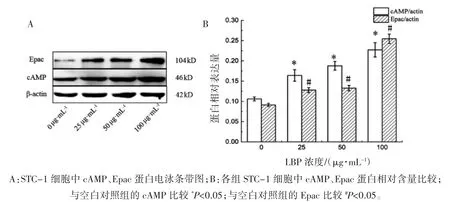
图2 不同浓度LBP 对STC-1 细胞干预后cAMP、Epac 蛋白的表达水平
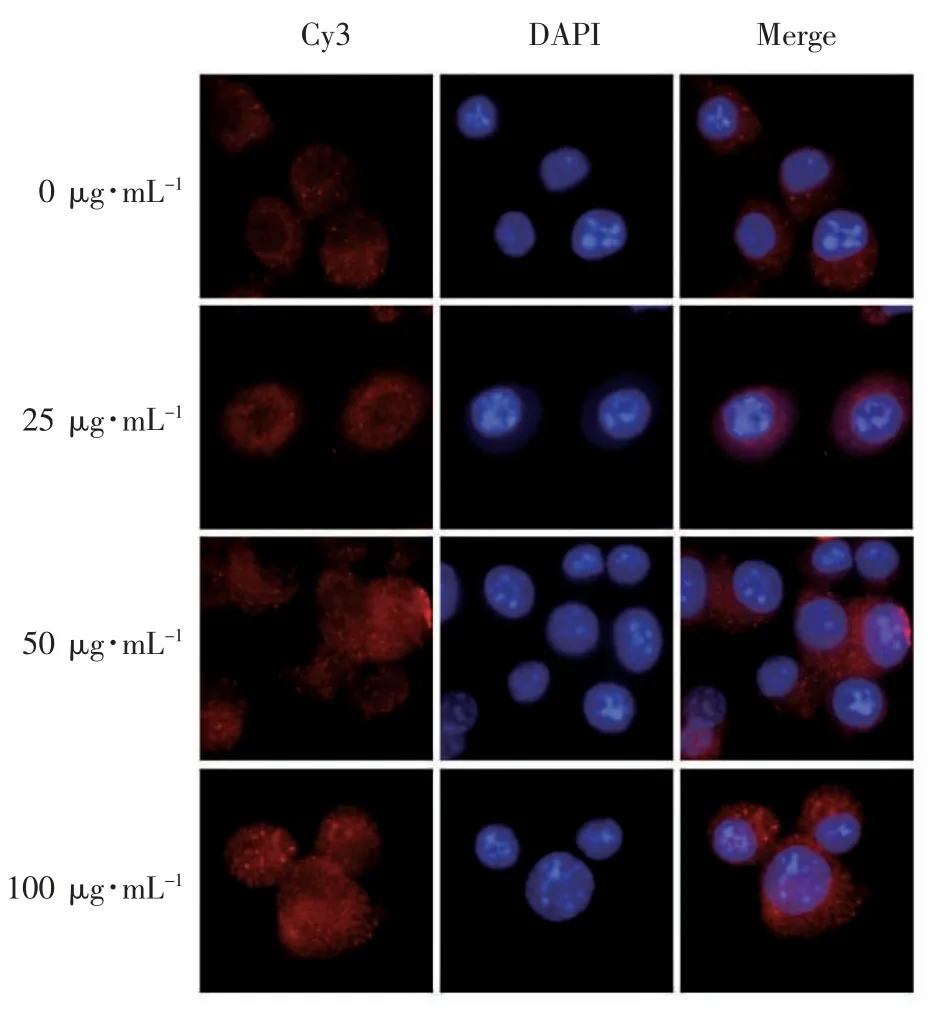
图3 不同浓度LBP 对β-catenin 蛋白核转位的影响(×100)
2.4 免疫共沉淀检测转录因子TCF7L2、FOXO4与β-catenin 结合情况
将重组蛋白Wnt3a 干预组设为阳性对照组,由表 1、表 2 可知,LBP 与重组蛋白 Wnt3a 之间存在相互作用(见图4)。在无LBP 和重组蛋白Wnt3a 干预的情况下(即空白对照组),可以检测到FOXO4 和TCF7L2 与β-catenin 的复合物。重组蛋白Wnt3a 干预后,FOXO4 抗体沉淀的二聚体中 β-catenin 的表达增加(P<0.001)。经 LBP 干预后,细胞中β-catenin 与转录因子TCF7L2 的复合物水平较空白对照组增加(P=0.001)。经LBP干预后的FOXO4/β-catenin 二聚体与空白对照组比较差异无统计学意义(P=0.085)。LBP 和重组蛋白Wnt3a 联合干预后,β-catenin 与TCF7L2的结合物较空白对照组增加,FOXO4/β-catenin复合物表达水平较空白对照组降低(P 均<0.01)。
2.5 采用实时荧光定量PCR 检测STC-1 细胞中GCG 基因的表达
为进一步研究LBP 对Wnt 信号通路中GCG 基因的影响,采用实时荧光定量PCR 检测GCG 基因的表达。结果表明,随着LBP 浓度的增加,GCG基因的表达逐渐增加。50 μg·mL-1和 100 μg·mL-1LBP 干预下,GCG 基因表达均较空白对照组增加(P 均<0.05),见图 5。
2.6 STC-1 细胞上清液中GLP-1 的表达水平
ELISA 结果显示,与空白对照组相比,50 和100 μg·mL-1LBP 干预下上清液中 GLP-1 的表达水平差异均有统计学意义(P 均<0.05)。当LBP干预浓度为25 μg·mL-1时,细胞上清液中的GLP-1的表达水平与空白对照组相比差异无统计学意义(P>0.05),见图 6。

表 1 各组干预后FOXO4/β-catenin 二聚体的表达水平
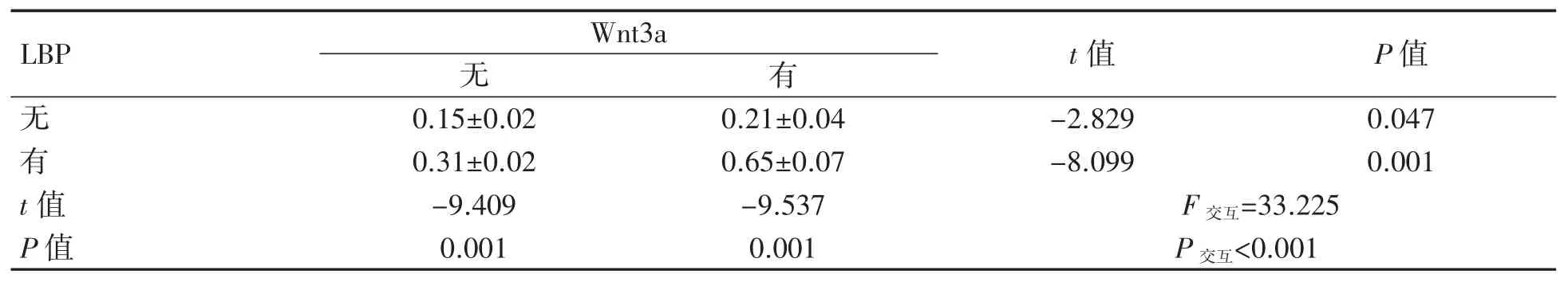
表2 各组干预后TCF7L2/β-catenin 二聚体的表达水平
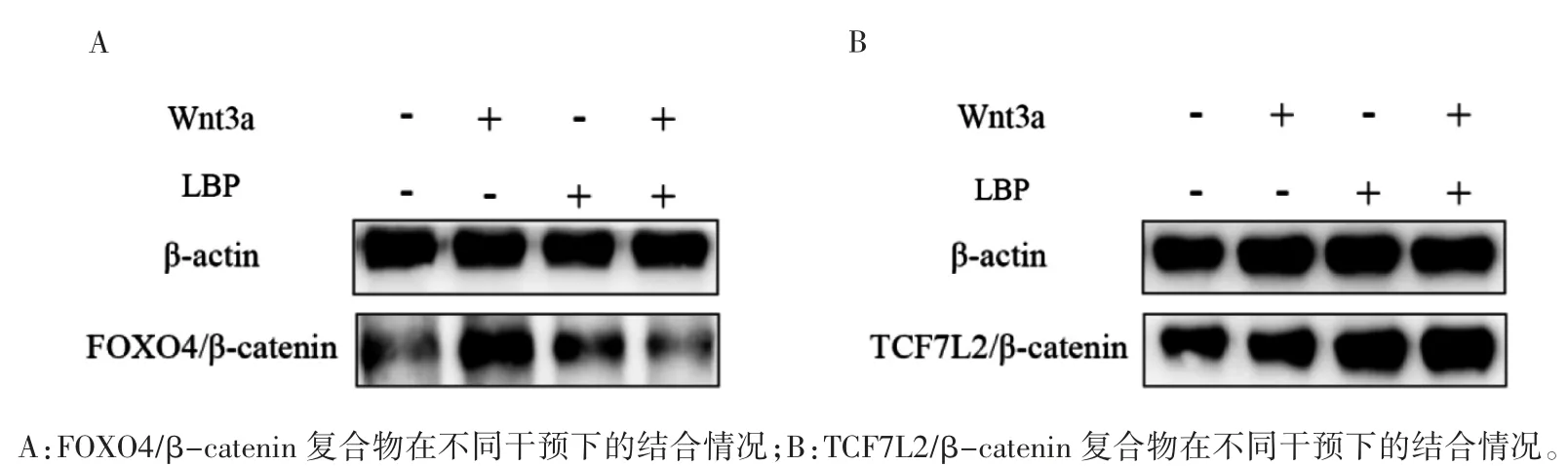
图 4 转录因子FOXO4、TCF7L2 与β-catenin 结合情况

图 5 STC-1 细胞中GCG 基因的表达水平比较
3 讨论
Wnt/β-catenin 信号通路参与调控增殖、迁移、侵袭和凋亡等生物学过程[7]。该途径与多种疾病相关,如糖尿病及其相关疾病[8-9]、癌症[10-12]、自身免疫性疾病[13-14]等。β-catenin 蛋白作为Wnt/β-catenin 信号通路上的关键开关,β-catenin蛋白入核是激活Wnt/β-catenin 通路的关键步骤[15]。本研究使用LBP 干预STC-1 细胞,细胞核和细胞质中β-catenin 蛋白的浓度增加。LBP 刺激β-catenin 蛋白易位进入细胞核,说明LBP 可能通过上调β-catenin 的表达以及促进β-catenin的核转位,从而激活Wnt/β-catenin 信号通路。
在小鼠小肠上皮细胞中,β-catenin 入核后与T 细胞因子(TCF)/淋巴增强因子(LEF)转录因子结合,形成β-catenin/TCF 二聚体,激活下游靶基因[16]。转录因子FOXOs 与β-catenin 的结合将竞争性地抑制转录因子TCF 与β-catenin 的结合,导致受Wnt 信号通路调控的靶基因的转录活性降低[17]。本实验检测了LBP 干预下转录因子FOXO4 和 TCF7L2 与 β-catenin 蛋白的结合情况,结果表明,LBP 能有效地增加转录因子TCF7L2与 β-catenin 的结合,提高β-catenin/TCF 二聚体的含量。这一结果与徐佳慧[18]在胃癌中的研究相似,进一步表明LBP 可能对Wnt 信号通路有一定的影响。
在 Wnt 信号通路的下游,β-catenin/TCF 二聚体可以调节GCG 的表达[19]。β-catenin/TCF 二聚体与GCG 基因增强子G2 序列结合,调控GCG 基因的转录[20]。为了验证LBP 是否可以通过增加β-catenin/TCF 二聚体来上调GCG 基因的表达,并进一步调节Wnt 信号通路,本研究观察了不同浓度的LBP 对STC-1 细胞中GCG 基因的影响。结果表明,LBP 能有效调控细胞GCG 基因的表达。
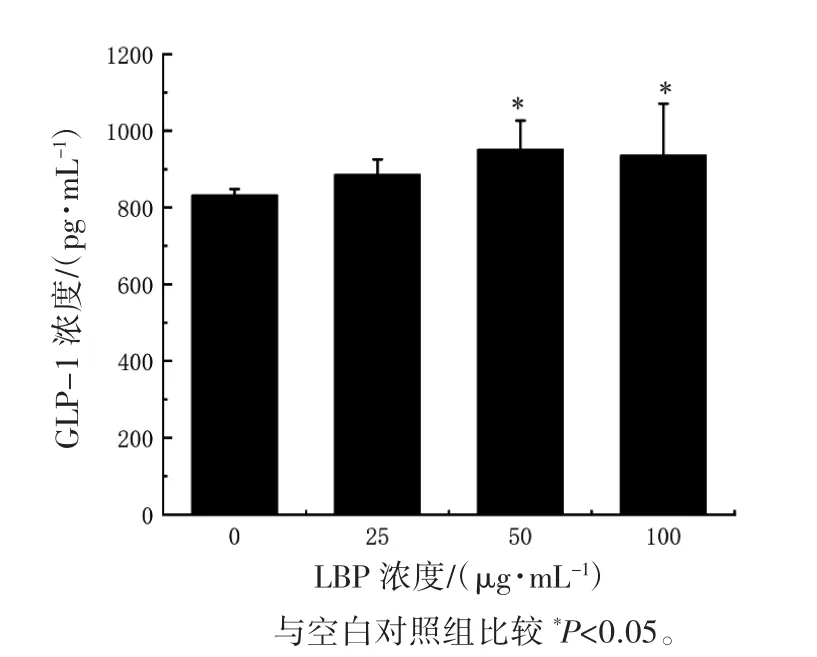
图 6 STC-1 细胞上清液中GLP-1 的表达水平
cAMP 是GCG 编码肽激素的影响因素之一[21],Epac 为cAMP 的影响因子之一,也是调节GLP-1分泌的重要因素。研究表明[22-23],在一些胰腺α和肠道内分泌L 细胞中,cAMP 升高能促使GCG mRNA 的表达和启动子转录增加;同时有学者研究了Epac 在刺激GCG 转录、胰高血糖素和GLP-1 产生中的作用[24-25]。这些研究结果与本实验结果相近,LBP 可能通过上调 cAMP、Epac 蛋白的水平,进一步刺激GCG 基因的表达以及GLP-1的分泌。
由GCG 基因编码的GLP-1 不仅能够增加胰岛素的分泌,同时也能提高细胞对胰岛素的敏感性,并保护胰岛细胞免受损伤,为使用胰岛素治疗2 型糖尿病提供科学依据[1]。目前已有研究[26]表明,多糖对 Wnt/β-catenin 信号通路、cAMP/Epac 确有影响,同时GCG 基因对GLP-1 的调控作用也已证实。但目前还未见关于多糖影响GLP-1 分泌的系统研究。因此,本实验观察了不同浓度LBP 干预STC-1 细胞后,GLP-1 水平是否随 LBP 浓度增加而改变。结果表明,GLP-1 的变化趋势与GCG基因的表达趋势一致,提示Wnt 信号通路以及cAMP/Epac 可能参与了LBP 诱导的GLP-1 分泌。
综上,本实验通过 Wnt/β-catenin、cAMP/Epac信号通路,探讨LBP 对GCG 基因的影响,从而研究对GLP-1 分泌的影响。从β-catenin 蛋白的表达、TCF7L2/β-catenin 二聚体的形成、GCG 基因的表达和GLP-1 分泌系统地研究了LBP 对Wnt信号通路的影响。结果发现,LBP 可以通过刺激Wnt 信号通路来增加β-catenin 蛋白的分泌,从而促进TCF/β-catenin 二聚体的形成,进而上调GCG基因的表达,增加GLP-1 的浓度,同时也能通过上调cAMP 与Epac 蛋白的表达水平,进而影响GCG 基因以及GLP-1 的表达与分泌。本研究为LBP 治疗T2DM 的机制提供新的证据。

