MRI纹理分析在单囊状胰腺囊腺瘤鉴别诊断中的价值
王希恒, 薛华丹, 成思航, 李娟, 孙照勇, 金征宇
胰腺囊腺瘤分为浆液性囊腺瘤(serous cystadenoma,SCA)和粘液性囊腺瘤(mucinous cystic neoplasm,MCN),SCA分为寡囊型和微囊型,与微囊型SCA不同,寡囊型SCA(macrocystic serous cystade-
noma,MaSCA)的囊少且大,由于囊腔较大,在临床阅片过程中,MaSCA与MCN常难以鉴别[1]。SCA通常为良性肿瘤,很少发生恶变,只有引起临床症状时建议手术[2,3],而MCN具有恶变潜能,国际共识指南建议手术切除[4],欧洲循证指南建议≥4 cm的MCN手术切除,<4 cm的MCN终身随访[5],鉴于SCA和MCN的临床诊疗措施差异很大,故术前对两者鉴别非常重要。
纹理分析及影像组学是指对大量的医学图像特征进行综合量化,广泛用于疾病诊断、术前评估及预后随访等目的,为临床决策支持提供很大帮助,近年来已逐渐应用于医学影像领域[6-8]。磁共振成像(magnetic resonance imaging,MRI)无创、无辐射,在胰腺囊性病变诊断及影像征象识别具有较高准确性[9],本研究旨在建立术前MRI纹理分析模型,证实其对MaSCA和MCN的鉴别诊断价值,辅助影像诊断,为临床治疗提供参考。
材料与方法
1.临床及影像资料
回顾性搜索本院影像归档和通信系统(picture achiving and communication system,PACS)及病理系统2015年6月-2019年12月经手术切除、病理证实为囊腺瘤患者资料。纳入标准:①病变经手术病理证实;②MRI扫描前未经放、化疗等治疗。排除标准:①图像伪影重;②无术前MRI图像。根据以上纳排标准,排除病理证实为微囊型SCA(5例)及无术前MRI检查(74例)患者,最终入组68例,包括32例MaSCA(男:女=9:23,平均年龄47.0岁)和36例MCN(男:女=0:36,平均年龄41.9岁)。搜集患者MRI压脂T1加权图像(fat suppression T1weighted imaging,FS-T1WI)和压脂的T2加权图像(fat suppression T2weighted imaging,FS-T2WI)数据。
2.扫描方法
使用西门子3.0T MRI扫描仪(Magnetom Skyra,Siemens Healthcare),18通道线控阵表面线圈及部分32通道脊柱线圈,横轴面FS-T1WI (T1-Dixon)扫描参数为重复时间4.11 ms,回波时间1.31 ms,层厚3 mm,翻转角12°,视野420×420 mm;横轴面FS-T2WI (T2-BLADE)扫描参数:重复时间2390 ms,回波时间85 ms,层厚6 mm,翻转角100°,视野360 mm×360 mm。
3.图像分析
影像特征分析:两位影像科医师进行双盲法阅片,共同评估病变的大小、位置、形状、囊壁厚薄(>2 mm或≤2 mm)、分隔有无及厚薄(>2 mm或≤2 mm)、壁结节,意见不一致时协商达成共识。
纹理分析基于68例胰腺病变FS-T1WI和FS-T2WI原始DICOM图像,一位影像科医师标注病变最大层面并送达纹理分析工作站(TexRAD有限公司,www.texrad.com,part of Feedback Plc,剑桥,英国),在工作站沿着病变边缘手动标注病变轮廓,标注结果均经另一位高年资医师审核(图1)。使用TexRAD软件对MRI图像进行纹理特征分析,利用高斯-拉普拉斯带滤波算法对滤值或宽度进行细微调整,选择性地提取出不同空间过滤标准的FS-T1WI和FS-T2WI病变区域纹理图像,空间比例因子(spatial scaling factor,SSF)代表滤过,定义SSF=0表示无滤过,SSF=2 mm表示滤过后得到精细纹理,SSF=3~5 mm表示中等纹理,SSF=6 mm表示粗糙纹理。每个SSF值最终得到的量化纹理参数包括平均灰度值(Mean),标准差(standard deviation,SD),熵(Entropy),正像素的平均值(mean of positive pixels,Mpp),偏度(Skewness)和峰度(Kurtosis)。最终,每个病变在两个序列均分别提取36个纹理特征。
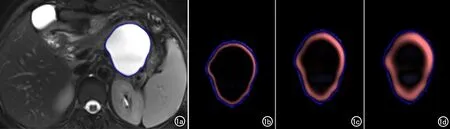
图1 患者,女,胰体尾部MCN。a) 基于FS-T2WI图像标注的病变轮廓; b) SSF=2提取的纹理特征; c) SSF=4提取的纹理特征; d) SSF=6提取的纹理特征。
4.统计学分析
利用独立样本t检验、卡方检验或Fisher确切概率法比较MaSCA和MCN影像征象之间的差异。利用独立样本t检验或Mann-Whitney检验两组数据各纹理参数之间的差异,利用ROC曲线(receiver-operating characteristic curve)评估有统计学差异者诊断性能。利用多变量Logistic回归分析,选取有差异影像特征构建诊断MCN的影像诊断模型,选取ROC曲线下面积(area under the curve,AUC)最大的纹理参数构建诊断MCN的纹理分析模型,影像特征及纹理特征组合构建组合模型,利用ROC曲线评估各模型的预测性能,记录AUC、95%的置信区间(confidence interval,CI)、敏感性及特异性。符合正态分布的计量资料以“均数±标准差”表示,偏态分布的以“中位数(四分位间距)”表示。统计学软件采用SPSS 25.0。P<0.05认为差异有统计学意义。
结 果
1.临床及影像特征
对比MaSCA和MCN患者的临床资料,两组在年龄差异无统计学意义,性别差异有统计学意义(P=0.001)。对比两者影像特征,两组在形状、分隔厚薄及壁结节上均无统计学差异,在囊肿大小(P=0.003)、位置(P=0.001)、囊壁厚薄(P=0.019) 及分隔有无(P=0.031)上有统计学差异(表1),MCN直径>MaSCA,通常分布于体尾部,囊壁较厚,MaSCA内常见分隔。

表1 MaSCA及MCN的临床及影像特征比较
2.MRI纹理分析
基于FS-T1WI提取的纹理参数中,MaSCA和MCN在Mean(SSF=0)、SD(SSF=0、3、4、5、6)、Entropy(SSF=0)、Mpp(SSF=0、2、3、4、5、6)、Skewness(SSF=0)、Kurtosis(SSF=0、4、5、6)上的差异均有统计学意义,在以上有统计学差异的参数中Mean(SSF=0)、Entropy(SSF=0)和Skewness(SSF=0)的AUC分别为0.674、0.645和0.688,SD(SSF=0)、Mpp(SSF=3、4)和Kurtosis(SSF=0)取得最大AUC分别为0.652、0.693、0.770(表2)。

表2 基于FS-T1WI纹理分析中两组差异有统计学意义的参数
基于FS-T2WI提取纹理参数中MaSCA和MCN在Skewness(SSF=0)、Kurtosis(SSF=0、5、6)上的差异均有统计学意义,在以上有统计学差异参数中Skewness(SSF=0) AUC为0.776,Kurtosis(SSF=0)取得最大AUC为0.820(表3)。
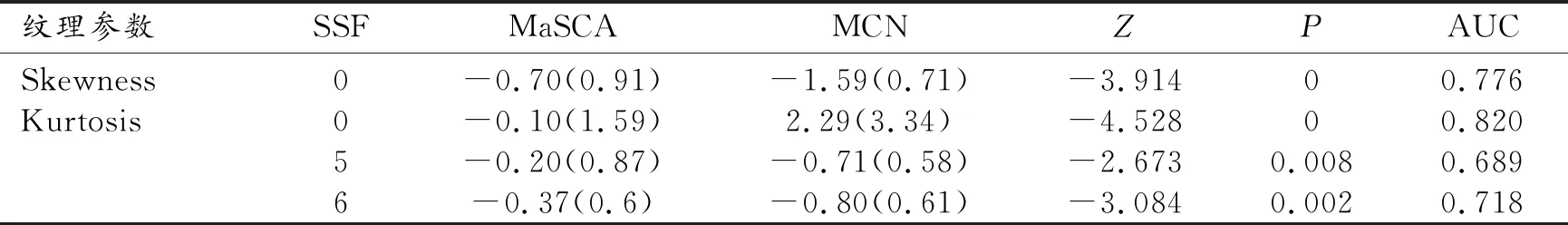
表3 基于FS-T2WI纹理分析中两组差异有统计学意义的参数
3.模型诊断性能
以囊肿大小、位置、囊壁厚薄及分隔有无为自变量构建诊断MCN影像模型AUC为0.849,敏感度较高,为86.1%,特异度较低,为68.7%。以Mean(SSF=0,T1WI)、SD(SSF=0,T1WI)、Entropy(SSF=0,T1WI)、Mpp(SSF=3、4,T1WI)、Skewness(SSF=0,T1WI)、Kurtosis(SSF=0,T1WI)及Skewness(SSF=0,T2WI)、Kurtosis(SSF=0,T2WI)作为自变量构建诊断MCN的纹理分析模型AUC为0.887,敏感度及特异度均较高,分别约80.6%、84.4%。组合模型的AUC、敏感度及特异度均最高,分别约0.958、88.9%、90.6%(表4,图2)。

图2 ROC曲线示各模型鉴别MaSCA和MCN效能

表4 影像模型、纹理分析模型及组合模型诊断性能
讨 论
在本研究我们构建了影像模型、纹理分析模型及组合模型用于鉴别MaSCA和MCN,同时比较三者的诊断效能,纹理分析模型略高于影像模型,但组合模型明显高于前两者。纹理分析以无创的方式对胰腺囊腺瘤进行危险分层,在辅助临床影像诊断及为临床决策提供指导方面有很大的应用潜能及价值。
胰腺SCA及MCN发病具有明显性别倾向,SCA男女发病比例约3:1,平均发病年龄60~65岁[10,11],MCN男女发病比例约20:1,高发于47~50岁[12,13]。与既往研究一致,在该研究中MaSCA发病年龄高于MCN且均好发于女性,但是性别分布比例及发病年龄与文献报道均有所差异,考虑与两组患者病例数少及SCA中仅纳入MaSCA患者有关。影像特征与既往研究相符[1,14],MCN体积大、好发于体尾部且囊壁厚,MaSCA体积小、好发于胰头且囊壁薄。文献报道[14,15]MCN及MaSCA在形状上差异显著,MCN通常为类圆形而MaSCA多分叶状且两者是否存在分隔无统计学差异,这与本研究结果两组均多见分叶状外形且差异不显著、MaSCA多见分隔且差异显著的结果相佐,考虑一方面为病例数所限,另一方面为影像检查差异,本研究为基于MRI征象分析,相较于既往CT检查,具有较高的组织分辨率,对细微征象观察清晰。
肿瘤从大体到细胞水平、遗传到表观水平都是不均匀的,在细胞密度、血管生成和坏死均存在空间异质性,因此,术前无创性评估肿瘤内异质性对临床价值很大。MaSCA囊壁由扁平或立方上皮细胞组成且有导管分化趋势,囊腔充满浆液[1]。MCN上皮由分泌粘蛋白的柱状细胞构成,上皮细胞与异型增生或浸润性癌相关,上皮细胞下存在卵巢样基质,MCN囊腔充满粘液。MaSCA和MCN在组织学层面的差异反映在MR图像上是纹理分析的基础[16]。纹理分析是指利用各种数学方法,定量评估图像的灰度强度和像素的位置获取各种纹理特征,从而反映肿瘤内部异质性特点[17,18]。本研究获取的6种纹理参数中,平均灰度值代表ROI内像素的平均值;标准差代表平均值离散度;偏度指像素分布不对称的平均量度;峰度指直方图像素强度的峰值[19];熵反映组织的不规则度或复杂度[20];正像素平均值表示高于阈值零的平均灰度强度,减少了图像中暗物质的影响[21]。
本研究基于FS-T1WI提取有统计学差异纹理参数中MaSCA的平均灰度值、标准差、熵、正像素平均值均高于MCN,其中熵常用来反映组织的异质性。梁萌等[22]基于CT进行囊液纹理分析结果显示MCN的熵显著高于SCA,与本研究不同,考虑差异一方面在于ROI范围,前研究避免囊壁及钙化成分,本研究ROI包括整个病变轮廓,涵盖成分复杂。另一方面,本研究在对影像征象进行分析时MaSCA的分隔特征显著高MCN,对最终结果也有一定影响。本研究结果显示基于FS-T1WI MCN的偏度和峰度明显高于MaSCA。Li等[23]利用MRI纹理分析技术鉴别具有恶性潜能的胰腺无功能神经内分泌肿瘤与良性或低度恶性的实性假乳头状瘤,训练集和验证集两组患者FS-T1WI偏度和峰度数据均无统计学差异,但Li等研究是基于实性肿瘤且应用于有明显良恶性差异的病变。本研究基于FS-T2WI的纹理参数中SSF=0时MaSCA较MCN的偏度大、峰度小且有统计学差异。Lupean等[24]基于T2WI纹理分析鉴别卵巢良恶性囊肿,良性较恶性者偏度小、峰度大且有统计学差异。Cheng等[21]基于FS-T2WI提取纹理特征鉴别胰腺良恶性囊性病变,偏度和峰度均无统计学差异,以上相关研究与本研究存在差异,考虑原因为我们入组的MCN中未根据组织分化程度做进一步分类且胰腺囊性病变纹理参数意义还有待探索[20]。
本研究为鉴别MaSCA和MCN,基于MRI FS-T1WI和FS-T2WI分别构建了影像模型、纹理分析模型和组合模型,组合模型AUC高达0.958,结果充分表明MRI纹理分析能够显著提高MaSCA和MCN的诊断效能,纹理特征与影像特征综合分析具有很重要的临床意义。既往纹理分析研究多是基于实性肿瘤,对囊性病变鉴别少见。Cheng等[21]基于MRI纹理分析构建模型对鉴别胰腺良恶性囊性病变有一定价值。Xie等[15]分别构建影像模型、基于CT纹理分析技术的组学模型及组合模型,结果表明组合模型对MaSCA和MCN进行鉴别诊断有最好的性能,AUC达0.994,充分证实了CT纹理分析技术对术前鉴别胰腺囊腺瘤的价值。Wang等[25]基于MRI纹理分析构建回归模型鉴别MCN和SCA,AUC高达0.879,与本研究结果近似。
本研究有一定局限性。首先,本研究为回顾性单中心研究,在前文中也提及样本量小对结果有所影响,故设置内外验证集的大样本、前瞻性、多中心研究十分重要;第二,ROI的标注只是在病变最大的单一层面未涵盖全部病变特点且我们仅基于最常见的MRI扫描序列进行纹理分析,未来研究中应纳入多序列多层面组学分析会更有说服力;第三,ROI的标注是手工进行,标注偏差可能造成直方图的混乱,未来基于自动分割或半自动分割ROI的标注,消除手工分割的主观影响,在诊断的准确性会有所提高;第四,寡囊性囊腺瘤还应与胰腺假性囊肿及分支型导管内乳头状粘液性肿瘤(branch-duct intraductal papillary mucinous neoplasm,BD-IPMN)鉴别,假性囊肿通常伴有胰腺炎病史,BD-IPMN在MRCP上可见与胰管相通[26],有助于两者鉴别。
总之,本研究综合影像特征和纹理特征的组合模型有助于术前无创性鉴别MaSCA和MCN,具有很高的诊断性能。