抑郁合并失眠对大鼠HPA轴及下丘脑中氨基酸类和单胺类神经递质的影响
李春艳,王宇红,王 华, 赵洪庆,李姿蓉,杨 蕙,黄会珍
(湖南中医药大学 1.科技创新中心,2.第一附属医院,湖南 长沙 410208)
抑郁症是一种常见的精神疾病,慢性应激可能是其病因,研究表明大部分抑郁症患者伴有睡眠障碍[1]。睡眠障碍在慢性应激下导致失眠,同时,应激状态下的机体免疫功能下降,引发炎症反应,从而导致组织损伤。因此,失眠又是抑郁症的危险因素。此外,应激激活下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal,HPA),HPA轴亢进导致谷氨酸(glutamate,Glu)和γ-氨基丁酸(gamma-amino butyric acid,GABA)比例失调。HPA轴同时受多种神经递质和神经肽的调节,包括5-羟色胺(hydroxytryptamine,5-HT)能、去甲肾上腺素(Noradrenaline,NE)能和多巴胺(dopamine,DA)能等,HPA轴失调被认为与抑郁症的发生发展密切相关。另一方面,失眠与HPA轴的功能障碍密切相关,HPA轴的激活使促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)和皮质酮(corticosterone,CORT)的浓度增加,产生觉醒效应。下丘脑同时作为HPA轴负反馈调节的首要环节及内分泌系统和神经免疫系统的中心,当机体长期处于应激状态,导致HPA轴亢进,启动激素级联反应,引起系列分子的变化及脑部损伤,可能是抑郁失眠的发病机制。综上,本实验采用慢性不可预测轻度应激(chronic unpredictable mild stress,CUMS)联合睡眠剥夺(sleep deprivation,SD)建立大鼠抑郁症失眠模型,探索大鼠抑郁失眠的发病机制,为抑郁症失眠的机理阐明提供更多的数据。
1 材料与方法
1.1 动物SPF级SD雄性大鼠84只,体质量(180-200) g(湖南斯莱克景达实验动物有限公司),质量合格证号:1107271911001684,实验动物许可证号:SCXK(湘)2016-0002。实验单位为湖南中医药大学第一附属医院实验动物中心SPF级动物房,设施使用许可证编号:SYXK(湘)2015-0003。
1.2 试剂CORT,ACTH,CRH酶联免疫试剂盒(均为20191205,JINGTIAN);去甲肾上腺素,多巴胺盐酸盐,5-羟色胺盐酸盐标准品(B24713,B25300,B21833,上海源叶生物科技有限公司);TRIzol(152105,美国ambion公司);cDNA Synthesis Kit(00760266,Thermo Scientific);SYBR qPCR SuperMix Plus(0516511,Novoprotein);GABAAR,GABABR,GAD67,GAPDH兔抗大鼠多克隆抗体,羊抗兔二抗(bs-4112R,bs-1293R,bs-1302R,bs-2188R,bs-0295G,北京bioss公司);兔抗CREB多克隆抗体(ab32515,英国Abcam公司);兔抗CaMKⅡ多克隆抗体(3362S,cell signaling technology);ECL试剂盒(Multi Sciences)。
1.3 主要仪器MK3型酶标仪(美国Thermo Scientific公司),湖南中医药大学科技创新中心自制睡眠剥夺台,超微量核酸蛋白浓度测定仪(英国Bio Drop公司),ECO型PCR扩增仪(美国illumina公司),1260型高效液相色谱仪(美国Aglient公司),ECD电化学检测器(荷兰Antec公司),Chemi Doc XRS+Imager型化学发光系统(美国BIO-RAD公司)。
1.4 分组和造模分组,分为7组:慢性不可预测轻度应激组(CUMS)、72 h睡眠剥夺组(72 h SD)、慢性不可预测轻度应激+72 h睡眠剥夺组(CUMS+72 h SD)、21 d睡眠剥夺组(21 d SD)、慢性不可预测轻度应激+21 d睡眠剥夺组(CUMS+21 d SD)、空白对照组和环境对照组。
造模,适应性5 d后,d 6开始为造模d 1,造模前14 dCUMS、CUMS+72 h SD、CUMS+21 d SD 3组均进行CUMS造模。造模d 15-35开始SD造模,其中21 d SD组每天15:00至隔天9:00进行18 h SD[2],连续21 d;72 h SD组于造模最后3 d进行连续72 h SD[3];两个复合模型组在进行失眠造模期间均不间断抑郁造模。分别于抑郁造模14 d后和复合造模结束后对各组大鼠进行行为学检测。CUMS具体方法为:每只大鼠孤笼饲养和应激造模,包括禁食、4 ℃冰水环境、倾笼、噪音、潮湿垫料、昼夜颠倒、足底电击、禁水、夹尾。每天一种刺激,每种刺激3 d内不重复。
1.5 行为学实验开野实验:将大鼠置于敞箱中,适应30 s后记录大鼠在4 min内的活动情况。每当其爬行过1格或上肢攀附在箱壁上1次,则加1分,最后以总分进行数据统计。
强迫游泳实验:将大鼠放入水缸中适应30 s后测试4 min内大鼠的不动时间。四肢均保持不动或稍微运动,即记为游泳不动时间,以此来评价每组大鼠的绝望状态。
糖水偏好实验:禁食禁水24 h后进行,计算1 h内大鼠蔗糖水消耗量,根据每组大鼠的糖水平均消耗率来判断其快感缺失程度。
1.6 酶联免疫分析测定血清和下丘脑中HPA轴指标和氨基酸类神经递含量使用大鼠CRH、ACTH、CORT、Glu和GABA的ELISA试剂盒(均为20191205,JINGTIAN),分别测定血清中CRH、ACTH、CORT和下丘脑中Glu、GABA的含量。
1.7 HPLC-ECD法测定单胺类神经递质NE、DA、5-HT含量对冷冻保存的下丘脑用0.01 mol·L-1HClO4溶液进行前处理,匀浆后取上清备用。色谱条件:Quattro 4 C18色谱柱规格:柱长150 mm,直径为2.1 mm,填充颗粒为3 μm;流速:0.3 mL·min-1;柱温:35 ℃;样量:20 μL;流动相:单水磷酸二氢钠90 mmol·L-1、单水柠檬酸50 mmol·L-1、辛烷磺酸钠1.7 mmol·L-1、EDTA50 μmol·L-1,4种物质混合液 ∶甲醇=90 ∶10。将NE、DA、5-HT对照品配置成标准曲线。
1.8 HE染色观察下丘脑组织病理状态将下丘脑组织进行石蜡包埋,制成石蜡切片,然后脱蜡和水化。苏木精染色,自来水清洗,置于盐酸乙醇分化,并用纯水冲洗。乙醇伊红染色,纯水冲洗。之后脱水,再分别放入二甲苯Ⅰ、Ⅱ中透明。将切片取出,在组织上滴加中性树脂,盖上盖玻片,拍照。
1.9 Western blot检测下丘脑中GABA相关蛋白表达提取下丘脑总蛋白,然后进行电泳,常规转膜,5%脱脂奶粉封闭1.5-2.0 h,常规清洗,分别加入1 ∶800稀释的GABAAR、GABABR、GAD67抗体和1 ∶1 000稀释的CaMKⅡ、CREB、GAPDH抗体4 ℃过夜;加入1 ∶2 000稀释的二抗在室温下孵育1 h,洗涤,滴加ECL发光液成像。
1.10 RT-qPCR法检测下丘脑中GABA信号相关分子基因表达用TRIzol试剂提下丘脑组织的总RNA。测定RNA浓度和纯度,然后按照Thermo试剂盒进行逆转录。测定目的基因和内参β-actin的PCR产物Cq值。完成实验后,采用2-ΔΔCq法分析数据。使用Primer Premier 6.0软件自行设计引物,由上海生工生物工程有限公司合成,引物具体信息见Tab 1。
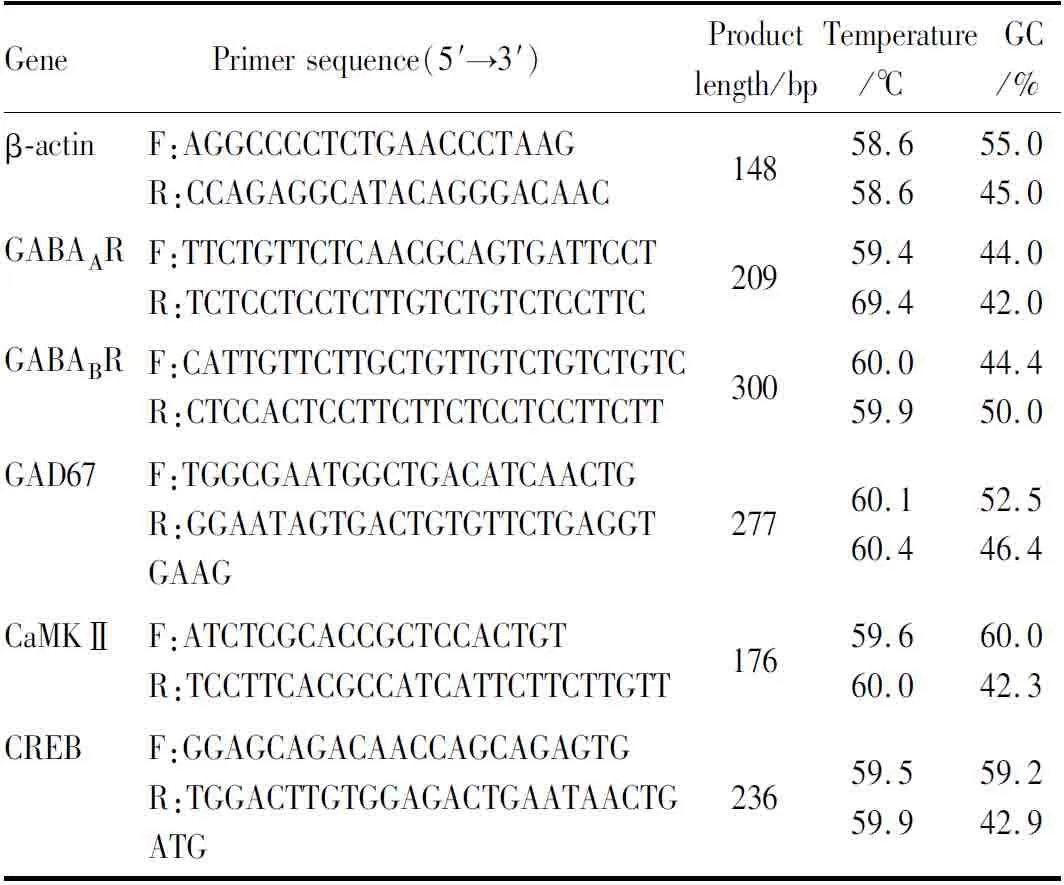
Tab 1 Primer sequences for qPCR

2 结果
2.1 大鼠日常行为观察和体质量结果日常行为:空白对照组大鼠在落水1-2次后便能较快找到小平台,适应新环境的能力较强;经过CUMS造模的各组大鼠落水4-5次后才能站在小平台上,且短暂停歇后会再次落水,适应新环境能力较差,可知慢性应激能够削弱动物的记忆认知能力。
体质量增长率:与空白对照比较,各模型组大鼠体质量增长率下降(P<0.05),尤以CUMS+21 d SD组下降明显;与CUMS组比较,CUMS+72 h组和CUMS+21 d SD组大鼠在造模后期体质量增长率下降;在造模后期,与CUMS+72 h组相比,CUMS+21 d SD组大鼠的体质量增长率是下降的(P<0.01),见Fig 1。
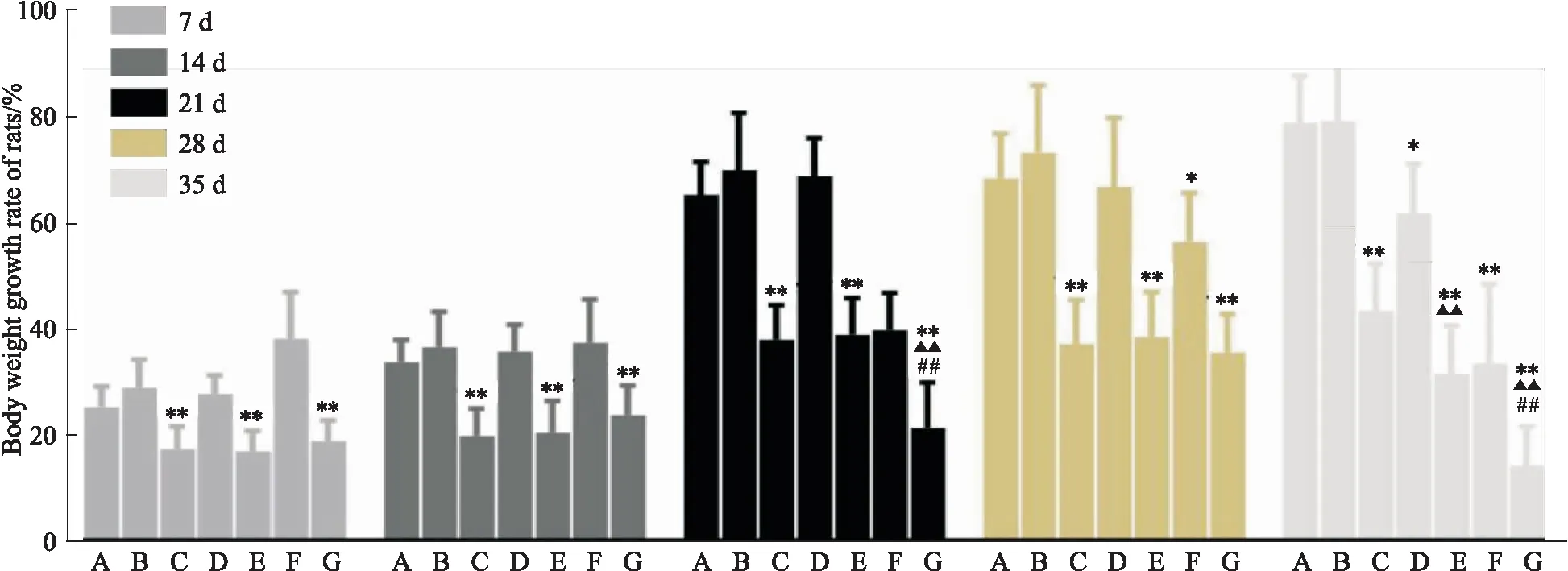
Fig 1 Body weight growth rate of
2.2 行为学实验结果
2.2.1开野实验 CUMS 14 d后:与空白组对照组相比,CUMS造模两周后,除单纯失眠组,各模型组大鼠均表现出了自主活动降低的趋势(P<0.01),说明大鼠已出现抑郁样情绪。
复合造模后:造模结束后,两个复合模型组大鼠自主活动次数和粪便粒数与空白对照组相比差异有显著性(P<0.05),复合造模大鼠比纯抑郁大鼠表现出更低的自主活动,见Tab 2。

Tab 2 Results of open field experiment after 14 days of CUMS modeling and end of composite model
2.2.2强迫游泳实验 CUMS 14 d后:与空白对照组相比较,经过CUMS造模的模型组大鼠不动时间显著增加(P<0.05)。
复合造模后:与空白组相比,各模型组动物不动时间增加(P<0.05);两个复合模型组不动时间变化虽差异无统计学意义,但CUMS+21 d SD组大鼠不动时间较长,说明长期慢性的应激失眠造模更能增加大鼠的绝望程度;与CUMS组相比,CUMS+21 d SD组大鼠不动时间有所增加,见Tab 3。

Tab 3 Results of forced swimming experiment after 14 days of CUMS modeling and end of composite
2.2.3糖水偏好实验 CUMS 14 d后:与空白对照组相比,经过14 d的CUMS,各造模组的平均糖水消耗率下降(P<0.01);表明经过一段时间的应激后,大鼠的快感有一定程度的缺失,表现出抑郁样情绪。
复合造模后:造模结束后,与空白对照组相比,各模型组糖水消耗率均下降(P<0.05);与CUMS组相比,CUMS+21 d SD组大鼠糖水消耗率有所下降,但差异无统计学意义;与CUMS+72 h SD组相比,CUMS+21 d SD组大鼠的糖水消耗率下降(P<0.05),见Tab 4。
Tab 4 Experimental results of sugar water consumption in CUMS modeling for 14 days and composite
2.3 复合造模后戊巴比妥钠翻正实验与空白对照组相比,各模型组大鼠睡眠潜伏期增长(P<0.05),睡眠时长缩短(P<0.01);与CUMS组相比,CUMS+21 d SD组大鼠的睡眠潜伏较长,睡眠时长变短,CUMS+72 h SD组大鼠则差异无显著性,见Tab 5。

Tab 5 Results of correction experiment at the end
2.4 ELISA测定HPA轴各指标和氨基酸类神经递质含量
2.4.1血清中HPA轴各指标含量 与空白对照组相比,各模型组大鼠血清中各激素含量均升高(P<0.05),CUMS+21 d SD组增加趋势最为明显;与CUMS组或CUMS+72 h SD组相比,CUMS+21 d SD组大鼠3个指标含量均增加(P<0.05),可推测长期睡眠不足更易加重抑郁状态下的HPA轴亢进,见Tab 6。
Tab 6 Changes in contents of CRH,ACTH,CORT in serum and hypothalamus of n=6; hypothalamus n=3)
2.4.2下丘脑中HPA轴各指标含量 与空白对照组相比,各模型组大鼠下丘脑中CRH、ACTH、CORT含量升高(P<0.05);与CUMS组相比,CUMS+21 d SD组CRH含量均增加(P<0.01),ACTH、CORT含量的增加虽无统计学意义,但趋势也较明显;与CUMS+72 h SD组比较,CUMS+21 d SD组HPA轴各指标含量均增加,见Tab 6。
2.4.3下丘脑中氨基酸类神经递质含量 与空白对照组相比,各模型组大鼠下丘脑Glu含量上升,GABA含量下降(P<0.05),其中两个复合模型组和21 d SD组的Glu/GABA失调(P<0.01);与CUMS组或CUMS+72 h SD组相比,CUMS+21 d SD组大鼠Glu和GABA含量变化明显(P<0.05),二者比例失调(P<0.05),见Tab 7。
Tab 7 Changes of Glu and GABA content in hypothalamus
2.5 HPLC-ECD法测定单胺类神经递质含量
下丘脑中NE、DA、5-HT含量,与空白对照组相比,各模型组大鼠下丘脑中3种单胺递质含量均下降(P<0.05);与CUMS组或CUMS+72 h SD组比较,CUMS+21 d SD组3种单胺递质的含量均降低(P<0.05),见Tab 8。HPLC-ECD检测3种单胺递质示例色谱图,见Fig 2。

Fig 2 Example chromatograms of different samples detected by HPLC-ECD
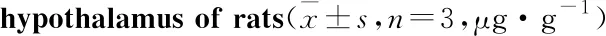
Tab 8 Changes of monoamine transmitter contents in
2.6 HE染色观察下丘脑组织病理状态空白对照组大鼠下丘脑细胞大小均匀,排列有序,细胞无空泡样现象;CUMS+72 h SD和CUMS+21 d SD组下丘脑神经元细胞形态结构损伤严重,尤以后者更为明显,细胞排列紊乱、间隙变大,胞体增大,空泡样性状明显,细胞形态病变,出现神经元丢失现象;对比72 h SD和21 d SD两组细胞,后者的病变程度更深,见Fig 3。

Fig 3 HE staining results of rat hypothalamus(×200)
2.7 Western blot检测下丘脑中GABA相关蛋白表达与空白对照组相比,各模型组大鼠下丘脑中GAD67、GABAAR、GABABR、CaMKⅡ、CREB蛋白灰度值均下降(P<0.05);与CUMS组比较,CUMS+21 d SD组各分子蛋白含量降低(P<0.01),而CUMS+72 h SD组则只有GAD67和CaMKⅡ的变化差异有显著性;与CUMS+72 h SD组比较,CUMS+21 d SD组大鼠下丘脑中GABA相关蛋白表达均降低(P<0.01或P<0.05),见Fig 4,5。
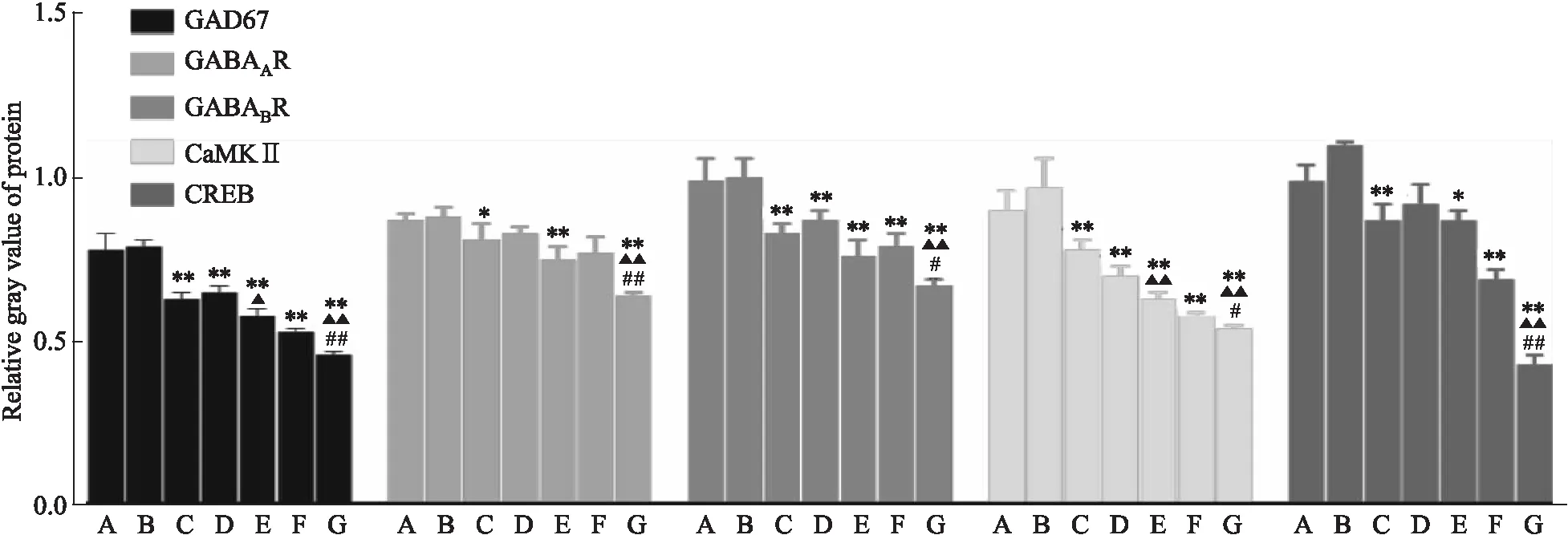
Fig 4 The gray value expression of GABA signal molecule protein in hypothalamus of
Fig 5 Expression of GABA signaling related molecules in hypothalamus of rats
2.8 RT-qPCR检测下丘脑中GABA相关基因表达与空白对照组相比,各模型组大鼠下丘脑中GAD67、GABAAR、GABABR、CaMKⅡ、CREB基因表达均下降(P<0.05);与CUMS组或CUMS+72 h SD组比较,CUMS+21 d SD组大鼠下丘脑中GABA相关分子基因表达量均下降(P<0.01),见Tab 9。
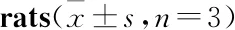
Tab 9 The gene expression of GABA signaling related molecules in hypothalamus of
3 讨论
目前,抑郁症中最常用的造模方法是慢性不可预测轻度应激,失眠的造模方法主要有化学试剂刺激法和物理应激法。化学试剂法易产生假阳性结果,同时对操作人员技术要求高[4]。物理应激法[5-6]包括强迫运动法、足休克法、轻柔刺激法、慢性束缚法和水平台法。对比研究,本实验选择水平台法,其共经历了单平台、多平台及改良多平台3个阶段,其中改良多平台睡眠剥夺法(modified multiple platform method,MMPM)应用更为普遍[7]。利用大鼠厌畏水的特性,在平台的周围注满水,水面距平台约1.0 cm。大鼠在平台上可以自行进食饮水,若其睡眠,则由于肌张力松弛而落入水中,需重新振作精神爬上平台,如此反复达到选择性剥夺快动眼睡眠(rapid eye movement sleep,REMS)的效果。抑郁症状态下的睡眠质量变差最显著表现在REMS潜伏期缩短、密度增加,因此采用REMS剥夺更贴近人类患病特点。一般采用72 h的短期快速睡眠剥夺,或者每天剥夺10-18 h连续2-3周的长期慢性睡眠剥夺[8-9]。结合本研究目的选择对比观察72 h快速睡眠剥夺,和每天造模18 h连续3周慢性睡眠剥夺这两种方式,最终确定最佳造模方式。因可使动物受到制动、浸水等刺激,设置环境对照组来排除干扰。
实验通过体质量增长率、摄食量、日常大鼠行为观察发现,CUMS+21 d SD组大鼠的体重增长率最低,摄食量减少程度最大。而通过糖水偏好、开野实验和强迫游泳行为学测试,发现各模型组大鼠快感显著缺失、自主活动下降及求生欲降低,其中以复合模型CUMS+21 d SD组明显。表明长时间失眠可使大鼠萎靡不振。此外,与空白组对比,戊巴比妥钠实验发现CUMS组大鼠睡眠潜伏期增长,睡眠时长显著缩短,表明抑郁症本身具有诱发失眠的倾向。但复合模型较纯抑郁组睡眠潜伏期更长,睡眠时长更短,同时慢性睡眠剥夺比快速睡眠剥夺效果更佳。通过环境对照组对比,发现周围环境的制动、浸水刺激对大鼠影响较小,基本可忽略。两个复合模型组较贴切地复制了抑郁症失眠的临床表征,CUMS+21 d SD组各方面数据优于CUMS+72 h SD组,更符合人类失眠发病缓慢、病程长等特点。因此,抑郁失眠模型可通过慢性轻度应激联合21 d睡眠剥夺来复制。
实验使用ELISA检测发现,抑郁症失眠大鼠血清和下丘脑中CRH、ACTH和CORT含量上升,下丘脑中Glu/GABA比例上升,大脑兴奋性毒性增加,GABA信号分子表达下降。而通过Western blot和RT-qPCR进一步验证了此想法,对于抑郁症失眠大鼠,其下丘脑中GABA相关分子GABAAR、GABABR、GAD67、CaMKⅡ、CREB的蛋白及基因表达显著下降,表明GABA相关分子表达被抑制,导致树突障碍和神经元存活率下降。HPLC-ECD发现下丘脑中单胺类神经递质NE、DA和5-HT显著减少。进一步通过HE染色观察下丘脑,发现神经元细胞形态结构损伤严重,细胞排列紊乱、间隙变大,胞体增大,空泡样性状显著,细胞形态病变,出现神经元丢失现象,表明抑郁症失眠大鼠下丘脑受损。总而言之,本实验研究发现,通过慢性应激联合睡眠剥夺可导致大鼠HPA轴亢进,使CRH、ACTH和CORT表达上升,下丘脑中单胺递质及氨基酸类神经递质表达发生改变,下丘脑神经元和突触受损,这些改变可能是抑郁合并失眠的发病机制。
抑郁与失眠均涉及神经内分泌的变化,下丘脑作为HPA轴负反馈调节的首要环节和神经内分泌中心,启动激素分泌,发挥其对HPA轴的调控作用[10]。GABA通过抑制兴奋性神经元,阻断Glu的兴奋毒性,二者比例失调被认为是抑郁症和失眠的重要因素。Glu增多导致的兴奋毒性可诱导抑郁样行为,而临床上抗失眠药物多是模拟GABA作用,增强受体与GABA的亲和力和GABA能神经元的传递作用,产生镇静催眠、抗焦虑等作用[11]。GABA能神经元广泛分布于下丘脑视交叉上核区域[12],GAD67是其直接标记物[13],脑内主要分布的是GABAA和GABAB受体。GABABR介导未成熟神经元兴奋,进而激活CaMKII,磷酸化CREB结合位点,从而促进树突成熟与神经元存活[14]。在应激状态下,HPA轴亢进,ACTH和GC分泌过度,GC进一步诱导Glu释放和兴奋性传递异常增强,导致Glu/GABA比例增大,GABA相关信号被抑制,引起神经毒性,损伤下丘脑,反过来加重抑郁失眠的发生发展[15]。单胺递质假说是抑郁症发病机制中最为经典的一种,同时与失眠的发生发展密切相关,对于睡眠-觉醒节律的调节具有重要意义,Menon等[16]使用微透析技术证明单胺递质及其代谢产物在不同时长的睡眠剥夺期间发挥着重要作用,同时HPA轴失调可导致单胺递质的改变[17]。
本实验通过建立抑郁失眠大鼠模型,研究其对HPA轴和下丘脑中氨基酸类和单胺类神经递质的影响,进一步探讨其发病机制。实验发现,抑郁合并失眠大鼠中存在HPA轴功能障碍,GABA/Glu比例失调,单胺类神经递质减少,同时结合他人研究,进一步推测HPA轴失调导致氨基酸类和单胺类神经递质的改变,可能是抑郁合并失眠的发病机制。另外,本实验因时间技术有限,未对抑郁症失眠大鼠进行睡眠监测,其造模期间脑电波的活动特征能反应出大鼠的睡眠状态,这值得下一步深入探讨。

