长链非编码RNA Kcnq1ot1对小鼠糖尿病心肌病的作用
杨 帆,王丽宏
(1. 南京大学医学院附属鼓楼医院内分泌科,江苏 南京 210008;2. 哈尔滨医科大学附属第二医院内分泌科,黑龙江 哈尔滨 150001)
糖尿病已经成为危害公共健康的全球性问题,成为威胁人类健康的“第三大杀手”。流行病学调查显示,糖尿病患者发生心力衰竭的风险明显高于正常人,超过50%-80%糖尿病患者最终死于糖尿病的心血管并发症[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的一个重要心血管并发症,是导致糖尿病患者出现心衰、恶性心律失常、猝死的重要原因之一。目前尚缺乏治疗DCM的有效办法,因此,积极探索DCM的发病机制、寻找新的治疗靶点,对DCM的防治无疑具有重要的科学意义。
焦亡是与炎症相关的细胞程序性死亡,可触发细胞膜孔形成,促进胞质促炎因子的释放和细胞裂解[2]。焦亡过程中,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)可募集并与含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase-1,caspase-1)的前体(pro-caspase-1)相互作用,形成NLRP3炎性体并促进pro-caspase-1的自催化裂解,产生活化的caspase-1,后者可将pro-IL-1β和pro-IL-18加工为成熟体IL-1β和IL-18。同时,活化的caspase-1可以将消皮素D(gasdermin D,GSDMD)切割成两个片段,产生的氨基末端片段通过其成孔作用破坏细胞膜,促进细胞焦亡[3]。以往的研究表明,焦亡在DCM中激活,抑制焦亡后糖尿病动物模型心脏形态和功能明显改善[4-6]。值得注意的是,焦亡与心肌纤维化密切相关:IL-1β和IL-18激活可以促进氧化应激,导致成纤维细胞增殖和胶原的产生。然而,目前关于DCM心肌纤维化与焦亡的调控机制尚未完全阐明。
长链非编码RNA(long non-coding RNA,lncRNA)是一种转录本长度 > 200个核苷酸的非编码RNA,不能编码蛋白质,但可以在表观遗传学、转录及转录后水平调控基因的表达,参与多种病理生理过程。LncRNA Kcnq1ot1与多种心脏疾病密切相关,包括急性心肌损伤和心律失常等[7-8]。然而,Kcnq1ot1在DCM中的作用及机制尚不清楚。本研究的主要目的是阐明lncRNA Kcnq1ot1对DCM心肌焦亡、炎症和纤维化的调控作用,为DCM提供了新的思路和潜在的治疗靶点。
1 材料与方法
1.1 实验动物C57BL/6小鼠(18-20)g,♂,购于哈尔滨医科大学实验动物中心,许可证号 SCXK(黑)2019-001,在哈尔滨医科大学北方医学转化中心动物饲养房喂养。专人饲养,自由进食、自由进水。动物饲养房在标准状态下,温度维持在(23±1)℃,湿度维持在(55±5)%,通风状态良好,每天光照12 h、黑暗12 h交替进行。实验过程严格遵守中国《实验动物福利伦理审查指南》和美国《实验动物饲养管理和使用指南》(第8版),并通过哈尔滨医科大学伦理委员会批准。
1.2 试剂链脲佐菌素(北京索来宝),货号:S8050;慢病毒(中国上海吉玛),货号:P4240-100UG;TRIzol(美国Invitrogen),货号:15596026;ReverTra Ace qPCR RT kit(日本Toyobo),货号:FSQ-101;SYBR qPCR Mix(日本Toyobo),货号:QPK-201;RIPA裂解液(美国Thermo),货号:FNN0011;蛋白酶和磷酸酶抑制剂(瑞士Roche),货号:5892791001;蛋白Marker(美国Thermo),货号:J449-0.8ML;ECL显色液(中国Tanon),货号:180-5001;BCA试剂盒(中国碧云天),货号:P0009;PVDF 膜(美国Millipore),货号:ISEQ00010;山羊抗兔、抗鼠IgG二抗(美国Invitrogen),货号:AAT-16720;NLRP3、caspase-1、IL-1β、GSDMD-N、collagen Ⅰ 、collagen Ⅲ、TGF-β1、p-Smad2/3、Smad2/3抗体(美国CST),货号:15101、2255、12703、3642、72026、30565S、3108、5336、9520、5339、9523;GAPDH抗体(中国ZSGB-BIO),货号:TA-08。
1.3 仪器7500 Fast实时定量PCR仪(美国ABI);Odyssey成像系统(美国LI-COR);冰冻切片机(德国Leica);高分辨率小动物超声成像系统(加拿大VisualSonics);电子血糖仪及试纸(德国罗氏);台式低速冷冻离心机(中国奥盛仪器);转移电泳槽和电泳仪(美国Bio-Rad)。
1.4 动物模型的制备和分组6-8周龄雄性C57BL/6小鼠,体质量(18-20)g,适应性喂养1周。1周后将小鼠随机分组,分别为正常组(control组)、糖尿病组(DM组)、糖尿病小鼠注射Kcnq1ot1-shRNA慢病毒组(DM+Kcnq1ot1-shRNA组)和糖尿病小鼠注射对照Scr-shRNA慢病毒组(DM+Scr-shRNA组)。采用小剂量多次连续腹腔注射链脲佐菌素(streptozocin,STZ)方法建立糖尿病模型,STZ溶于柠檬酸盐缓冲液(pH 4.2)中,50 mg · kg-1·d-1连续腹腔内注射5 d,正常对照组给予等体积的柠檬酸盐缓冲液注射,最后一次注射72 h后,尾静脉采血检测空腹血糖>16.7 mmol·L-1则糖尿病造模成功。随后,小鼠尾静脉注射Kcnq1ot1-shRNA慢病毒,建立动物体内干扰Kcnq1ot1模型;DM+Scr-shRNA组注射对照Scr-shRNA慢病毒,control组和DM组注射等剂量的生理盐水。合成Kcnq1ot1-shRNA慢病毒。1×1012TU ·L-1慢病毒溶于50 μL生理盐水,小鼠尾静脉注射[9]。Kcnq1ot1-shRNA的序列为5′-GGTAGAATAGTTCTGTCTT-3′。经尾静脉给予小鼠上述药物后继续喂养8周,建立DCM模型。
1.5 超声心动图检测小鼠腹腔注射10%的水合氯醛进行麻醉,应用高清小动物超声成像系统Vevo1100留取左室长轴二维超声图像,计算左室射血分数(ejection fraction,EF%)和短轴缩短率(fractional shortening,FS%)。
1.6 HE染色制备石蜡切片。将石蜡切片脱蜡,蒸馏水洗涤,给予HE染色,流水冲洗30 s,梯度乙醇及二甲苯浸泡,处理后封片、晾干,留取HE染色图像,观察心肌形态。
1.7 Masson染色石蜡切片脱蜡至水,洗涤后给予Masson染色剂染色,0.2%冰醋酸洗涤并用0.1%磷钨酸分化,亮绿染液染色,待纤维化病灶染至淡绿色用0.2%冰醋酸洗涤,梯度酒精脱水,处理后封片、晾干,留取Masson染色图像,观察心肌纤维化程度。
1.8 RNA提取和实时定量PCR取小鼠的左心室组织,TRIzol提取总RNA,测定RNA浓度和纯度,应用Toyobo逆转录试剂盒逆转录为cDNA,反应程序为 37 ℃ 15 min,98 ℃ 5 min,4 ℃ Holding。应用Toyobo SYBR qPCR Mix试剂盒进行qRT-PCR。以GAPDH为内参,采用2-ΔΔCt法计算目的基因相对含量。主要引物序列如Tab 1所示。

Tab 1 Specific primer sequences for qRT-PCR
1.9 蛋白质印迹分析用RIPA裂解液提取心脏组织蛋白,BCA法检测蛋白浓度,并上样、电泳、转膜,分别加入NLRP3(1 ∶800)、caspase-1(1 ∶500)、IL-1β(1 ∶800)、GSDMD-N(1 ∶500)、collagen Ⅰ(1 ∶1 000)、collagen Ⅲ(1 ∶1 000)、TGF-β1(1 ∶800)、p-smad2/3(1 ∶800)、smad2/3(1 ∶800)、GAPDH(1 ∶ 2 000)一抗,4 ℃过夜,TBST洗膜加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶2 500)二抗,37 ℃孵育1 h,ECL显色,拍照。
1.10 免疫组织化学染色将小鼠左心室组织放入4%多聚甲醛中固定、包埋、冰冻,切成5 μm的薄片置于载玻片,4%多聚甲醛固定20 min,穿透液穿透1 h。山羊血清封闭2 h,加入NLRP3、caspase-1、IL-1β和GSDMD-N一抗(1 ∶200),4 ℃过夜,二抗湿盒中常温孵育1 h,加入DAPI,室温下静置30 min,显微镜观察。

2 结果
2.1 糖尿病小鼠干扰Kcnq1ot1的表达本实验构建DCM的动物模型,通过对C57BL/6小鼠尾静脉病毒注射实现体内干扰Kcnq1ot,每组5只。qRT-PCR检测发现,与对照组相比,Kcnq1ot1在糖尿病小鼠的心脏组织明显升高,给予Kcnq1ot1-shRNA后被明显抑制(Fig 1)。
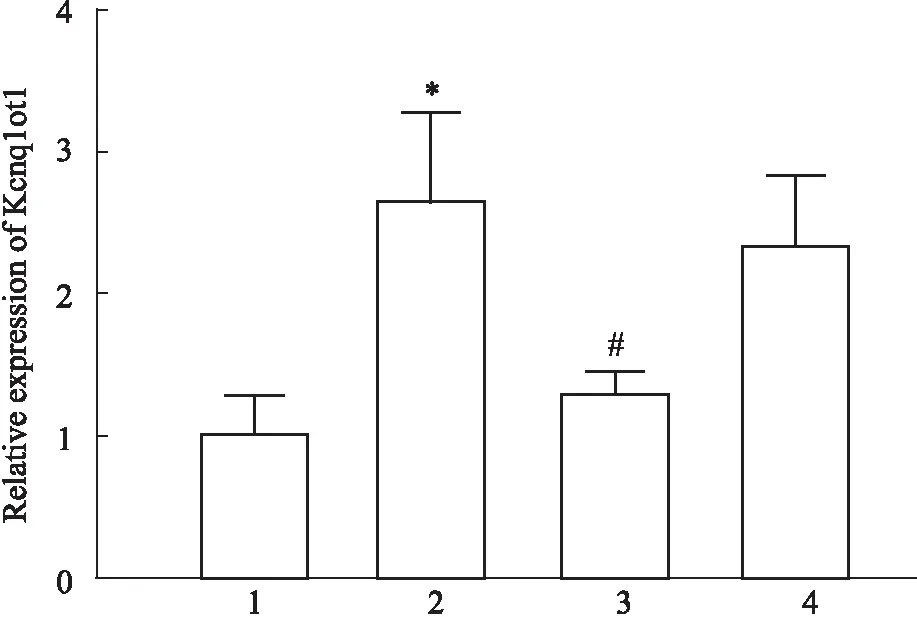
Fig 1 Silencing Kcnq1ot1 in
2.2 干扰Kcnq1ot1对糖尿病小鼠心脏功能的影响为了研究Kcnq1ot1对糖尿病小鼠心脏功能的影响,将各组小鼠麻醉后进行超声心动图检测。结果表明,与对照组相比,DM组小鼠左心室功能明显减退,表现为心脏收缩和舒张功能下降,EF和FS明显降低;体内干扰Kcnq1ot1后,糖尿病小鼠心脏功能明显改善(Fig 2A-C)。

Fig 2 Cardiac function attenuated by silencing Kcnq1ot1 in diabetic mice
2.3 干扰Kcnq1ot1对糖尿病小鼠心脏结构的影响采用HE染色和Masson染色的方法评价各组小鼠的心脏形态学改变和纤维化程度。HE染色结果表明,与对照组相比,糖尿病小鼠左心室心肌细胞肥大,排列紊乱;干扰Kcnq1ot1后,心肌细胞肥大减轻(Fig 3A)。Masson染色结果表明,糖尿病小鼠左心室胶原沉积增多,心肌纤维化加重;干扰Kcnq1ot1后,胶原沉积减少,纤维化改善(Fig 3B)。
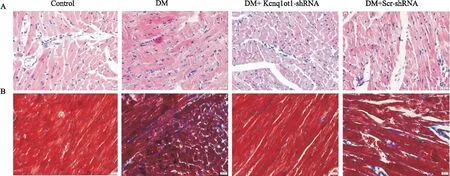
Fig 3 Cardiac structure attenuated by silencing Kcnq1ot1 in diabetic mice(n=5)
2.4 干扰Kcnq1ot1对糖尿病小鼠心脏胶原的影响为进一步探讨lncRNA Kcnq1ot1对糖尿病小鼠心肌纤维化的调控作用,应用Western blot方法检测心脏胶原的表达情况。实验结果表明,DM组小鼠心脏组织collagen Ⅰ和collagen Ⅲ蛋白表达水平明显升高,DM+Kcnq1ot1-shRNA组胶原表达减少(Fig 4)。上述结果说明,干扰Kcnq1ot1可减少糖尿病小鼠心肌胶原沉积。

Fig 4 Cardiac collagen deposition attenuated by silencing Kcnq1ot1 in diabetic
2.5 干扰Kcnq1ot1对糖尿病小鼠心脏TGF-β1/Smads通路的影响我们进一步检测纤维化相关的TGF-βl/Smads信号转导通路的表达情况。结果表明,与对照组相比,DM组小鼠心脏组织TGF-β1、p-Smad2和p-Smad3蛋白表达水平明显升高,DM+Kcnq1ot1-shRNA组上述蛋白表达显著减少(Fig 5)。这说明干扰Kcnq1ot1可抑制糖尿病小鼠TGF-βl/Smads信号转导通路的激活,减少心肌胶原沉积。

Fig 5 TGF-β1/Smads pathway in cardiac tissues of diabetic mice attenuated by silencing
2.6 干扰Kcnq1ot1对糖尿病小鼠心脏焦亡的影响为研究Kcnq1ot1对糖尿病小鼠心肌焦亡的影响,采用免疫组化、qRT-PCR和Western blot方法检测各组小鼠心脏组织中NLRP3、caspase-1、IL-1β和GSDMD-N的表达水平。免疫组化分析表明,与对照组相比,DM组小鼠心脏组织NLRP3、caspase-1和IL-1β表达提高,DM+Kcnq1ot1-shRNA组NLRP3、caspase-1和IL-1β表达减少(Fig 6A)。同时,各组NLRP3、caspase-1和IL-1β的mRNA和蛋白表达水平也表现为相似的趋势(Fig 6B-E)。此外,糖尿病小鼠心脏组织GSDMD-N的蛋白表达明显增多,然而抑制Kcnq1ot1后,其表达下调(Fig 6A、E)。这些结果表明,干扰Kcnq1ot1可抑制糖尿病小鼠心脏焦亡的激活。

Fig 6 Kcnq1ot1 involved in regulation of pyroptosis in vivo
3 讨论
DCM是DM的一种慢性进展性的心血管并发症,主要是由于DM引起心肌纤维化、心脏结构改变、舒张功能异常,进而引发收缩功能障碍[10]。LncRNA能够在表观遗传学、转录及转录后水平调控多种疾病。Kcnq1ot1是一种lncRNA,能够调控包括心脏疾病在内的多种疾病,然而Kcnq1ot1在DCM的表达及调控机制尚不清楚。本研究发现,Kcnq1ot1在STZ诱导的C57BL/6小鼠左心室组织中表达明显增多。DM小鼠体内干扰Kcnq1ot1后能够改善心脏功能并减轻心肌纤维化。因此,本实验阐明了Kcnq1ot1在DCM中的关键作用,可能作为DCM早期诊断的生物学标志物,揭示了lncRNA可以作为DCM的治疗靶点。
随着对糖尿病及其并发症研究的不断进展,对DCM的研究已经深入到基因水平。目前已经发现多种ncRNA能够调控DCM的发生发展,如miRNA、lncRNA和circRNA等[11]。其中,lncRNA可以在DCM病理过程中通过不同机制调节基因的表达。例如,lncRNA H19在DCM中下调,可通过调控miR-675和VDAC1影响细胞凋亡[12]。LncRNA MIAT在高糖处理的心肌细胞和STZ诱导的糖尿病小鼠中表达上调,可以靶向结合miR-22-3p调控DAPK2的表达[13]。LncRNA Kcnq1ot1是一种非编码RNA,参与调控多个目的基因的转录以促进正常的生长和发育。以往的研究表明,Kcnq1ot1与多种疾病相关,包括长QT综合征、白内障、肿瘤和心肌缺血/再灌注损伤[14-16]。然而,Kcnq1ot1和DM及其并发症之间的关系鲜有报道。在本研究中,我们的结果表明lncRNA Kcnq1ot1在STZ诱导的DM小鼠的心脏组织中表达明显增多。抑制Kcnq1ot1能够明显抑制caspase-1的表达。本研究阐明了Kcnq1ot1在DCM模型中的差异性表达及作用。
以往的研究已经表明,焦亡参与DCM的发生和进展。高糖环境能够激活细胞的ROS,激活NLRP3炎症小体,促进caspase-1的剪切,从而加速IL-1β和IL-18的释放。caspase-1是焦亡过程中的关键因子,能够调控炎症细胞因子的成熟[17]。在本研究中,我们发现干扰Kcnq1ot1后,caspase-1和其下游的炎症因子IL-1β被显著抑制。值得强调的是,焦亡与炎症密不可分,而炎症是很多病理过程的共同机制和中心环节,是多种疾病的发病基础。糖尿病患者长期处于慢性炎症状态,炎症反应也是DCM发生和进展的关键因素。多项研究表明,IL-1β与TGF-β1/Smads通路介导的心肌纤维化密切相关[18]。本研究阐明了干扰Kcnq1ot1可以通过抑制炎症因子从而减少胶原沉积,改善心肌纤维化。
综上所述,我们首次发现Kcnq1ot1在体内DCM模型中表达增多,下调Kcnq1ot1通过NLRP3/caspase-1/TGF-β1通路改善心肌焦亡和纤维化。我们的研究阐明了Kcnq1ot1在DCM中的表达及功能,并提出了一种基于非编码RNA调控的治疗DCM的新方法。

