紫云英苷通过NOX2/ROS/NF-κB信号通路抑制哮喘气道炎症
马小斐, 刘函晔,王丹丹,宋艺兰,延光海,李良昌
(吉林省过敏性常见疾病免疫与靶向研究重点实验室,延边大学医学院,吉林 延吉 133002)
哮喘(asthma)是一种慢性炎症性疾病。Th2类细胞因子如白介素(interleukin,IL)4、5和13等促进IgE生成和炎症细胞浸润导致过敏性哮喘的发生。哮喘的治疗通常使用皮质类固醇药物,长期激素类药物的应用会导致一系列不良反应,因此需要寻找更安全有效的哮喘治疗药物。
紫云英苷(astragalin,AG)是百蕊草、黄芪等多种传统药用植物的生物活性成分,近年来研究表明其具有明显的抗炎作用。在脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤模型小鼠中发现紫云英苷能明显降低TNF-α、IL-1β和IL-6的水平[1],减轻氧化应激并抑制卡拉胶诱导的足肿胀模型小鼠炎症反应[2],抑制LPS诱导巨噬细胞的核转录因子κB(nuclear factor kappa B,NF-κB)激活和炎症介质释放[3],也有研究报道紫云英苷通过降低细胞因子信号抑制物-3(suppressor of cytokine signaling-3,SOCS-3)抑制Th2细胞因子介导的哮喘气道炎症[4]。虽然紫云英苷抗哮喘等炎症的作用已经被证实,但从氧化应激方面探讨其抗哮喘作用的研究却没有被深入阐述。本论文旨在确定紫云英苷通过NOX2/ROS/NF-κB抑制哮喘氧化应激和气道炎症。
1 材料与方法
1.1 实验材料、试剂
1.1.1实验动物 清洁级BALB/c小鼠50只,♂,6-8周龄,购自延边大学实验动物中心,合格证号为:SCXK(吉)2017-0003。正常饮食,室温下饲养。一切动物实验均通过延边大学医学院医学伦理审查,遵循相关动物保护法。
1.1.2实验试剂 紫云英苷(MCE公司,货号:HY-N0015),OVA(美国Sigma,货号:A3782),氢氧化铝凝胶(美国Sigma,货号:1017502);活性氧(reactive oxygen species,ROS)检测DCFH-DA探针(碧云天公司,货号:S0033S);超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(南京建成公司,货号:A001-3-2),丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成公司,货号:A003-1-2);IL-4(货号: BMS613)、IL-5(货号:BMS610)、IL-13(货号:BMS6015)的ELISA试剂盒(Invitrogen,美国);IL-4(sc-53084)、IL-5(sc-398334)、p47phox(sc-17845)、p-IκBα(sc-8404)、p-NF-κB p65(sc-166748)抗体(Sant Cruz,美国);NADPH氧化酶2(NOX2)(ab129068)、IL-13(ab108501)、IκBα(ab32518)、NF-κB p65(ab16502)和β-actin(ab8226)抗体(abcam,英国)。
1.2 实验方法
1.2.1小鼠哮喘模型制备 小鼠分5组:正常(Normal),哮喘(Model),紫云英苷低(AG 25),中(AG 50)和高(AG 100)剂量组,每组10只。每组小鼠在d1和d14腹腔注射OVA(10 μg)和氢氧化铝(1 mg)悬浊液200 μL致敏,在d21-23,模型小鼠用OVA(0.1 g)生理盐水混合液10 mL雾化吸入,吸入时间持续30 min,正常小鼠用生理盐水代替。紫云英苷组在激发前1h分别按25,50和100 mg·kg-1灌胃治疗。
1.2.2收集实验 最后一次激发24 h后处死小鼠,暴露气管,将1 mL生理盐水注入气管后回抽获取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),离心取上清用于ELISA检测,沉淀再悬浮,取200 μL甩片后Diff-Quik染色。小鼠左肺上叶固定后石蜡包埋。其余肺叶提取蛋白。
1.2.3BALF中细胞因子测定 ELISA法检测BALF中IL-4、IL-5、IL-13等细胞因子的水平。实验操作参照说明书。
1.2.4小鼠肺切片HE染色 石蜡包埋的肺组织5 μm连续切片,脱蜡后HE染色,观察小鼠肺部炎症变化。
1.2.5ROS、MDA 和SOD含量检测 500 mg右肺组织匀浆后制备细胞悬液,按照说明书装载DCFH-DA探针,流式细胞仪上机检测ROS水平。实验操作参照说明书。 比色法检测MDA和SOD水平。
1.2.6Western blot 肺组织加适量的RIPA裂解液进行裂解,放置冰上后每10 min震荡1次,30 min后10 000g离心取上清,测定蛋白浓度后上样。110 V恒压分离蛋白,300 mA恒流电转至PVDF膜上。5%脱脂奶粉封闭PVDF膜,TBST洗膜后加入 IL-4、IL-5、IL-13、NOX2、p47phox、IκBα、NF-κB p65和β-actin一抗(1 ∶1 000稀释)4 ℃过夜。d 2,TBST洗膜后用HRP标记的二抗室温孵育2 h。ECL发光后AI600凝胶成像仪进行摄像分析。

2 结果
2.1 紫云英苷对哮喘小鼠BALF中炎症细胞的影响对各组小鼠BALF炎症细胞进行计数,结果表明:与正常组小鼠相比,模型组小鼠炎性细胞总数,嗜酸性粒细胞、中性粒细胞和淋巴细胞数量明显升高(P<0.05),紫云英苷中、高剂量组能降低哮喘小鼠炎症细胞和细胞总数(P<0.05),而且随着紫云英苷剂量的增加,细胞总数,嗜酸性粒细胞、中性粒细胞和淋巴细胞数量明显下降,见Tab 1。
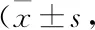
Tab 1 Effect of astragalin on cell numbers and compositions in BALF of asthmatic mice n=10,×107·L-1)
2.2 紫云英苷对哮喘小鼠BALF和肺组织中IL-4,IL-5和IL-13影响ELISA结果可见:与正常组相比,模型组小鼠BALF中IL-4,IL-5和IL-13含量明显增加,差异具有统计学意义(P<0.05);紫云英苷中、高剂量能够降低哮喘小鼠IL-4,IL-5和IL-13水平,差异具有统计学意义(P<0.05),见Tab 2。并且ELISA结果与Western blot结果一致,见Fig 1。提示紫云英苷能够改善OVA诱导的哮喘小鼠Th2炎症反应。

Fig 1 Effect of astragalin on IL-4, IL-5 and IL-13 expressions in lung tissues of asthmatic mice
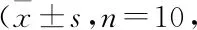
Tab 2 Effect of astragalin on IL-4, IL-5 and IL-13 levels in BALF of asthmatic mice ng·L-1)
2.3 紫云英苷对哮喘小鼠肺部炎症的影响正常组小鼠气道上皮排列整齐,气道周围未见炎症细胞聚集。但模型组小鼠气道上皮排列不规则,可见上皮细胞的肿胀和脱落,气道周围可见大量的炎症细胞。而紫云英苷中、高剂量组能减少气道周围炎细胞数量,保持气道上皮完整,见Fig 2。
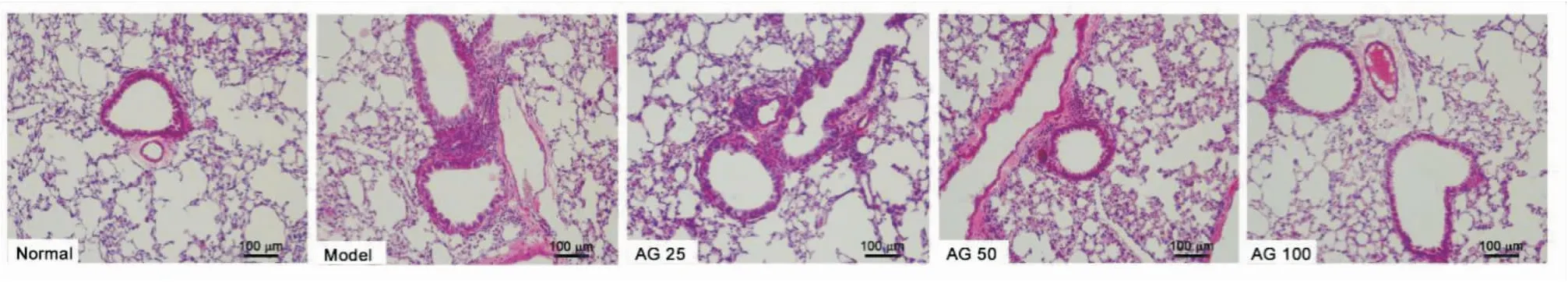
Fig 2 Effect of astragalin on pulmonary inflammation in asthmatic mice(bar=100 μm)
2.4 紫云英苷对哮喘小鼠肺部氧化应激的影响与正常组相比,模型组小鼠肺部ROS和MDA水平升高,而抗氧化酶SOD的活性明显下降(P<0.05);紫云英苷中、高剂量组能够有效降低ROS和MDA的水平,提高SOD的活性(P<0.05)。提示紫云英苷能改善哮喘小鼠肺部氧化应激,见Fig 3。

Fig 3 Effect of astragalin on oxidative stress in lungs of asthmatic mice
2.5 紫云英苷对NOX2和p47phox表达的影响Western blot检测NOX2和p47phox表达,与正常组相比,模型组肺组织中NOX2和p47phox表达水平升高,差异有统计学意义(P<0.05)。中、高剂量紫云英苷处理后NOX2和p47phox表达明显降低,与模型组相比差异具有统计学意义(P<0.05),见Fig 4。

Fig 4 Effect of astragalin on NOX and p47phox expressions in lung tissues of asthmatic mice
2.6 紫云英苷对IκBα表达的影响与正常组相比,模型组肺组织中IκBα磷酸化水平升高,总IκBα表达水平降低,差异具有统计学意义(P<0.05)。而中、高剂量紫云英苷能抑制IκB磷酸化,提高总IκBα,与模型组相比差异具有统计学意义(P<0.05),见Fig 5。

Fig 5 Effect of astragalin on IκB in lung tissues of asthmatic mice
2.7 紫云英苷对NF-κB p65磷酸化的影响与正常组比较,模型组肺组织中NF-κB p65磷酸化水平升高,差异具有统计学意义(P<0.05)。而中、高剂量紫云英苷能有效抑制NF-κB p65磷酸化,与模型组比较差异具有统计学意义(P<0.05),见Fig 6。
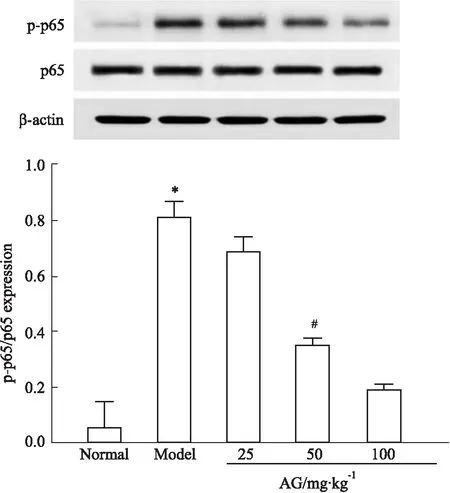
Fig 6 Effect of astragalin on NF-κB p65 phosphorylation in lung tissues of asthmatic mice
3 讨论
哮喘是以气道炎症为特征的过敏性疾病,在其发病机制中Th2细胞介导的Ⅰ型过敏起关键作用[5]。Th2细胞因子IL-4和IL-13能促进IgE产生,诱导气道高反应性;IL-5对嗜酸性粒细胞有明显的增殖和趋化作用[6]。调控Th2细胞因子水平可能是防治哮喘的有效手段。在确定紫云英苷对哮喘炎症的影响实验中,发现紫云英苷明显降低哮喘模型小鼠BALF嗜酸性粒细胞等炎症细胞数量;肺组织HE染色结果发现,紫云英苷能够减轻支气管及周围组织炎症细胞浸润。进一步观察紫云英苷对Th2细胞因子的影响,发现紫云英苷明显降低BALF和肺组织中IL-4、IL-5、IL-13的水平。这些结果提示,紫云英苷可能通过降低Th2细胞因子水平影响哮喘气道炎症。
ROS是氧化应激的重要的组成部分,参与机体的氧化平衡。NOX是除线粒体内膜呼吸链的另一个ROS重要来源。NOX2(gp91phox)是NOX家族中的一个重要亚型,其组分中结构亚基p22 phox和催化亚基NOX2形成的二聚体(即细胞色素b558),定位在细胞膜上。p47 phox、p67 phox和p40 phox亚基构成的复合体定位在胞质。信号级联触发后,p47 phox激活使胞质复合体转移至细胞膜,并与细胞色素b558结合形成有活性NOX2,催化生成ROS[7]。产生的ROS可被SOD等抗氧化系统清除。但病理条件下,抗氧化系统难以清除过多产生的ROS,引起脂质过氧化等一系列病理反应。研究表明,哮喘存在ROS的过量产生,过量产生ROS能够激活炎症细胞并促使气道上皮释放促炎细胞因子,加剧气道对过敏原的反应[8]。也有研究显示哮喘患者肺内ROS明显增加,并且增加的ROS破坏肺泡上皮和血管内皮的屏障功能,参与气道炎症和气道重塑[9]。敲除NOX2明显促进naive CD4 T向Th2细胞分化[10],并且在NOX-/-哮喘小鼠中,Th2细胞因子诱导的炎症明显加重[10-11]。本研究发现,紫云英苷能明显提高NOX2和p47phox表达,降低哮喘小鼠肺部ROS和MDA水平,提高SOD活性。暗示紫云英苷通过抑制NOX2-ROS途径改善哮喘小鼠肺部氧化应激。
NF-κB/Rel家族复合物是一种氧化还原敏感的转录因子[12]。NF-κB通常以p50和p65/RelA亚基的异二聚体形式存在。正常情况下,NF-κB与抑制性κB(IκB)结合并以非DNA结合形式定位在细胞质。各种NF-κB活化诱导剂刺激细胞后,IκBα丝氨酸残基迅速磷酸化,磷酸化的IκBα被 E3泛素连接酶泛素化,随后被26S蛋白酶体降解[11]。NF-κB从与IκBα组成的聚合体中释放,核转移位点暴露,NF-κB转移至细胞核并与基因启动子中的κB元件结合激活靶基因如IL-4、IL-5、IL-13等,发挥其炎症调控作用[13]。研究表明,灌服抗氧化剂OTC可显著减少NF-κB向胞核的移位,降低粘附分子、趋化因子和细胞因子的表达[14]。也有研究表明,ROS能够促进IκBα酪氨酸磷酸化(Tyr42)和PEST结构域磷酸化,诱导NF-κB p65(Ser529)磷酸化促使NF-κB核转位,激活NF-κB。本研究中也证明了紫云英苷降低ROS水平的同时,也能够明显抑制NF-κB的活化。综上所述,紫云英苷可能通过抑制NOX2/ROS/NF-κB信号通路减轻哮喘气道炎症。

