杨桃根DMDD调控ROS介导的自噬通路减轻糖尿病大鼠心肌损伤
马 静,吴娅妮,黄德伦,周艳平,侯柳婷,李亚坤,钟 静,韦晓洁
(1. 广西中医药大学基础医学院,广西 南宁 530299;2. 广西医科大学药学院,广西 南宁 530021)
糖尿病(diabetes mellitus,DM)是全球危害性最大的慢性疾病之一,而我国年龄标准化的DM发病率已高达10%[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是DM常见的、严重的并发症之一,也是导致DM患者死亡的主要原因[2]。长期高糖刺激可造成心肌细胞肥大、凋亡,引起心肌纤维化,导致心室收缩及舒张功能不全,最终形成心力衰竭[3]。由此可见,高糖所致的心肌细胞凋亡是诱发DCM的核心病理变化。DCM心肌细胞凋亡的发生机制复杂,目前认为与高糖引起的内质网应激、活性氧(reactive oxygen species,ROS)聚集及自噬紊乱有关[4]。
杨桃(AverrhoacarambolaL.)为酢浆草科五敛子属植物,在我国广泛分布于广西、广东、福建等地[5]。杨桃根茎是广西民间常用中药材。《中华本草》中记载,杨桃根具有行气活血、祛风止痛、涩精止带之功效。本课题组前期证实,杨桃根总提取物可改善DM大鼠糖脂代谢,抑制高糖诱发的氧化应激反应[6]。近期,我们从杨桃根中分离出一种单体成分,即2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮(DMDD),并初步证实该成分能减轻高糖所致的心肌细胞损伤,但其机制尚未完全明确。本研究采用高糖高脂饮食联合链脲佐菌素诱导建立DM大鼠模型,观察杨桃根DMDD对DM大鼠心脏功能、心肌细胞凋亡、ROS-自噬通路的影响,探讨杨桃根DMDD对DM大鼠心肌损伤的保护作用及机制。
1 材料与方法
1.1 实验动物SPF级成年SD大鼠共50只,♂,体质量(180±20)g,由广西医科大学实验动物中心提供,许可证号:SCXK桂2014-0002。
1.2 实验试剂杨桃根DMDD由本课题组自行制备;高糖高脂饲料购于北京博爱港生物技术有限公司;链脲佐菌素购于Sigma公司;ROS、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购于南京建成生物工程研究所;抗Beclin-1、LC3、Atg5、p-PI3K、PI3K、p-Akt、Akt、p-mTOR、mTOR、GAPDH抗体购于Abcam公司;TUNEL试剂盒购于上海碧云天生物技术有限公司。
1.3 分组与造模大鼠随机分为Control组、DM组、DMDD组(12.5、25.0、50.0 mg·kg-1),每组10只。经适应性喂养1周后,DM组、DMDD组给予高糖高脂饲料饲养4周,之后腹腔注射链脲佐菌素(120 mg·kg-1)1次,4周后随机血糖值≥16.7 mmol·L-1即判定2型糖尿病大鼠造模成功,本研究造模成功率为75%(30/40),失败模型予以替补;Control组仅给予普通饲料及灌胃等量生理盐水。DMDD组于造模成功后分别灌胃不同浓度DMDD,连续灌胃给药21 d,1次/d;Control组、DM组仅灌胃等量生理盐水。末次给药后,采集大鼠血样及心脏组织供后续试验。
1.4 血糖测定经尾尖采血,用血糖测定仪检测大鼠空腹血糖(fasting blood glucose,FBG)。
1.5 左心室功能评价10%水合氯醛(3 mL·kg-1)腹腔注射麻醉大鼠,使用Vevo 2100型小动物彩色超声诊断仪测定左室舒张末期压(left ventricular end-diastolic pressure,LVEDP)、左心室压峰值(left ventricular systolic pressure,LVSP)、左心室内压最大上升速率(maximum upstroke velocity of left ventricular pressure,+dp/dtmax)、左心室内压最大下降速率(maximum descent velocity of left ventricular pressure,-dp/dtmax)。
1.6 心肌形态变化取大鼠心肌组织,4%多聚甲醛固定,随后脱水、透明、浸蜡、包埋、切片,HE染色后于光镜下观察心肌组织病理学形态变化。
1.7 心肌细胞凋亡心肌组织经固定、脱水、石蜡包埋、切片后,参照TUNEL试剂盒说明书检测细胞凋亡,凋亡细胞核染成棕黄色,光镜下随机选5个视野,统计凋亡细胞数目,凋亡指数/%=(凋亡细胞数/总细胞数)×100%。
1.8 氧化应激指标检测取心肌组织加入4 ℃PBS研磨制备10%组织匀浆,3 000 r·min-1离心10 min取上清液,根据试剂盒说明书进行操作,SOD采用羟胺法检测,MDA采用 TBA法检测,ROS采用化学荧光法检测。
1.9 Western blot检测取50 mg心肌组织加入500 μL预冷RIPA裂解液,匀浆后离心取上清,BCA法检测蛋白浓度, 20 μg蛋白样品上样,行SDS-PAGE电泳,转膜至PVDF膜,5%脱脂奶粉封闭,一抗(Beclin-1 1 ∶500、LC3 1 ∶1 000、Atg5 1 ∶1 000、PI3K 1 ∶1 000、p-PI3K 1 ∶1 000、Akt 1 ∶1 000、p-Akt 1 ∶1 000、mTOR 1 ∶1 000、p-mTOR 1 ∶1 000、GAPDH 1 ∶ 2 000)4 ℃孵育过夜,洗膜后加入二抗(1 ∶5 000)室温孵育1 h,洗膜、ECL显色、曝光,ImageJ软件处理图像。

2 结果
2.1 DMDD对FBG和心功能指标的影响相较于Control组,DM组FBG、LVEDP明显增高,同时LVSP、+dp/dtmax、-dp/dtmax明显降低(P<0.05);相较于DM组,DMDD组FBG、LVEDP明显降低,同时LVSP、+dp/dtmax、-dp/dtmax明显增高(P<0.05),并呈剂量依赖性,见Tab 1。
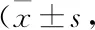
Tab 1 Comparison of FBG and cardiac function indexes in each group n=10)
2.2 DMDD对心肌组织结构的影响HE染色可见Control组大鼠心肌细胞形态结构完整,排列整齐、紧密;DM 组大鼠心肌细胞呈不规则排列,细胞间质增宽,并伴有细胞破碎、坏死,部分心肌纤维断裂;DMDD组大鼠心肌细胞排列稍紊乱,破碎、坏死细胞数量明显减少,纤维断裂减少(Fig 1)。
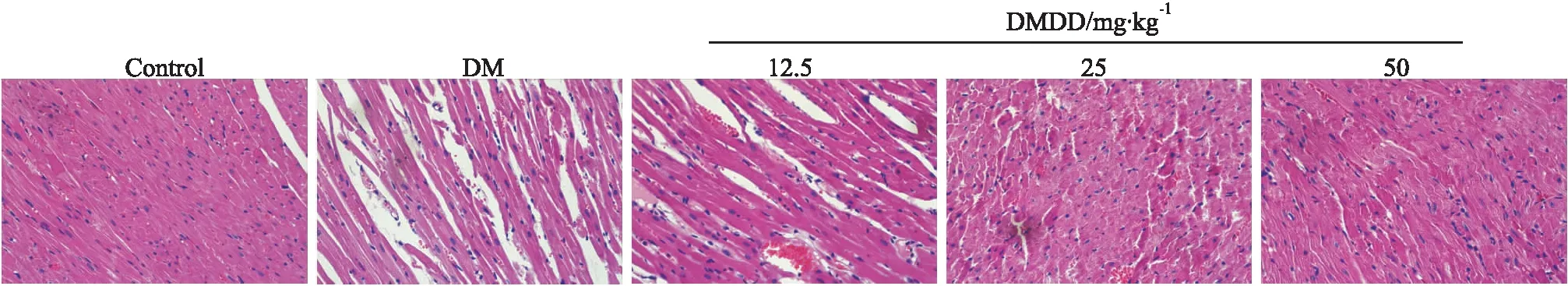
Fig 1 Myocardial morphology of rats in each group (HE×200)
2.3 DMDD对心肌凋亡的影响TUNEL染色可见,相较于Control组,DM组心肌细胞凋亡指数明显增高(P<0.05);相较于DM组,DMDD组心肌细胞凋亡指数明显降低(P<0.05),且呈明显剂量依赖性(Fig 2)。

Fig 2 Apoptosis of myocardial cells in each group n=10)
2.4 DMDD对心肌ROS、SOD及MDA水平的影响相较于Control组,DM组SOD水平明显降低,同时ROS、MDA水平明显增高(P<0.05);相较于DM组,DMDD组SOD水平明显增高,同时ROS、MDA水平明显降低(P<0.05),且呈明显剂量依赖性(Fig 3)。
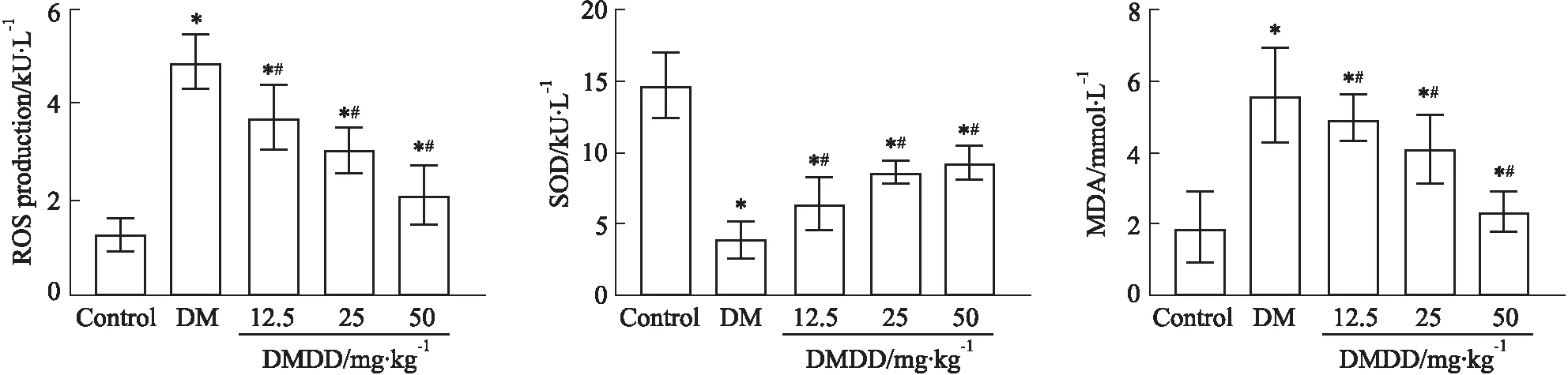
Fig 3 Comparison of ROS, SOD and MDA levels in myocardial tissues of rats in each group n=10)
2.5 DMDD对心肌Beclin-1、LC3、Atg5表达的影响相较于Control组,DM组Beclin-1、LC3 Ⅱ/Ⅰ、Atg5表达明显增高(P<0.05);相较于DM组,DMDD组Beclin-1、LC3 Ⅱ/I、Atg5表达明显降低(P<0.05),且呈明显剂量依赖性(Fig 4)。

Fig 4 Comparison of Beclin-1, LC3 and Atg5 expression in myocardial tissues of rats in each group n=10)
2.6 DMDD对心肌PI3K/Akt/mTOR通路的影响相较于Control组,DM组p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR明显降低(P<0.05);相较于DM组,DMDD组p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR明显增高(P<0.05),且呈明显剂量依赖性(Fig 5)。
Fig 5 Comparison of PI3K, Akt, and mTOR expressions in myocardial tissues of rats in each group n=10)
3 讨论
持续高糖诱导的心肌细胞凋亡是引发DCM的主要原因,由于凋亡心肌细胞无法再生,逐渐被胶原纤维等取代,故而导致心肌纤维化及心室重构。因此,抑制心肌细胞凋亡对于改善DM心肌损伤具有积极意义[7]。本研究采用高糖高脂饮食联合腹腔注射链脲佐菌素建立DM大鼠模型,HE染色显示DM组大鼠心肌组织损伤明显;心脏彩超可见LVEDP明显增高,同时LVSP、+dp/dtmax、-dp/dtmax明显降低;TUNEL染色显示心肌细胞凋亡明显。上述变化与文献[8]中对于DM心肌损伤模型的报道一致,提示造模成功。而相较于DM组,DMDD组大鼠心肌组织损伤明显减轻,左心室功能明显改善,同时心肌细胞凋亡指数明显降低。这表明DMDD对于DM心肌损伤具有明确的保护效应。
自噬是真核细胞的重要代谢途径,泛指蛋白质和受损细胞器经溶酶体清除、降解的一系列过程[9]。生理条件下,细胞自噬活性持续处于低水平状态,有助于维持细胞的存活与能量平衡[10]。然而,某些条件下会导致自噬过度激活,造成细胞程序性死亡。目前认为,自噬可在一定程度上调控心肌细胞增殖与凋亡,并在DCM进展过程中发挥至关重要的作用[11]。本研究显示,DM组大鼠不仅存在心功能障碍,还伴有心肌自噬过度激活,表现在自噬标志物Beclin-1、LC3 Ⅱ/I、Atg5表达较Control组明显增高,与朱小艳等[12]报道一致。而DMDD组大鼠上述自噬标志物表达较DM组明显降低,提示DMDD可有效抑制DM大鼠心肌细胞过度自噬。
高糖状态下,心肌组织中ROS产生增加,加之氧自由基清除能力减弱,势必造成ROS大量蓄积,最终造成心肌细胞DNA及脂质的过氧化损伤[13]。本研究结果显示,DMDD组SOD水平较DM组明显增高,同时ROS、MDA水平较DM组明显降低。表明DMDD有助于清除ROS,并调控抗氧化物/氧化物平衡,从而改善糖尿病所致心肌氧化应激损伤。近年研究发现,ROS可作为一种胞内信号分子参与细胞自噬的调控[14]。证据表明,ROS可通过调控PI3K/Akt/mTOR、AMPK、PIK3C3等通路诱导自噬小体形成,从而引发细胞自噬[15]。其中PI3K/Akt/mTOR通路是研究得最为广泛的路径之一。当细胞ROS水平发生变化时,可激活PI3K激酶,促使Akt磷酸化,并调控下游mTOR活化,进而影响自噬体形成和成熟[16-17]。本研究发现,DMDD组p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR较DM组明显增高(P<0.05),说明DMDD可激活PI3K/Akt/mTOR通路,这也是其调控心肌细胞自噬的主要机制之一。
综上所述,杨桃根DMDD可通过调控ROS介导的PI3K/Akt/mTOR自噬通路,抑制心肌细胞凋亡,从而减轻DM大鼠心肌损伤。

