有氧运动对心力衰竭大鼠心室肌细胞钾通道重构的影响
胡菱 孟林凤 胥亚楠 裴赫男 王茜 胡华刚 赵冬琰 刘梅洁
充血性心力衰竭(CHF)是多种心血管疾病进展的终末阶段,约50%的患者死于恶性心律失常[1],而恶性心律失常发生的主要机制是心肌细胞电重构。心肌细胞离子通道重构是心肌细胞电重构的重要基础。多项研究表明,适量有氧运动(AE)能够显著改善心血管内皮功能,提高受试者运动耐力,降低交感神经兴奋性,抑制肾素-血管紧张素-醛固酮系统(RAAS)的活动,从而显著改善心肌缺血及缺氧状况[2-7]。但AE对心室肌细胞离子通道重构的作用尚未明确。延迟整流钾电流(IK)是心室肌细胞复极的主要电流之一,本研究建立CHF大鼠模型,通过AE干预,观察快速激活延迟整流钾电流(IKr)编码基因KCNH2及及慢激活延迟整流钾电流(IKs)α亚基编码基因KCNQ1的表达水平,探讨AE在CHF治疗中的作用及病理生理机制。
1 材料与方法
1.1 实验动物与材料
1.2 CHF模型建立及实验分组
SD大鼠随机分为假手术组、CHF组、假手术+AE组和CHF+AE组,每组12只。SD大鼠禁食12 h,称量体质量,腹部脱毛后采用10%水合氯醛(0.3 mL/100 g) 腹腔注射麻醉大鼠,CHF模型建立参照参考文献[8]。将大鼠仰卧固定,消毒后沿剑突自腹中线略偏左侧垂直切开腹部皮肤,钝性分离腹主动脉及左肾动脉。用4号手术缝线于左肾动脉上方约1.0 cm处结扎腹主动脉,使腹主动脉狭窄约80%[腹主动脉直径约(1.76±0.10) mm],逐层缝合。假手术组于腹主动脉下放置手术缝线但不结扎,CHF组结扎腹主动脉,两组大鼠手术1周后,先进行适应性游泳1周,再进行一般照护8周。假手术+AE组及CHF+AE组采取无负重游泳训练,在120 cm×80 cm×70 cm的长方形塑料水桶中进行,水桶四壁光滑,水深约40 cm,水温(32.0±2.5)℃,每天游泳运动1次,每次20 min,两组大鼠手术1周后,先进行适应性游泳1周,再进行AE训练8周。
1.3 心功能指标测定
各组饲养及训练结束后,采用VisualSonics 770超声,17.5 MHz探头测定SD大鼠的左室后壁厚度(LVPWD)及左室射血分数(LVEF)。取大鼠内眦静脉血冰上静置2 h,3 000转/min离心15 min,取上清液,用ELISA试剂盒测定血浆中NT-proBNP含量。使用过量10%水合氯醛将大鼠处死,摘取心脏,分离心房,剪去右心室游离壁,称量左室质量,左室质量指数(LVWI)=左室质量/大鼠体质量。
1.4 HE染色及天狼星红染色检测心室肌组织形态及纤维化程度
将心室肌组织用4%多聚甲醛固定,石蜡包埋,切片,进行HE染色和天狼星红染色。
1.5 实时荧光定量聚合酶链反应(PCR)检测KCNQ1和KCNH2的mRNA表达水平
使用Trizol Reagent提取各组心室肌细胞总RNA。大鼠KCNQ1上游引物为5′-CGCCTCCTG TTTCTCTGTCT-3′,下游引物为5′-CGTCTTCGTCTCCGTCTTTG-3′。大鼠KCNH2上游引物为5′-ACCCACAATGTCACCGAGAAG-3′,下游引物为5′-CCCTGACCGAGTAAGACGAC-3′。GAPDH上游引物为5′-GGTGCTGAGTATGTCGTGGAGT-3′,下游引物为5′-TAGTGACGGTGGGTCTTCTGA-3′。反应条件为95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。以2-ΔΔCt计算KCNQ1和KCNH2 mRNA的相对表达水平。
1.6 Western Blot检测KCNQ1和KCNH2的蛋白表达水平
提取各组心室肌细胞总蛋白,使用BCA法测定蛋白浓度。取60 μg总蛋白上样,行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后将蛋白转移至硝酸纤维素膜上,用5%脱脂牛奶室温封闭1 h,加入KCNH2、KCNQ1一抗,4 ℃孵育过夜,加入辣根过氧化酶标记的二抗室温孵育1 h。充分漂洗后显影、摄片并进行条带灰度定量测定。以GAPDH作为内参,利用ImageJ软件对条带进行半定量分析。
1.7 统计学分析
统计分析采用Graphpad Prism 6软件。计量资料以均数±标准差表示,采用单因素方差分析进行多组间比较。P<0.05为差异有统计学差异。
2 结果
2.1 各组心功能指标比较
与假手术组相比,CHF组的LVEF显著降低,LVPWD、LVWI及NT-proBNP水平均明显升高(P均<0.01);假手术+AE组与假手术组的心功能指标差异均无统计学意义。与CHF组相比,CHF+AE组LVEF明显升高,LVPWD、LVWI及NT-proBNP水平均明显降低(P均<0.01)。见表1。

表1 各组大鼠LVEF、LVPWD、LVWI、NT-proBNP检测结果比较
2.2 各组心室肌组织形态学及纤维化程度比较
HE染色结果显示,假手术组、假手术+AE组心肌细胞形态正常,排列整齐;CHF组可见心肌细胞明显肥大、水肿,部分心肌细胞呈脂肪样变性,出现间质充血及纤维排列紊乱,CHF+AE组的上述情况较CHF组减轻。见图1。
天狼星红染色可显示心肌间质及血管周围胶原分布情况。假手术组、假手术+AE组成纤维细胞未见明显增殖,细胞排列整齐;CHF组成纤维细胞增殖,胶原累积,Ⅲ型胶原增多,细胞外基质沉积,CHF+AE组的上述表现较CHF组明显好转。见图1。
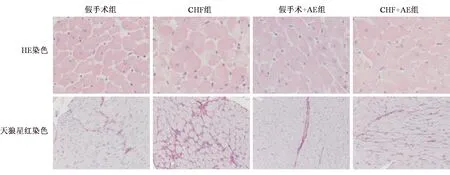
图1 各组大鼠心肌组织形态学及纤维化程度
2.3 各组心室肌细胞KCNH2 和KCNQ1表达水平比较
与假手术组相比,CHF组KCNQ1和KCNH2的mRNA表达水平均明显上调(P均<0.05);假手术+AE组与假手术组KCNQ1和KCNH2 mRNA表达水平的差异均无统计学意义。与CHF组相比,CHF+AE组KCNQ1及KCNH2的mRNA表达水平均明显下调(P均<0.05)。见表2。
与假手术组相比,CHF组心室肌细胞KCNQ1及KCNH2蛋白表达水平明显下调(P均<0.05);假手术+AE组与假手术组心室肌细胞KCNQ1及KCNH2蛋白表达水平的差异均无统计学意义。与CHF组相比,CHF+AE组KCNQ1及KCNH2蛋白表达水平明显上调(P均<0.05)。见图2、表2。

表2 各组KCNH2和KCNQ1的mRNA和蛋白表达水平比较
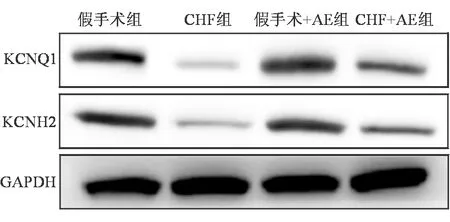
图2 各组KCNQ1及KCNH2蛋白表达情况
3 讨论
心室重构包括结构重构及电重构,是CHF的重要病理生理机制[9]。RAAS是导致心室结构重构的重要因素。NT-proBNP能对抗RAAS引起的水钠潴留,可扩张血管,增加排钠,有较好的稳定性,是评价CHF的敏感性及特异性指标。研究证实,AE可以改善CHF患者的心肺耐力,降低 NT-proBNP水平,改善患者的心功能[10]。本研究成功建立了CHF大鼠模型,发现接受AE的CHF大鼠的LVEF较未接受AE的CHF大鼠升高,LVWI、NT-proBNP水平降低,表明AE可改善心室射血功能,抑制CHF所致心室重构,同时能够对抗RAAS引起的水钠潴留,降低NT-proBNP水平。另外,本研究发现,接受AE的CHF大鼠心肌细胞水肿、增大、脂肪变性、间质充血等病理改变较未接受AE的CHF大鼠有所减轻,表明AE对CHF大鼠心肌细胞凋亡有改善作用。这与文献报道AE能显著改善CHF大鼠的心功能、减轻心肌纤维化一致[2]。
IK具有外向整流的特点,包括3种亚型,分别为超快激活电流(IKur)、IKr和IKs,大鼠心室肌细胞仅有后2种电流,其改变可导致功能衰竭的心室肌细胞发生快速室性心律失常。研究表明,在CHF大鼠发生室性心律失常时,存在IK及IKs减小,动作电位持续时间(APD)显著延长[11-13]。本研究检测大鼠心室肌IKr及IKs-α亚基的编码基因KCNH2和KCNQ1,发现CHF大鼠KCNH2和KCNQ1的mRNA表达水平明显上升,接受AE后,KCNH2和KCNQ1的mRNA表达水平明显下降,而CHF大鼠KCNQ1及KCNH2的蛋白表达水平明显下调。转录和翻译是两个不同的过程,在某些特定的条件下可以脱节,翻译过程中,mRNA可能会受到其他因子的负调控。这与文献报道CHF大鼠在发生室性心律失常时KCNH2和KCNQ1蛋白表达受抑制结果一致[14]。
综上所述,本研究结果显示,AE参与调控CHF大鼠心肌结构与IKr、IKs离子通道重构,AE可改善心肌结构重构,逆转心肌电重构中IK离子通道的改变。该研究为临床运用AE治疗CHF、改善CHF预后提供一定理论基础。

