罗格列酮调控沉默信息调节因子1对高糖处理的心肌微血管内皮细胞增殖和迁移的影响
韩玉泽 张春雨 梁慧 赵丹
心血管疾病是糖尿病患者最常见的并发症。心肌微血管内皮细胞(CMEC)占心脏细胞总数的1/3,在维持冠状动脉微血管和邻近心肌细胞正常功能方面起着关键作用[1]。然而,慢性高血糖等因素可引起CMEC功能障碍和凋亡,导致微血管病变[2]。罗格列酮是噻唑烷二酮类抗糖尿病药,可通过提高胰岛素的敏感性有效控制血糖。研究显示,罗格列酮可减轻CMEC损伤并改善其功能,对改善糖尿病心肌微血管病变具有重要意义[3-4]。在正常状态下,内皮细胞增殖能力有限,但在病理情况下内皮细胞增殖和迁移对血管修复具有始动作用[5]。然而,罗格列酮能否促进内皮细胞增殖并提高其迁移能力尚未可知。沉默信息调节因子1(Sirt1)是研究最为广泛的去乙酰化酶同源物,研究显示CMEC细胞Sirt1活性降低,可抑制细胞自噬,增强细胞凋亡,促进糖尿病冠状动脉微血管功能障碍的发生[6]。但目前尚不明确罗格列酮是否通过调控Sirt1表达影响CMEC增殖和迁移。本研究探讨罗格列酮对高糖处理的大鼠CMEC增殖和迁移的影响,并分析其对Sirt1表达的调控作用。
1 材料与方法
1.1 实验材料
大鼠心肌微血管内皮细胞CMEC购于德国微生物菌种保藏中心;RPMI-1640培养基、胎牛血清、青链霉素双抗溶液购于美国Gibco公司;罗格列酮(纯度为93.3%,批号100673-201902)购于中国食品药品检定研究院;Sirt1小干扰RNA(si-Sirt1)及其对照(si-NC)、PCR引物由上海生工公司提供;细胞计数试剂盒8(CCK-8)购于美国Sigma公司;Transwell小室购于美国BD公司;兔源抗Sirt1抗体、兔源抗P21抗体、兔源抗上皮细胞钙粘蛋白(E-cadherin)抗体、山羊抗兔IgG二抗购于美国CST公司。
1.2 细胞培养和分组
CMEC细胞采用含10%胎牛血清、1%青链霉素双抗的RPMI-1640培养基培养,置于37 ℃、5% CO2孵育箱中。当细胞融合度达到80%时,进行传代,同步化以后进行实验分组。以含5.5 mmol/L葡萄糖的完全培养基培养的细胞作为对照组;含33 mmol/L葡萄糖的完全培养基培养的细胞作为高糖对照组[7];在含33 mmol/L葡萄糖的完全培养基中加入终浓度为5、10、20 μmol/L的罗格列酮,培养的细胞分别作为实验1组、实验2组、实验3组[8]。培养24 h后,检测细胞增殖、迁移能力以及Sirt1的表达水平。
将si-NC、si-Sirt1分别转染CMEC,并采用33 mmol/L葡萄糖和20 μmol/L罗格列酮处理24 h,记为实验3+si-NC组、实验3+si-Sirt1组,随后检测细胞增殖和迁移能力变化。
1.3 CCK-8法检测细胞增殖活力
将各组CMEC细胞按照5×103/孔接种到96孔板,培养24 h后,每孔加入CCK8试剂10 μL,培养箱孵育4 h,全自动酶标仪检测450 nm波长各孔光密度(OD)值,计算细胞存活率。细胞存活率=(实验组OD值/对照组OD值)×100%
1.4 Transwell实验检测细胞迁移能力
采用无血清RPMI-1640培养液重悬各组CMEC细胞,在Transwel上室加入1×105个CMEC细胞,在24孔板下室加入含10 ng/mL血管内皮生长因子的完全培养液,培养箱孵育8 h后,用棉签擦去上室未迁移细胞,经多聚甲醛戈丁和结晶紫染色后,倒置显微镜下观察细胞过膜情况,选取3个视野,拍照并计数,以均值表示细胞迁移能力。
1.5 Western blot检测P21、E-cadherin和Sirt1的蛋白表达水平
采用RIPA裂解缓冲液提取各组CMEC细胞总蛋白,并进行蛋白定量。利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离细胞蛋白,电泳结束后,将蛋白转移到聚偏二氟乙烯膜上。5%脱脂奶室温封闭膜1 h,洗膜后,4 ℃条件下用稀释的一抗溶液孵育膜过夜,加入稀释的二抗溶液室温孵育膜1 h。使用增强型化学发光试剂显影,ImageJ软件分析目的蛋白的灰度值,以GAPDH为内参,计算目的蛋白的相对表达水平。
1.6 实时荧光定量PCR检测Sirt1的mRNA表达水平
采用Trizol试剂从各组细胞分离总RNA,利用PrimeScript RT试剂盒进行逆转录,采用SYBR Green Master Mix在ABI 7900HT系统上检测Sirt1的mRNA表达水平。Sirt1引物序列:上游5′-GCCAGAGTCCAAGTTTAGAAGA-3′,下游5′-CCATCAGTCCCAAATCCAG-3′。GAPDH引物序列:上游5′-TGGAAGGACTCATGACCACA-3′,下游5′-TTCAGCTCAGGGATGACCTT-3′。以GAPDH为内参照,2-ΔΔCt法分析Sirt1的mRNA表达水平。
1.7 统计学分析
所有实验设置3个平行实验并重复3次,实验数据采用均数±标准差表示。采用SPSS 17.0进行数据分析,两组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 罗格列酮对高糖处理的CMEC增殖的影响
与对照组比较,高糖对照组CMEC存活率明显降低;与高糖对照组比较,高糖联合罗格列酮处理后CMEC存活率均明显升高(P均<0.05)。见表1。

表1 各组CMEC存活率比较
2.2 罗格列酮对高糖处理的CMEC迁移的影响
与对照组比较,高糖对照组CMEC迁移数量显著降低;与高糖对照组比较,高糖联合罗格列酮处理后CMEC迁移数量均显著增加(P均<0.05)。见表2。
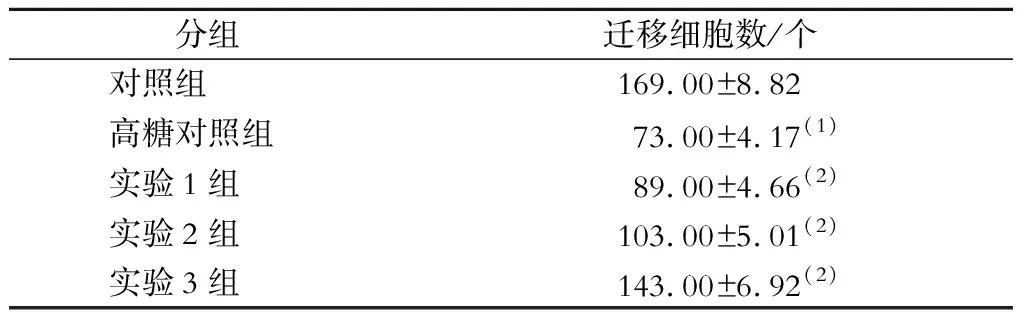
表2 各组CMEC迁移数量比较
2.3 罗格列酮对高糖处理的CMEC中Sirt1、P21、E-cadherin表达的影响
与对照组比较,高糖对照组CMEC中Sirt1的 mRNA和蛋白表达水平均显著降低,P21和E-cadherin的蛋白表达水平均显著增加;与高糖对照组比较,高糖联合罗格列酮处理后CMEC中Sirt1的mRNA和蛋白表达水平均显著升高,P21和E-cadherin的蛋白表达水平均显著降低(P均<0.05)。见表3和图1。
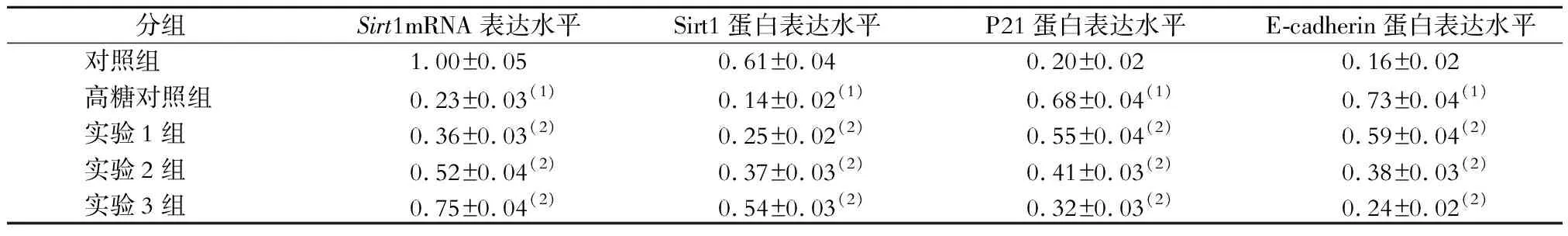
表3 各组CMEC中Sirt1、P21、E-cadherin的表达水平比较
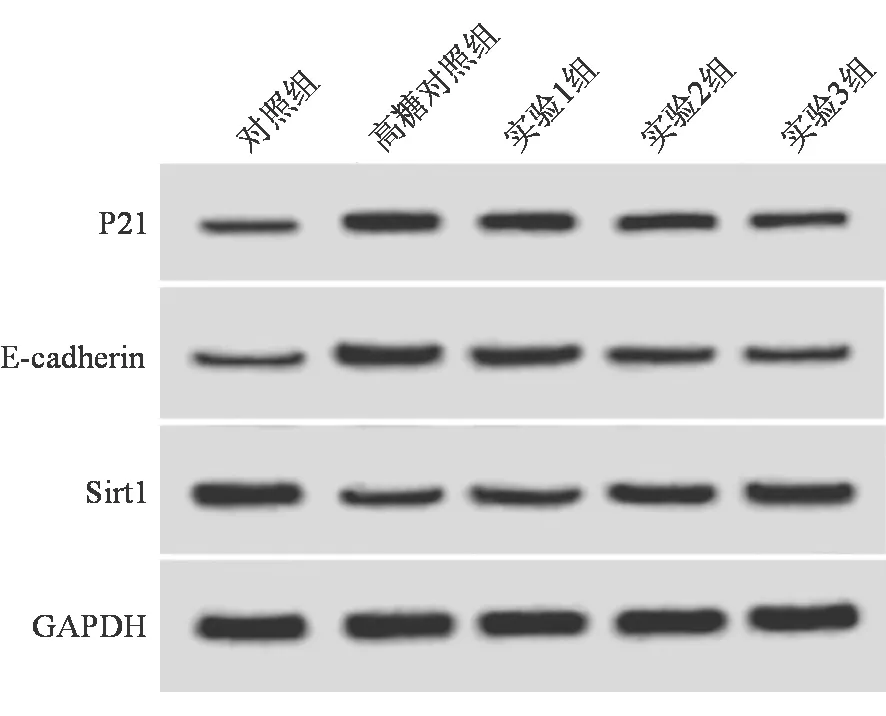
图1 各组CMEC中Sirt1、P21、E-cadherin的蛋白表达情况
2.4 抑制Sirt1能减轻罗格列酮对高糖处理的CMEC增殖、迁移的影响
与实验3+si-NC组比较,实验3+si-Sirt1组CMEC存活率显著降低(P<0.05)。见表4。

表4 2组转染后CMEC存活率比较
与实验3+si-NC组比较,实验3+si-Sirt1组CMEC中Sirt1的蛋白表达水平显著降低,E-cadherin和P21的蛋白表达水平均显著升高,细胞迁移数量显著降低(P均<0.05)。见表5和图2。
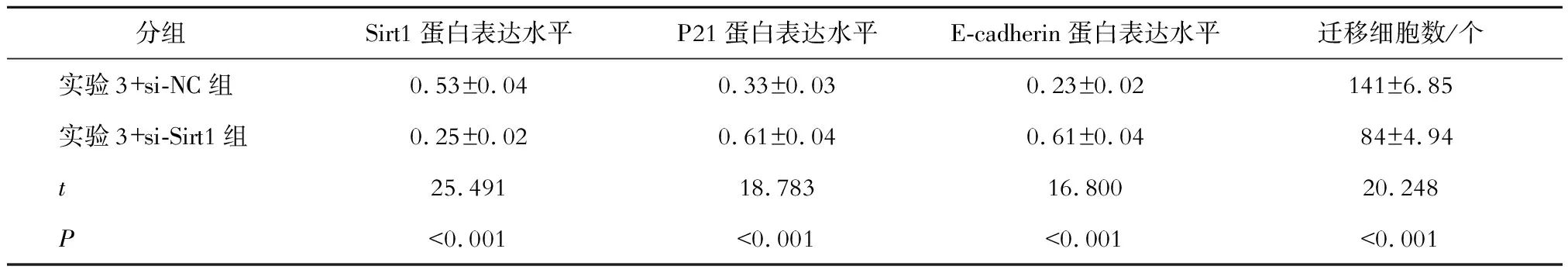
表5 2组转染后CMEC迁移数量及蛋白表达水平比较
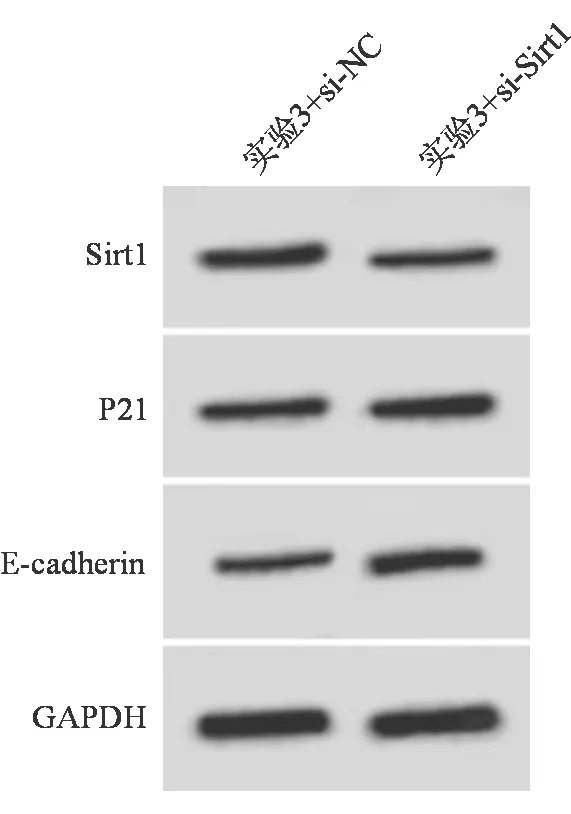
图2 2组转染后Sirt1、P21和E-cadherin的蛋白表达情况
3 讨论
罗格列酮为过氧化物酶体增殖物激活受体γ(PPARγ)的特异、高效激动剂。罗格列酮除通过激活PPARγ受体对糖尿病有治疗作用外,对心血管系统也有不同程度的保护作用。高夏青等[9]发现罗格列酮通过提高血清超氧化物歧化酶水平,抑制炎性因子分泌,减轻心肌氧化应激和炎性损伤,减少心肌梗死面积。邹晓译等[10]发现罗格列酮通过降低还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性和血管超氧阴离子水平,减轻血管紧张素Ⅱ诱导的血压升高和心肌肥厚。郝拮等[11]发现罗格列酮可通过促进脂联素分泌,减少梗死面积,进而在缺血预适应中发挥心肌保护作用。本研究探讨罗格列酮对高糖处理的CMEC增殖和迁移的影响,发现高糖处理的CMEC的存活率和迁移能力显著降低,而罗格列酮干预可使高糖处理的CMEC的存活率和迁移能力显著升高。P21是一种重要的周期蛋白激酶抑制剂,可将细胞周期阻滞于G1期,具有抗细胞增殖作用[12]。E-cadherin是细胞黏附分子,可维持上皮极性和完整性,其表达或功能缺失与细胞迁移密切相关[13]。高糖处理的CMEC的P21和E-cadherin蛋白表达升高,而罗格列酮干预后P21和E-cadherin蛋白表达水平显著降低,与上述功能实验结果一致。以上研究表明罗格列酮可拮抗高糖对CMEC增殖和迁移的抑制作用,对高糖处理的CMEC细胞有保护作用。
研究显示,通过去乙酰化作用,Sirt1不仅在细胞代谢、分化、凋亡、氧化应激以及衰老中发挥调控作用,还参与心脏发育、心肌细胞生长、血管形成,是心血管疾病防治的潜在靶点[14]。Zhong等[15]发现丹参酮ⅡA可通过激活Sirt1维持线粒体电位,减少线粒体膜通道孔开放,抑制促凋亡因子释放,促进CMEC细胞存活,保护微血管结构和功能。此外,Sirt1还可降低高糖诱导下血管内皮细胞氧化应激水平,拮抗高糖对血管内皮细胞增殖抑制和凋亡促进作用[16]。本研究发现高糖处理的CMEC的Sirt1的mRNA和蛋白表达水平显著降低,罗格列酮可拮抗高糖对Sirt1表达的抑制作用,提示罗格列酮可能通过调控Sirt1表达参与对CMEC增殖、迁移的调控。进一步研究显示,抑制Sirt1可减轻罗格列酮对高糖处理的CMEC增殖和迁移的影响,这说明上调Sirt1是罗格列酮拮抗高糖对CMEC细胞增殖和迁移抑制作用的重要机制。
总之,本研究证实罗格列酮通过上调Sirt1可促进高糖处理的CMEC增殖、迁移能力,为临床应用罗格列酮改善糖尿病患者心肌微血管损伤提供了实验依据。

