亚硝酸盐还原酶高产菌株的筛选与产酶条件的研究
付豪,邓艳芳,黄丽玲,赵丹,王昌涛,2,李萌*
(1.北京工商大学化学与材料工程学院北京市植物资源研究开发重点实验室,北京 100048;2.北京工商大学北京食品营养与人类健康高精尖创新中心,北京 100048)
亚硝酸盐(nitrite,NIT)外观与食用盐极为相似,颜色为白色或者黄色,普遍存在于自然界和日常生活中。在自然环境下,NIT由硝酸盐还原生成和铵盐氧化生成,硝酸盐和铵盐本身都是无毒的,在特定条件下经化学反应后就会生成有毒的NIT,NIT被用作添加剂是法定许可的,而且常作为添加剂广泛用于食品加工中。当然,NIT的使用量须严格管控,GB 2760—2014《食品安全国家标准食品添加剂使用标准》中明确规定其使用量不得超过150 mg/kg,残留量不得超过30 mg/kg[1]。现在常用降解NIT的方法有:加入酸性物质使亚硝酸盐生成不稳定的亚硝酸,亚硝酸分解又可以生成对心血管有益的NO;加入碱性氨基酸使NIT转变成亚硝胺;加入高浓度食盐溶液,使离子浓度增高,降低pH值的同时降低NIT浓度[2]。乳酸菌发酵法是一种更为安全、快速的方法[3],当乳酸菌在有亚硝酸盐的环境时,自身会产生亚硝酸盐还原酶,从而达到降低亚硝酸盐含量的目的。乳酸菌发酵前期pH值较高,主要是通过亚硝酸盐还原酶来降解NIT,随着乳酸菌生产的乳酸越来越多,其pH值会一直下降,发酵后期降解NIT则主要由乳酸来实现。
亚硝酸盐还原酶(nitrite reductase,NIR)能够还原亚硝酸盐,生成NH4+或N2。目前,亚硝酸盐还原酶已从多种高等植物、蓝藻、细菌分离提纯获得。此外,NIR是一种胞内酶,大多数位于周质间隙或细胞膜中。亚硝酸盐还原酶在植物和微生物细胞内分布在不同位置,因此需要利用不同的处理方法来提取酶液[4]。主要的方法原理是:根据酶的疏水性和分子大小等性质,用疏水相互作用、尺寸排阻色谱等方法纯化还原酶[5]。自20世纪80年代起,国内外研究者从分离纯化、定位、光谱性质、蛋白结构和编码基因等方面,探讨了亚硝酸盐还原酶的性质。迄今为止,人们研究发现了4种亚硝酸还原酶:nirK、nirS、nrfA、nasB[6]。亚硝酸还原酶基因和蛋白序列的差异性很大,同种类微生物中不同类型的亚硝酸还原酶,不同种类微生物中不同类型的亚硝酸还原酶,其序列也会表现出明显的差异性。大肠杆菌中的降解亚硝酸盐活性的功能基因片段,利用生物信息分析手段已经被确定[7]。目前植物乳杆菌上编码硝酸还原酶的功能性基因还未被明确,根据基因库中已知的亚硝酸盐还原酶蛋白序列的保守序列,查找到了植物乳杆菌功能基因组上的亚硝酸盐还原酶疑似基因[8-9]。
植物乳杆菌等产生的NIR在25℃~38℃时酶活均较高,其最适温度为30℃左右,当温度为15℃时,NIR的酶活会受到抑制,酶活力降至原来的10%;当温度为50℃时,酶会失去活性。NIR在pH值为5~6时,酶均表现有较明显活力,酶的最适反应pH值为5.5。与酸性环境不一样,在碱性环境中,酶活性将受到限制甚至全部消失。在这些最适反应条件下,测得酶的米氏常数Km值为120.5 μg/mL[10]。
目前研究表明,只有部分乳酸菌会产生NIR,且会因基因表达差异而产生不同类型的亚硝酸盐还原酶。本文对自然发酵泡菜中产生的亚硝酸盐微生物进行分离纯化,对其中降解NIT效率最高的菌株鼠李糖乳杆菌N-6的培养基和部分培养条件进行优化,对酶液进行初步纯化,并测定纯化后的酶活性。
1 材料与方法
1.1 材料
自然发酵泡菜:市售;MRS液体培养基:蛋白胨2g、葡萄糖 4 g、乙酸钠 1 g、硫酸镁0.04 g、硫酸锰 0.01 g、牛肉粉1 g、酵母粉0.8 g、磷酸氢二钾0.4 g、柠檬酸三铵0.4 g、吐温80 0.2 mL、蒸馏水200 mL;平板筛选培养基:MRS液体培养基加入2.8 g琼脂,200 mL去离子水;盐酸萘乙二胺、对氨基苯磺酸、亚硝酸钠:国药集团化学试剂有限公司;蛋白胨、葡萄糖、乙酸钠、盐酸萘乙二胺、三羟甲基氨基甲烷盐酸盐、对氨基苯磺酸、硼酸钠、乙酸锌、亚氰化钾、盐酸、冰乙酸(分析纯):北京北化精细化学品有限责任公司;引物:生工生物工程(上海)股份有限公司;以上试剂均为分析纯。
1.2 仪器
BS2202S型电子天平:北京赛多利斯仪器系统有限公司;BXM-30R高压灭菌锅:上海博讯实业有限公司;HH-SY11-Ni1电热恒温水浴锅:北京长安科学仪器厂;UVmini-1240紫外可见分光光度计:日本岛津公司;4k15 3-18k冷冻高速离心机:Sigma公司;DYY-12C电泳仪:北京六一仪器厂。
1.3 亚硝酸钠含量测定
1.3.1 溶液配制
盐酸萘乙二胺溶液:准确称取0.1 g盐酸萘乙二胺,溶解于50 mL超纯水中,混匀,置棕色瓶中,避光4℃保存待用;对氨基苯磺酸溶液:称取0.4 g对氨基苯磺酸,溶于100mL20%盐酸中,置于棕色瓶中混匀,避光保存待用。亚硝酸钠标准溶液:准确称取0.1 g亚硝酸钠,加入超纯水溶解,移入500 mL容量瓶中,加水稀释至刻度,此溶液即为亚硝酸钠标准溶液。
1.3.2 亚硝酸钠标准曲线测定
准确吸取 0、0.2、0.4、0.6、0.8、1.0、2.0、5.0 mL 亚硝酸钠标准溶液,分别置于50 mL容量瓶中,加入40 mL超纯水,摇匀,加入2 mL对氨基苯磺酸溶液,摇匀,置于避光处反应5 min;再加入1 mL盐酸萘乙二胺溶液,定容至50 mL,混匀,避光静置15 min。设置分光光度计波长为538 nm,分别测定吸光值,以亚硝酸钠溶液浓度为横坐标,吸光度值为纵坐标,绘制亚硝酸钠标准曲线。亚硝酸钠在0~0.25 μg/mL的浓度范围内与A538呈良好的线性关系,以吸光度A538对亚硝酸钠浓度进行线性回归,得到回归方程如下:y=1.058 3x+0.001 5(R2=0.998 72);y 表示吸光度值 A538;x 表示亚硝酸钠浓度,μg/mL。
1.4 高产NIR的乳酸菌筛选
1.4.1 菌株活化
活化培养基为MRS液体培养基,配制100 mL MRS培养基,接种1 g双歧杆菌酸奶发酵剂,置于摇床中30 ℃,180 r/min,培养24 h。
1.4.2 分离筛选
配制300 mL MRS琼脂培养基将活化好的新鲜种子液分别稀释1、10、100、1 000倍,将这4种浓度的菌液以涂布法接种在平板中,每个浓度接种2个平板,30℃培养24 h。配制500 mL MRS液体培养基,121℃灭菌20 min,选取长势较好菌落,用接种环分别接种到锥形瓶中,30℃培养24 h。从平板中筛选的菌落序号分别为 N-1、N-2、N-3、N-4、N-5、N-6、N-10、N-14、N-17、N-21、N-22、N-25、N-28、N-29、N-31[11]。
1.4.3 盐酸萘乙二胺分光光度法测定菌株分解亚硝酸盐能力
1.4.3.1 溶液配制
饱和硼酸钠溶液:称取50 g硼酸钠,溶于1 000 mL热水中,冷却备用;乙酸锌溶液:称取22 g乙酸锌,加入3 mL冰乙酸,最后再加水稀释到100 mL;亚铁氰化钾溶液:称取10.6 g亚铁氰化钾,加水至100 mL,搅拌溶解;盐酸萘乙二胺溶液:称取0.1 g盐酸萘乙二胺,溶解于50 mL水中,搅拌混匀,放入棕色瓶中备用;对氨基苯磺酸溶液:称取0.4 g对氨基苯磺酸,溶解于100 mL去离子水中,放进棕色瓶中备用。
配制NaNO2浓度为125 μg/mL的MRS液体培养基500 mL和不含NaNO2的液体培养基100 mL,以接种量3%,30℃培养24 h[12]。
1.4.3.2 吸光度测定
试样处理:吸取5 mL样品,分别置于250 mL三角瓶中,加入饱和硼砂溶液12.5mL,摇匀后再加入约50 mL蒸馏水,沸水锅里加热15 min,取出后冷却至25℃,再转移到100mL容量瓶中,加入5mL亚铁氰化钾溶液,混匀,再加入5mL乙酸锌溶液,定容到100mL,充分混匀,静置约30 min,沉淀样品中的蛋白质。这沉淀进行抽滤,弃去初滤液30 mL,收集剩余的滤液。
吸取2 mL上述滤液于50 mL容量瓶中,加水40 mL,摇晃均匀,先加入2 mL对氨基苯磺酸溶液,混匀,避光静置5 min,再加入1 mL盐酸萘乙二胺溶液,定容至50 mL,混匀,避光静置15 min,在波长538 nm处测定吸光值[13]。
1.5 菌株筛选
引物序列为 27f:AGA GTT TGA TCC TGG CTC AG;1492r:GGCTACCTTGTTACGACTT。PCR的反应条件:95℃预变性 5 min,95℃变形 30 s,58℃退火 30 s,72℃延伸1.5min,共循环30次,最后72℃延伸10min。基因测序:由北京华大测序公司进行。
1.6 影响高产菌株NIR的培养条件优化
筛选出的高产菌株,以NIT为指标,以碳源、氮源、磷源、培养温度与培养方式作为影响因素进行单因素试验,初始培养条件设定为2%葡萄糖、0.5%酪蛋白胨、0.2%磷酸二氢钾、培养温度37℃,动态培养,其中碳源分别选取蔗糖、葡萄糖和乳糖,并以不加碳源为空白对照。氮源分别选取蛋白胨、酪蛋白胨及胰蛋白胨,以不加氮源为空白对照,磷源分别选取磷酸二氢钠、磷酸氢二钠及磷酸二氢钾,以不加磷源为无磷空白对照,培养温度分别选取 20、30、37、40 ℃,培养方式选用动态和静态两种不同培养方式[14]。
1.7 亚硝酸还原酶的提取与分离纯化
1.7.1 蛋白质浓度测定
双缩脲法测定蛋白含量,首先制定标准曲线,测得蛋白质含量的回归方程曲线y=0.077 3x+0.005,回归系数R2=0.999 3,线性度较好[15]。
1.7.2 酶活测定方法
1.7.2.1 酶活力计算
酶活力单位定义:每小时降解1 μg亚硝酸盐所需要的酶量为一个酶活力单位(U),即1 U=1 μg/h。
1.7.2.2 酶活反应体系
取干净试管,加入1%葡萄糖1mL,50μg/mLNaNO21 mL,0.2 mol/L 的磷酸盐缓冲液(pH7.2)7 mL,酶液1 mL,在40℃保温反应24 h。加入0.4%对氨基苯磺酸溶液2 mL,混匀,避光静置5 min。再加入0.2%盐酸萘乙二胺溶液1 mL,静置15 min,在538 nm波长下测吸光值计算酶活力。以磷酸缓冲液代替酶液为空白对照,以磷酸缓冲液代替NaNO2溶液和酶液作为调零值[16]。
1.7.3 粗酶液制备与纯化
亚硝酸还原酶粗酶液的提取制备方法为溶菌酶和超声波破碎,具体制备过程参照文献[17]。粗酶液的纯化步骤:粗酶液—硫酸铵分级盐析—透析—二乙基氨基乙基纤维素阴离子交换层析—透析—浓缩—目的蛋白,具体操作过程见文献[18]。
1.7.3.1 NIR粗酶液的制备
将初筛获得的菌株分别接入含0.2 mg/mL亚硝酸钠的培养基中,30℃培养24 h。分别取菌液100 mL,6 000 r/min 4℃离心10 min。收集沉淀,弃去上清液,用10 mL磷酸盐缓冲液(pH=7.2)。振荡,将菌体悬浮,加入溶菌酶,使其浓度为5 mg/mL,30℃反应24 h。经过超声波破碎后,8 000 r/min 4℃离心15 min。取上清液即为粗酶液[19]。
1.7.3.2 硫酸铵分级盐析
本研究采用硫酸铵沉淀法来沉淀上清液中的蛋白成分。
根据盐析粗酶液的体积,称取30%硫酸铵,置于4℃冰箱 4h,再离心(20 min、6 000 r/min),留上清液去沉淀。向上清液中继续添加硫酸铵(饱和度达到60%),4℃放置 4 h,离心(15 min,1 200 r/min),收集沉淀。将沉淀溶于粗酶液同体积的磷酸盐缓冲液(0.2 mol/L、pH7.2)[20]。
1.7.3.3 透析
选用的透析袋截留范围是8 000~14 000,透析袋的预处理参考文献[21]。
1.7.3.4 二乙基氨基乙基纤维素(diethylaminoethylcellulose,DEAE)阴离子交换层析
选择的阴离子交换层析为DEAE琼脂糖凝胶CL-6B,层析柱规格为1.6 cm×30 cm。具体操作步骤如下:根据柱子大小取适量的凝胶。凝胶高度达到柱子高度的80%左右,自然沉降。沉降完成后用去离子水平衡12 h,备用,取粗酶液,上样量3 mL。上样前过0.22 mm孔径聚醚砜滤膜,除去不溶物。洗脱:用含0.5 mol/L NaCl的0.002 mol/L三羟甲基氨基甲烷盐酸盐在2 mL/min的流速下进行洗脱,洗脱液每5 min收集一管,每管3 mL,共收集80管;检测:经酶标仪在280 nm波长下测定每一管蛋白溶液的吸光值,并绘制层析图谱。然后收集峰值较高处的蛋白,用双缩脲法检测蛋白质含量;再生:用洗脱液洗脱各组分直到完全洗脱,即可加入新的样品,继续使用。
1.8 数据处理
利用Excel进行数据汇总,并利用Origin95进行绘图。
2 结果与分析
2.1 菌落初步筛选
不同菌落作用后的亚硝酸钠含量见图1。
通过盐酸萘乙二胺分光光度法测试菌株分解亚硝酸盐能力,由图1可知,亚硝酸钠含量越高,意味着降解率越底,因此初步筛选出亚硝酸钠含量较低的菌落,分别为 N-6、N-25、N-28、N-31。
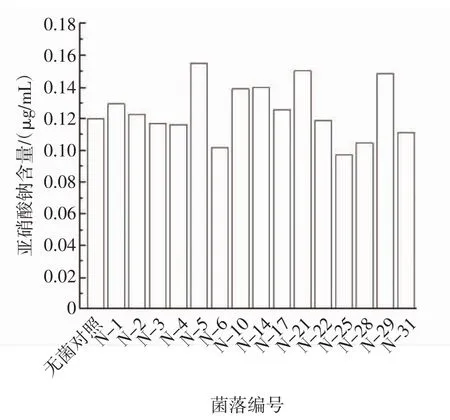
图1 不同菌落作用后的亚硝酸钠含量Fig.1 Sodium nitrite content after different colonies
2.2 高产NIR酶活测定结果
不同菌落的NIT降解率结果见图2。

图2 不同菌落的NIT降解率Fig.2 NIT degradation rate of different colonies
如图2所示,从泡菜样品中,初步筛选得出N-6、N-25、N-28、N-31号乳酸杆菌可高效降解NIT,其中N-6的降解率最高。经16SrDNA序列测序鉴定为鼠李糖乳杆菌(Lactobacillus rhamnosus)。
2.3 鼠李糖乳杆菌N-6培养条件优化
试验得出了鼠李糖乳杆菌N-6为最高产亚硝酸盐还原酶的乳杆菌,因此将进一步研究探索出影响鼠李糖乳杆菌产生NIR的最佳条件。影响乳杆菌降解NIT因素有很多,包括碳源、氮源、磷源、培养方式及培养温度等,本文对上述影响因素进行试验,得到鼠李糖乳杆菌产生NIR的最佳条件。
2.3.1 碳源对亚硝酸还原酶活性的影响
不同碳源对鼠李糖乳杆菌降解亚硝酸盐结果见图3。
由图3可知,无碳对照的NIT降解率为0.01%,由此说明碳源对鼠李糖乳杆菌影响较大,其中葡萄糖为最佳碳源,其降解率为52.22%,其降解亚硝酸钠的能力明显更强。这可能是由于鼠李糖乳杆菌自身对糖的转运和代谢效率会因糖而异,导致在降解亚硝酸盐上的差别。
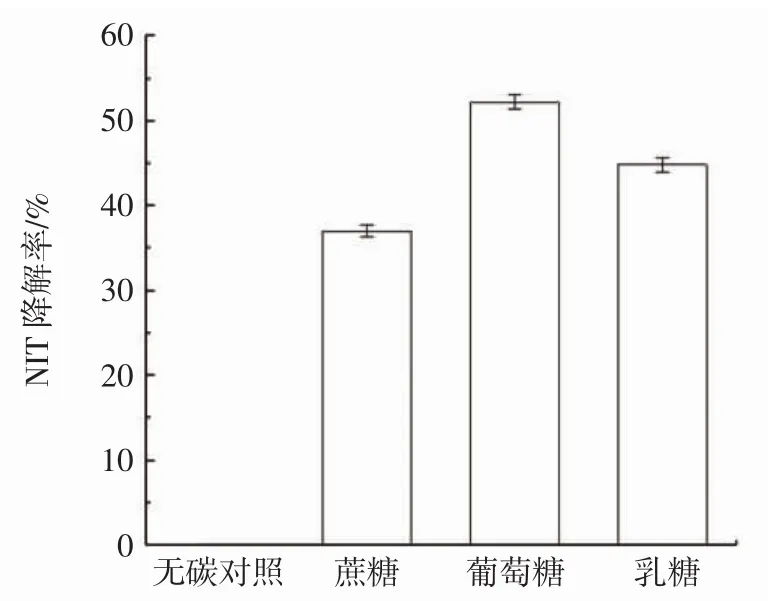
图3 不同碳源对降解NIT的影响Fig.3 Effect of different carbon sources on degradation of NIT
2.3.2 氮源对亚硝酸还原酶活性的影响
不同氮源对降解NIT的影响见图4。
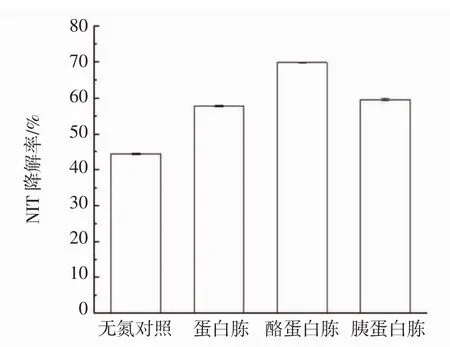
图4 不同氮源对降解NIT的影响Fig.4 Effect of different nitrogen sources on degradation of NIT
由图4可知,无氮对照的NIT降解率为44.44%,其中氮源为酪蛋白胨时鼠李糖乳杆菌的降解率最高,为68.89%。因此,此菌的最佳氮源为酪蛋白胨。
2.3.3 磷源对亚硝酸还原酶活性的影响
不同磷源对鼠李糖乳杆菌降解亚硝酸盐结果见图5。
由图5可知,无磷对照的降解率高于磷酸二氢钠与磷酸氢二钠,而低于磷酸二氢钾,因此鼠李糖乳杆菌的最佳磷源为磷酸二氢钾。
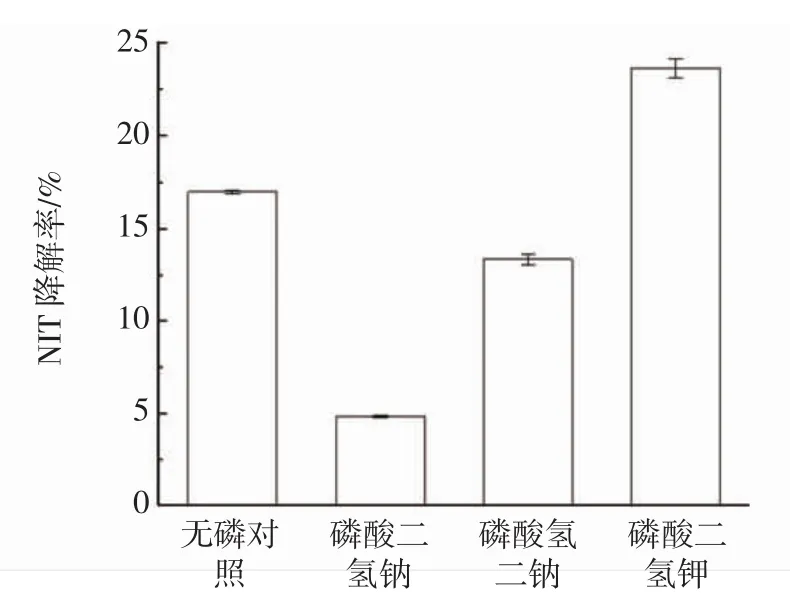
图5 不同磷源对NIT降解率的影响Fig.5 Effect of different phosphorus sources on the degradation rate of NIT
2.3.4 培养温度对鼠李糖乳杆菌降解亚硝酸盐的影响
不同培养温度对鼠李糖乳杆菌降解亚硝酸盐结果见图6。
由图6可知,鼠李糖乳杆菌的最适培养温度为37℃。
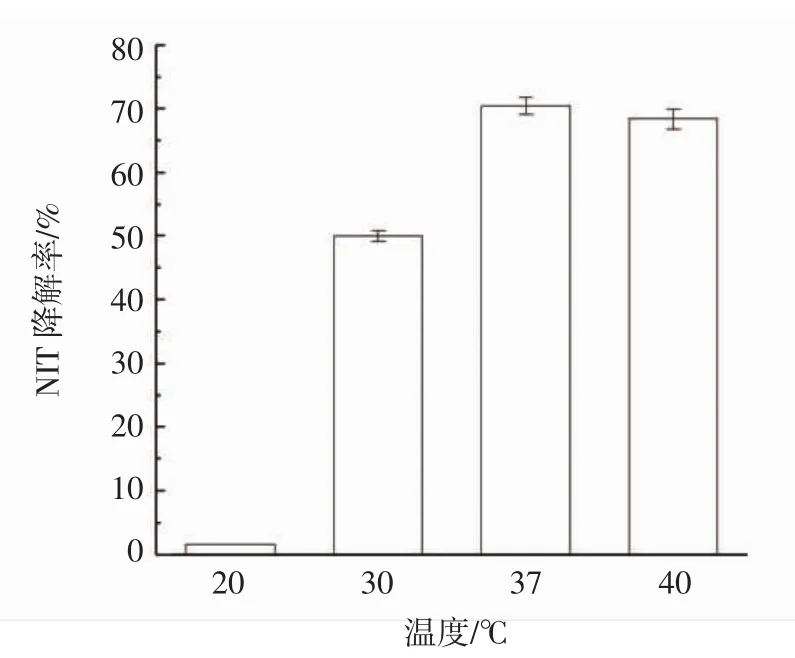
图6 不同温度条件下的NIT降解率Fig.6 NIT degradation rate under different temperature conditions
2.3.5 不同培养方式对亚硝酸还原酶活性的影响
采用静置培养和动态培养(摇床通气培养)两种培养方式,结果见图7。
由图7可知,动态培养鼠李糖乳杆菌时,其亚硝酸盐降解率较高,而静态培养对亚硝酸盐降解率相对较低,在动态培养中培养基的营养成分能被充分利用,菌株活力变强,而静态培养的菌株则相对不能充分利用营养。
2.4 亚硝酸还原酶的分离纯化
2.4.1 硫酸铵分级盐析结果分析
盐析过程酶活性见表1。
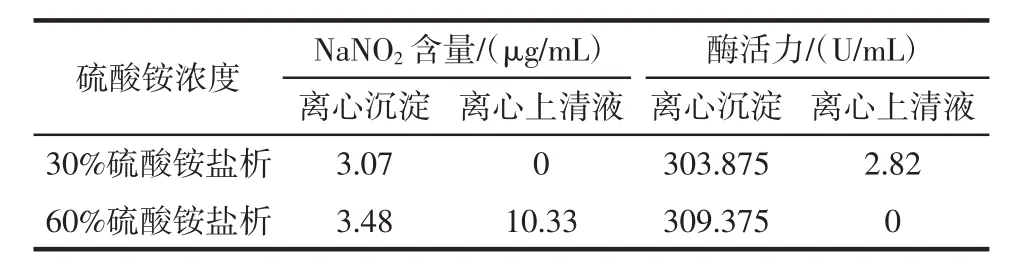
表1 盐析过程酶活性Table 1 Enzyme activity during salting out
由表1可知,经30%硫酸铵盐析处理,离心后所得蛋白沉淀测得酶活:303.875 U/mL;经60%硫酸铵处理上清液,离心后所得蛋白沉淀测得酶活力:309.375 U/mL,上清液中无酶活性。上清液已经无法检测出酶活性,表明酶蛋白已经完全经盐析沉淀下来,得到很好的分离。同时也表明,60%的硫酸铵浓度更有利于蛋白质的析出。因此,对于此还原酶来说,盐析时选择较高浓度的盐浓度(60%)比较有利于蛋白质沉淀完全。
2.4.2 DEAE阴离子层析交换结果分析
DEAE琼脂糖凝胶CL-6B层析图谱见图8。
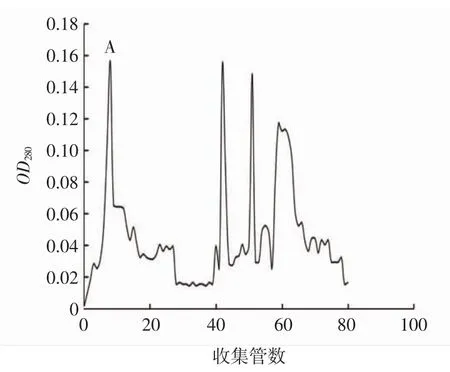
图8 DEAE琼脂糖凝胶CL-6B层析图谱Fig.8 DEAE agarose gel CL-6B chromatogram
如图8所示,DEAE琼脂糖凝胶CL-6B层析图谱包含4个洗脱峰值,收集这4个峰值附近的几个酶活力高的洗脱液进行浓缩,测定蛋白含量和酶活力。A处的洗脱液酶活力最高为764.49 U/mL,其它洗脱峰经检测后均无酶活,可能为杂蛋白。
粗酶液、盐析、透析与阴离子交换柱的蛋白含量与酶活力见表2。
由表2可知,经过盐析后亚硝酸盐还原酶的活性无显著提升,在采用透析袋,透析24 h后,经透析后测得还原酶活力为:208.48 U/mL。经透析除盐后,相对于上述盐析后的酶液酶活性有所提高。经DEAE柱层析分离纯化后还原酶的酶活力由60.83 U/mL提高到764.49 U/mL,纯化倍数为12.57倍。

表2 分离纯化亚硝酸还原酶蛋白含量及酶活力变化Table 2 Isolation and purification of nitrite reductase protein content and enzyme activity
3 结论
通过筛选多种乳酸杆菌后得出鼠李糖乳杆菌N-6所产生的亚硝酸盐还原酶的降解能力最强。进一步研究出影响鼠李糖产生NIR的最佳条件,培养基中的最适碳源、氮源、磷源、培养方式和温度分别为2%葡萄糖、0.5%酪蛋白胨、0.2%磷酸二氢钾、动态培养、37℃。
对菌液进行粗提,对结合超声波法得到的粗酶液、再经硫酸铵盐析、透析、阴离子层析法3种方法逐级分离纯化所提粗酶液,提高酶活性。经分离纯化后还原酶酶活力由60.83 U/mL提高到764.49 U/mL,有效地提高了还原酶纯度。

