金耳胞外酶代谢研究
杨学英,赵芳娟,邓百万*,解修超
(1.陕西理工大学陕西省食药用菌工程技术研究中心,陕西 汉中 723001;2.陕西理工大学生物科学与工程学院,陕西 汉中 723001)
金耳(Tremella aurantialba Bandoni et Zang.),又称黄金银耳、脑耳、黄木耳、金木耳、胶耳等,隶属于银耳目(Tremellales)银耳科(Tremellaceae)银耳属(Tremella),主要分布在我国云南、西藏等高海拔地区,是我国特有的一种珍稀食药兼用胶质真菌[1]。金耳胶质细腻、清润可口、味香色美,具有极高的营养价值和广泛的药理作用,富有营养滋补,强身保健之功效,被认为是重要的天然保健品,国际市场称之为“名山珍”[2-5]。
金耳的生长发育循环系统比较复杂,单一型的金耳纯菌丝没有分解纤维素、半纤维素和木质素的能力,自身几乎完全没有独立生长发育的能力,必须借助有亲和性的伴生菌(毛韧革菌)协同完成其生活史。毛韧革菌是金耳生长发育中不可缺少的生物因素[6],其通过分泌多种胞外酶对培养基质进行降解,为金耳的生长发育提供营养。胞外酶是指在细胞内合成而在细胞外起作用的酶,包括位于细胞外表面或细胞外质空间的酶,也指释放入培养基的酶[7]。食药用真菌生长发育过程中,一些简单的小分子物质和化学元素直接被吸收,另一些木质素及其它有机大分子物质则是通过菌丝不断向胞外分泌各种酶,将复杂大分子降解成小分子化合物,供菌丝吸收利用,胞外酶直接影响其对营养物质的生物降解能力[8-9]。因此,胞外酶的产生及变化规律在一定程度上能反映对培养基质中各种组分的利用规律[10]。目前,有关金耳的研究主要集中在金耳多糖提取及其生物学活性[11-12]、优良菌种优化筛选[13-14]和栽培技术[15-16]方面,而有关其在液体培养过程中胞外酶种类及其活性方面的研究鲜有报道。本研究通过测定毛韧革菌和金耳与毛韧革菌混合菌种在液体培养过程中10种胞外酶活性的变化,以期为金耳液体制种过程中金耳菌种质量的内控指标及其营养生理研究提供一定的参考。
1 材料和方法
1.1 材料与试剂
金耳(Tremella aurantialba)菌种(混合菌种,其内具有金耳和毛韧革菌双重菌丝)、毛韧革菌(Stereum hirsutum)菌株:陕西省食药用菌工程技术研究中心。
羧甲基纤维素钠、木聚糖、可溶性淀粉、果胶、酪蛋白、邻苯二酚、愈创木酚、3,5-二硝基水杨酸、酒石酸钾钠(均为分析纯):上海生工生物工程有限公司;ABTS(分析纯):Sigma公司;磷酸氢二钠、磷酸二氢钠(分析纯):天津市盛奥化学试剂有限公司。
固体培养基:马铃薯(去皮)200 g,葡萄糖20 g,蛋白胨5g,磷酸二氢钾5g,七水合硫酸镁3g,VB110mg,琼脂20 g,蒸馏水1000 mL,pH值自然。
液体培养基:马铃薯(去皮)200 g,葡萄糖20 g,蛋白胨5 g,磷酸二氢钾5 g,七水合硫酸镁3 g,VB110 mg,蒸馏水1 000 mL,pH值自然。
1.2 仪器与设备
立式压力蒸汽灭菌锅(LDZX-75KBS):上海博迅医疗生物仪器股份有限公司;生化恒温培养箱(SPX-25085H-II):上海新苗医疗器械制造有限公司;多振幅轨道摇床(ZWY-100H):上海智城分析仪器制造有限公司;紫外分光光度计(UV2550):日本岛津公司;恒温水浴锅(KQ5200DE):昆山超声仪器有限公司;电子分析天平(BSA8201):北京赛多利科学仪器有限公司;超净工作台(ZHJH-C111213):苏州净化仪器公司。
1.3 方法
1.3.1 活化及液体培养
在无菌条件下,切取约0.5 cm2的菌丝块接种在固体培养基平板上,24℃活化培养7 d,在500 mL三角瓶内装入250 mL液体培养基,在超净工作台中,将金耳菌种、毛韧革菌菌株各取约0.5 cm2分别接入液体培养基中,24℃、150 r/min恒温振荡,避光培养。
1.3.2 样品制备
在液体培养期间,每2 d定时取1次样品,双层滤纸过滤,发酵液经4℃、8 000 r/min离心10 min,取上清液即为粗酶液,连续测定8次,以在沸水中水浴10 min灭活的粗酶液作为空白对照。
1.3.3 葡萄糖、木糖、D-半乳糖醛酸和L-酪氨酸标准曲线制作
按参考文献[17-18]的方法,得到葡萄糖标准曲线回归方程:y=0.311 91x+0.010 4(R2=0.995 3);木糖标准曲线回归方程:y=2.387 1x-0.019 3(R2=0.998 3);D-乳糖醛酸标准曲线回归方程:y=2.791 4x-0.039 2,R2=0.997 6;L-酪氨酸标准曲线回归方程:y=0.008 4x+0.013 9,R2=0.997 7,线性关系良好。
1.3.4 胞外酶活性测定
羧甲基纤维素(carboxymethyl cellulose,CMC)酶、滤纸纤维素(filter paper cellulose,FP)酶、半纤维素(hemicellulases,HC)酶、果胶酶和淀粉酶活性测定参照参考文献[19]的方法。酶活力单位定义:在一定条件下,每分钟底物水解生成1 μmol还原糖的酶量,为1个酶活力单位(U/mL)。
蛋白酶活性测定参照参考文献[20]的方法。酶活力单位定义:在一定条件下,每分钟水解酪蛋白产生1 μg酪氨酸的酶量,为1个酶活力单位(U/mL)。
漆酶、邻苯二酚氧化酶和愈创木酚氧化酶活性测定参照参考文献[21]的方法。酶活力单位定义:在一定条件下,以反应前后吸光度值的改变值表示酶活性大小,改变0.01为1个酶活力单位(U/mL)。
过氧化物酶活性测定参照参考文献[22]的方法。酶活力单位定义:在一定条件下,以每分钟吸光度值改变值表示酶活性大小,改变0.01为1个酶活力单位(U/mL)。
1.4 数据统计分析
每次测定重复3次,取其平均值。采用Excel软件进行数据统计和制图。
2 结果与分析
2.1 CMC酶、FP酶活性变化分析
液体培养过程中CMC酶、FP酶活性变化情况见图1。
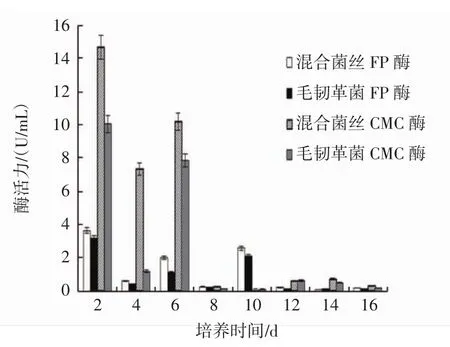
图1 液体培养过程中CMC酶和FP酶活性的变化Fig.1 Activity changes of extracellular carboxymethyl cellulose and filter paper cellulose in liquid cultivation
由图1可知,在整个发酵试验期内,毛韧革菌和混合菌丝的胞外CMC酶及FP酶活性变化规律有一定的相似性,整体上呈下降趋势。毛韧革菌和混合菌丝CMC酶活性高峰均出现在培养第2天,酶活力分别为10.051 U/mL和14.674 U/mL,随后酶活性稍有下降,在培养第6天又都出现1个小高峰,之后酶活性迅速下降,在液体培养后期始终保持在很低的水平。两者FP酶活性高峰也出现在第2天,酶活力分别为3.188 U/mL和3.633 U/mL,之后酶活性下降,而在培养第6天和第10天均分别出现1个小高峰,第10天以后两者FP酶活性同CMC酶一样,保持在很低的水平。FP酶活性峰值不止出现1次的原因可能与毛韧革菌和混合菌丝在液体培养时产生多种纤维素酶有关。从整体上看,混合菌丝相对于毛韧革菌纯培养时表现出更高的CMC酶和FP酶活性,结果表明混合培养时有相对较强的降解纤维素的能力。
2.2 HC酶活性变化分析
液体培养过程中HC酶活性变化情况见图2。

图2 液体培养过程中HC酶活性的变化Fig.2 Activity changes of extracellular hemicellulose in liquid cultivation
由图2可知,毛韧革菌和混合菌丝HC酶活性均在液体培养前期相对较高,随着培养时间的增加,酶活性都有比较明显的下降趋势。毛韧革菌HC酶活性高峰出现在培养第2天,酶活力为20.971 U/mL,而混和菌丝酶活性高峰出现在第4天,酶活力为26.067 U/mL,两者酶活性高峰出现后,酶活性均迅速下降,在8 d~16 d内酶活性都相对较低。在整个液体培养时期内,混合菌丝HC酶活性都在一定程度上高于毛韧革菌,结果表明混合培养时提高了对半纤维素的降解利用能力。
2.3 淀粉酶、果胶酶活性变化分析
液体培养过程中淀粉酶、果胶酶活性变化情况见图3。

图3 液体培养过程中淀粉酶和果胶酶活性的变化Fig.3 Activity changes of extracellular amylase and pectinase in liquid cultivation
由图3可知,毛韧革菌和混合菌丝淀粉酶活性变化趋势基本一致,两者淀粉酶活性高峰都出现在培养第2天,酶活力分别为14.781 U/mL和15.270 U/mL,随后酶活性均逐渐降低,在第6天和第14天又都出现1个小高峰,两者酶活性在发酵培养8 d~16 d内都保持在较低水平。毛韧革菌和混合菌丝果胶酶活性变化趋势存在一定的差异,两者果胶酶活性在培养2 d~4 d都处于较低水平,酶活性高峰均出现在培养第6天,酶活力分别为3.254 U/mL和5.756 U/mL,毛韧革菌酶活性达到峰值后,随着培养时间的延长,逐渐下降,而混合菌丝酶活性达到峰值后迅速下降,而后又缓慢上升,在培养第14天又出现1个小高峰,随后酶活性逐渐下降。果胶酶活性变化相对于淀粉酶存在一定的滞后性,分析其原因可能是由于菌丝体生长过程中优先利用纤维素、半纤维素和淀粉等物质,而果胶则是在营养胁迫条件下才会被利用。混合菌丝淀粉酶活性在整体上高于毛韧革菌,果胶酶活性在培养第6天前低于毛韧革菌,但在第6天及以后,酶活性明显高于毛韧革菌,从整个变化过程看,混合菌丝同毛韧革菌相比,果胶酶活性是高于毛韧革菌的,结果表明混合培养时提高了对淀粉和果胶的降解利用能力。
2.4 蛋白酶活性变化分析
液体培养过程中蛋白酶活性变化情况见图4。
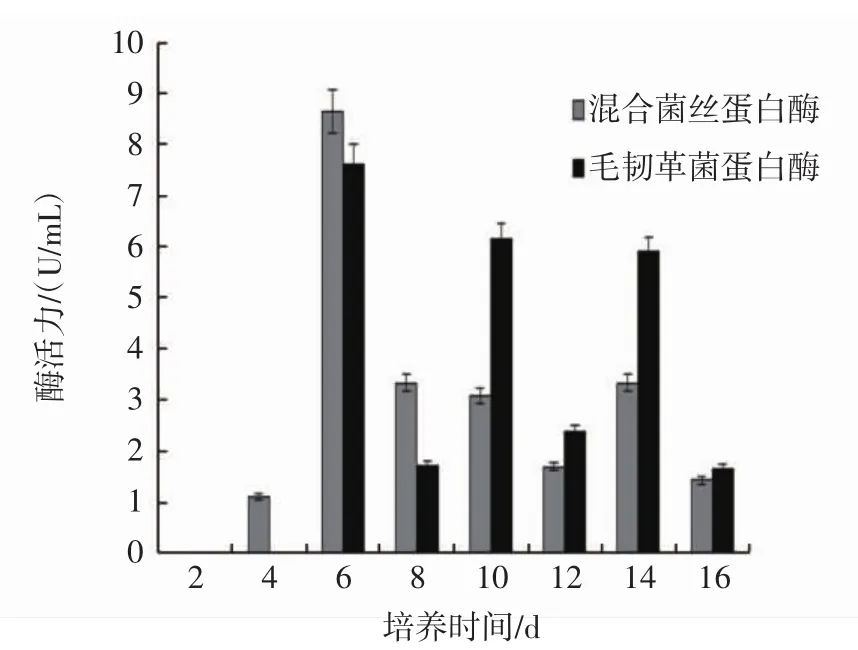
图4 液体培养过程中蛋白酶活性的变化Fig.4 Activity changes of extracellular protease in liquid cultivation
蛋白酶的主要作用是断裂蛋白质的肽键,将蛋白质分解成氨基酸、尿素、氨等小分子化合物,为菌丝的生长提供原料[23]。由图4可知,毛韧革菌和混和菌丝在液体培养过程中,蛋白酶活性变化均大致呈现“波浪”型。毛韧革菌在培养第6天及以后,混合菌丝在第4天及以后才能检测到蛋白酶活性,两者蛋白酶活性高峰均出现在培养第6天,酶活力分别为7.619 U/mL和8.650 U/mL,之后随着培养时间的延长,蛋白酶活力均时升时降,但总体来说,两者蛋白酶活性仍呈下降趋势,且在液体培养结束时,蛋白酶活性均保持在相对于培养初期来说较高的酶活性水平。混合菌丝蛋白酶活性在培养第8天及以前高于毛韧革菌,第8天以后酶活性低于毛韧革菌,从整体上看,混合菌丝同毛韧革菌相比,蛋白酶活性没有明显提高。
2.5 漆酶、愈创木酚氧化酶、邻苯二酚氧化酶和过氧化物酶活性变化分析
液体培养过程中漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性变化情况见图5、图6。
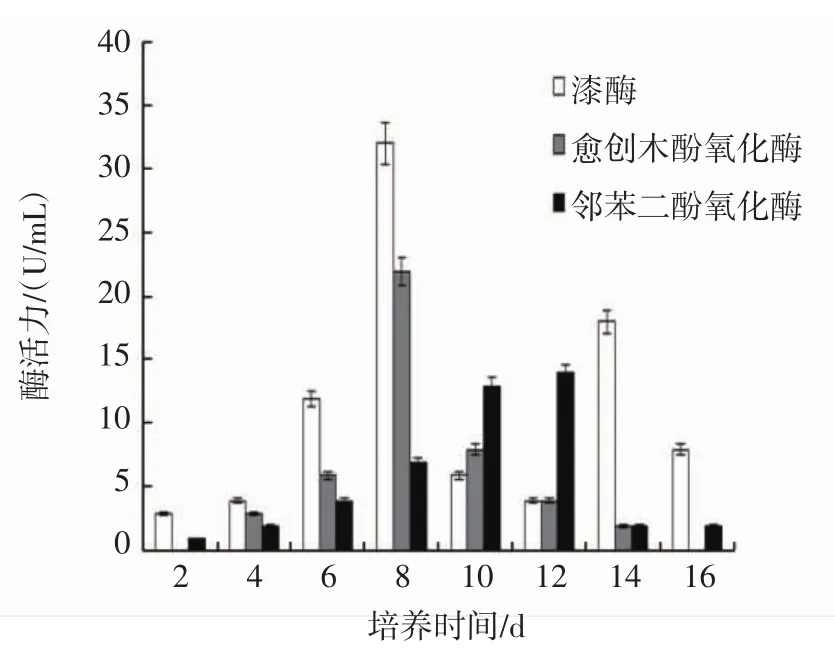
图5 金耳液体培养过程木质素降解酶活性的变化Fig.5 Activity changes of lignin degradation enzymes in in liquid cultivation of Tremella aurantialba

图6 毛韧革菌液体培养过程中木质素降解酶活性的变化Fig.6 Activity changes of lignin degradation enzymes in in liquid cultivation of Stereum hirsutum
漆酶、愈创木酚氧化酶和邻苯二酚氧化酶都属于木质素降解酶类,在木质素代谢过程中起着重要的作用,其活性大小可以反映出对木质素降解能力[24]。由图5、图6可知,毛韧革菌和混和菌丝漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性在液体培养初期酶活性均较低,随着培养时间的延长,基本呈现出先上升后下降的变化趋势。混和菌丝漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性高峰分别出现在培养第8、8、12天,酶活力分别为32、22 U/mL和14 U/mL(图5),漆酶在培养第14天又出现了1个小高峰,而愈创木酚氧化酶和邻苯二酚氧化酶在第1个活性高峰出现后酶活性逐渐下降。毛韧革菌漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性高峰分别出现在培养第10、10、12天,酶活力分别为26、11 U/mL和9 U/mL(图6),毛韧革菌漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性变化趋势与混和菌丝类似。综合比较分析,混合菌丝木质素降解酶活性均在一定程度上高于毛韧革菌,结果表明混合培养时可以提高对木质素的降解利用能力。毛韧革菌和混合菌丝液体培养过程中均未检测到过氧化物酶活性。
3 结论与讨论
毛韧革菌和混合菌丝在液体培养过程中胞外酶活性变化规律基本一致,具有明显的阶段性。两者CMC酶、FP酶、HC酶、淀粉酶活性峰值均出现在培养第2天~4天,随着培养时间的延长,酶活性有明显的下降趋势,而果胶酶活性峰值均出现在培养第6天,整体呈现出先上升后下降的变化趋势。毛韧革菌在培养第6天及以后,混合菌丝在第4天及以后才能检测到蛋白酶活性,两者酶活性都在培养第6天达到峰值,为菌丝的快速生长提供充足的氮源,在液体培养后期蛋白酶活性随着菌丝体生长速度的减缓又都逐步降低。毛韧革菌和混合菌丝漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性在液体培养前期酶活性处于较低水平,酶活性高峰均出现在培养第8天及以后,酶活性峰值出现的时间次序表明在液体培养过程中菌丝利用木质素类物质的时间较晚。
此外,研究结果显示金耳菌的存在也可能对毛韧革菌胞外酶酶活性有一定的影响,毛韧革菌液体发酵过程中,胞外CMC、FP酶、HC酶、淀粉酶、果胶酶、蛋白酶、漆酶、愈创木酚氧化酶和邻苯二酚氧化酶活性峰 值 分 别 为 10.051、3.188、20.971、14.781、3.254、7.619、26、11 U/mL 和 9 U/mL,而混合培养时,上述胞外酶活性峰值依次为 14.674、3.633、26.067、15.270、5.756、8.650、32、22 U/mL 和 14 U/mL。从整体上看,除蛋白酶外,混合菌丝胞外酶活性都在一定程度上高于毛韧革菌纯培养情况下的酶活性,表明金耳菌和毛韧革菌之间可能存在一定的互作关系,金耳的这种特性与和其同属的银耳相似。综合上述结果分析可知,金耳的伴生菌—毛韧革菌拥有极其丰富的胞外酶系,在培养基质降解方面起着极其重要作用,是其具有为金耳提供营养物质的重要生理基础,而金耳菌丝则会促进其伴生菌从基质中吸收营养,二者之间的相互作用机理有待进一步研究。

