增塑剂乙酰柠檬酸三丁酯暴露对学习记忆能力的影响及VE 保护作用
刘旭东,张智淮,杨建邦,刘良禹,朱思洁,张玉超,杨 旭
(1.茅台学院食品科学与工程系,贵州仁怀 564507;2.茅台学院酿酒工程系,贵州仁怀 564507;3.华中师范大学生命科学学院,湖北武汉 430079)
增塑剂在塑料制品中的质量百分比高达3%~30%,它与塑料基质之间非共价结合后极易溢出,从而使人们长期持续暴露于增塑剂的污染中[1]。作为使用量最大的一类增塑剂,邻苯二甲酸酯(phthalic acid esters,PAEs)类增塑剂在普通人群中持续暴露,在特殊人群中的暴露水平甚至可高达20 mg/kg·day[2],由于具有强烈的内分泌干扰作用,对生物体会产生多种毒性,尤其是生殖发育毒性,目前,PAEs 在全球范围内的使用已受到了严格的限制[3]。因此,非PAEs 类“新型增塑剂”的市场需求日益突出,目前已在多个领域(包括食品领域)均有一定的应用[4]。
乙酰柠檬酸三丁酯(acetyl tributyl citrate,ATBC)具有极低的内分泌干扰作用,被认为是PAEs 良好的替代物,已在化妆品、玩具、医疗器具等多个领域被使用,美国食品药品管理局已批准ATBC 可在食品包装材料和人造调味品中限量使用[5]。但是与PAEs 类似,ATBC 已经被证实可以从包装材料迁移至不同的产品中,迁移率高的可达79.8 mg/kg,甚至可达到PAEs 的10 倍[6−7],而随着ATBC 使用量的继续增大,部分人群甚至将受到高水平的ATBC 暴露风险。对于ATBC 生殖发育毒性研究的结果显示,ATBC 具有低生殖发育毒性[7],而对于其非生殖发育毒性研究则相对较少。目前对于ATBC 虽然尚无准确的人群暴露水平报道,但是参考PAEs 增塑剂长期使用后人群的暴露情况以及ATBC 在材料中的高迁移率,未来人们很有可能处于高水平的ATBC暴露中。所以在没有充分证明其完全安全性的情况下,将其广泛使用甚至是用于食品领域,无疑冒有巨大的风险。
PAEs 类增塑剂非生殖发育毒性研究结果显示,PAEs 暴露除了可以引起强烈的生殖发育毒性外,还可对实验动物产生神经毒性作用,引起实验动物行为异常、脑组织病理损伤、氧化应激和炎症水平上升等[8−9]。以此为参考,本研究首先判断高水平的ATBC暴露是否会导致小鼠学习记忆障碍,随后探究抗氧化维生素VE对损伤是否具有保护作用,为更全面的评价ATBC 的安全性,确保ATBC 的安全使用提供一定的参考。
1 材料与方法
1.1 材料与仪器
SPF 级C57BL/6 小鼠雄性 30 只,6~8 周龄,22±2 g,于湖北省实验动物研究中心(实验动物许可证号:SYXK(鄂)2020-0018,动物质量合格证编号:42000600038369),饲养于SPF 级实验动物房中,小鼠置于无病原专用鼠笼内,每天12 h 光照和12 h 黑暗,允许自由进食和饮水。动物饲养室内温度控制在20~25 ℃,室内相对湿度为50%~70%,保持室内安静,避免强光照,小鼠适应性饲养3 d 后开始进行灌胃暴露;ATBC(纯度>99%)、2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlordihydrofluorescein diacetate,DCFHDA)、硫代巴比妥酸(2-thiobarbituric acid,TBA) 美国Sigma-Aldrich 公司;其他试剂 均为国产分析纯;小鼠还原型谷胱甘肽(Glutathione,GSH)检测试剂盒、超氧化物歧化酶(Superoxide dismutast,SOD)活性检测试剂盒、4-羟基壬烯酸(4-hydroxynoneal,4-HNE)检测试剂盒 南京建成生物工程研究所;小鼠核转录因子(Nuclear transcription,NF-κB)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒、白介素1β(Interleukin-1β,IL-1β)检测试剂盒 上海蓝基生物公司。
ELx800 酶标仪 美国Bio-Tek 公司;Hide Chameleon V 多功能荧光酶标仪 芬兰Hidex 公司;5424R 低温冷冻离心机 德国Eppendorf 公司;DP73 显微镜 日本Olympus 公司;ANY-MazeTM动物行为学分析系统 美国Stoeling Co 公司;JLBehv-SD 小鼠跳台实验分析系统 上海吉量软件科技有限公司;Image Pro Plus(IPP)6.0 分析软件 美国Media Cybernetics 公司。
1.2 实验方法
1.2.1 ATBC 染毒液的配制及暴露 参考PAEs 特殊人群的暴露浓度和ATBC 的高迁移率,以及本研究的前期预实验结果,使用无菌生理盐水配制20 mg/mL 的ATBC 染毒液,4 ℃保存,暴露组每天使用标准灌胃针按照0.01 mL/g 体重的灌胃比例灌注相应浓度的染毒液,使得小鼠实际暴露剂量为200 mg/kg·day[2,6−7];对照组按照同样比例灌注无菌生理盐水;VE保护组在ATBC 暴露同时灌胃VE(200 mg/kg·day ATBC+50 mg/kg·day VE)[10],每组10 只小鼠,各组均连续灌胃90 d。在第84~90 d 进行水迷宫实验(共7 d),在第88~90 d 进行跳台实验,随后进行各指标的检测。
1.2.2 小鼠体重增长和脑指数测定 所有实验小鼠在暴露第1 d 称量体重,记为“初始体重(g)”,在最后一次暴露24 h 后称量体重,记为“终体重(g)”,小鼠体重增长(g)=终体重(g)–初始体重(g)。最后一次暴露24 h 后取小鼠脑组织,称量全脑重量(g),脑指数=全脑重量(g)/初始体重(g)。
1.2.3 Morris 水迷宫实验 通过水迷宫试验对小鼠的学习记忆能力变化进行检测[10],第84~88 d 为定向航行实验,主要用来测试小鼠的学习能力,通过对比不同暴露组小鼠在水池中找到逃逸平台所花费的时间,即逃逸潜伏期(Escape latency,EL)来判断不同组小鼠的学习能力强弱。每天对每只小鼠进行3 次训练,记录每只小鼠的EL。实验的第89 d 停止实验,为遗忘期。第90 d 开始空间探索实验,旨在测定小鼠的记忆能力,撤去逃逸平台,让小鼠在迷宫中游满60 s,记录小鼠在目标平台象限的时间和进入次数及游泳轨迹。
1.2.4 跳台实验 通过跳台实验对不同暴露组小鼠的学习记忆能力进行检测[11]。第88~89 d 为训练期,训练时将小鼠轻轻置于金属网上的木制平台上,给小鼠2 min 适应周围环境。2 min 后对金属网通电(36 V,50 Hz),通电持续5 min。一旦小鼠跳下平台就会受到电击,小鼠通常会再次跳回平台。通过2 d 的训练,在第90 d 对小鼠的记忆能力进行测定。记录小鼠从置于平台开始到第一次跳下平台所持续的时间,即潜伏期;以及整个通电过程中小鼠跳下平台的次数,即错误次数。
1.2.5 脑组织样品的制备 在第90 d 暴露24 h 后,用颈椎脱臼法处死子代小鼠,取小鼠全脑组织。每组随机选择3 只小鼠全脑置于4 %的多聚甲醛中进行固定,制作组织切片进行病理观察,其余全脑组织制备脑组织匀浆。将小鼠脑组织置于冷的磷酸盐缓冲液(pH=7.5)中洗净,用吸水纸吸干水分,然后放至玻璃匀浆器中,加入冷的磷酸盐缓冲液制成10 %的组织匀浆,然后在4 ℃下以10000 r/min 离心10 min,脑组织匀浆中蛋白质含量采用Lowry 法进行测定[12],将上清分装置于−80 ℃冰箱待使用。
1.2.6 脑组织病理切片制作 对子代小鼠脑组织进行石蜡包埋和切片,进行H&E 和Nissl 染色[13],随后在显微镜下进行切片观察。对Nissl 染色切片随机在脑海马区随机选择5 个视野区域,使用Image Pro Plus(IPP)6.0 软件测出Nissl 染色每张切片的光密度值(OD)进行图像定量分析[14]。
1.2.7 ROS 含量测定 用磷酸盐缓冲液将1.2.5 中制备的子代小鼠脑组织匀浆上清液稀释100 倍,采用DCFH-DA 法检测ROS 含量[15],利用荧光酶标仪在485 nm 激发光、525 nm 发射光的条件下测定荧光强度,反映样品中含有ROS 的水平。
1.2.8 丙二醛(Malondialdehyde,MDA)含量测定 取1.2.5 中制备的子代小鼠脑组织匀浆上清液,使用TBA 法测定MDA 的含量[16],MDA 能够与TBA 反应缩合形成红色产物,分别在532、600 和450 nm 波长下测定光吸光收值,按照公式:MDA(μmol/L)=6.45×(OD532−OD600)−0.56×OD450计算MDA 的含量。
1.2.9 4-HEN、GSH 含量测定 取1.2.5 中制备的子代小鼠脑组织匀浆上清液,使用4-HEN、GSH 检测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.2.10 SOD 活性测定 取1.2.5 中制备的子代小鼠脑组织匀浆上清液,使用SOD 活性检测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.2.11 NF-κB、TNF-α和IL-1β含量测定 取1.2.5中制备的子代小鼠脑组织匀浆上清液,用TNF-α和IL-1β测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.3 数据处理
采用方差分析(ANOVA)对实验数据的差异性进行检测,数据统计图使用GraphPad Prism 8.0(San Diego,美国)生成,用SPSS 13.0(SPSS,美国)分析数据。采用多重ANOVA 进行水迷宫定向航行实验数据分析,使用t检验确定各暴露组之间的差异性,其他数据采用单因素ANOVA,使用t检验分析差异性。
2 结果与分析
2.1 小鼠体重和脑指数变化
小鼠体重和脑指数的变化如图1 所示。通过90 d的200 mg/kg·day ATBC 连续暴露,小鼠的体重增长受到了显著的影响(图1A)(P<0.05),ATBC 暴露组小鼠体重增长量显著小于对照组(P<0.05)。而给与VE保护后,ATBC 对小鼠体重增长的影响有明显缓解,VE保护组小鼠体重增长量和ATBC 暴露组相比有显著性的提高(P<0.05)。ATBC 暴露对小鼠脑指数并未产生显著性影响(图1B)。

图1 小鼠体重增长量和脑指数Fig.1 Mice bodyweight increased and brain index
2.2 水迷宫实验
水迷宫实验结果如表1 和图2 所示。通过为期5 d 的定向航行训练,各实验组小鼠的EL 都明显缩短。在第88 d,暴露组EL 极显著(P<0.01)高于对照组(表1)。通过第89 d 的遗忘期,第90 d 暴露组小鼠在目标平台象限停留时间及进入次数极显著(P<0.01)高于对照组小鼠(图2A,图2B)。小鼠的游泳轨迹显示,对照组小鼠轨迹规律性较高,相对集中于平台所在象限,而200 mg/kg·day 暴露组小鼠的游泳轨迹无规则、无目的性强(图2C)。给与VE保护后,保护组小鼠EL 和ATBC 暴露组相比显著性下降(P<0.05),同时目标平台象限停留时间及进入次数显著上升,但保护组停留时间依然显著低于对照组(P<0.05),游泳轨迹规律性明显升高。
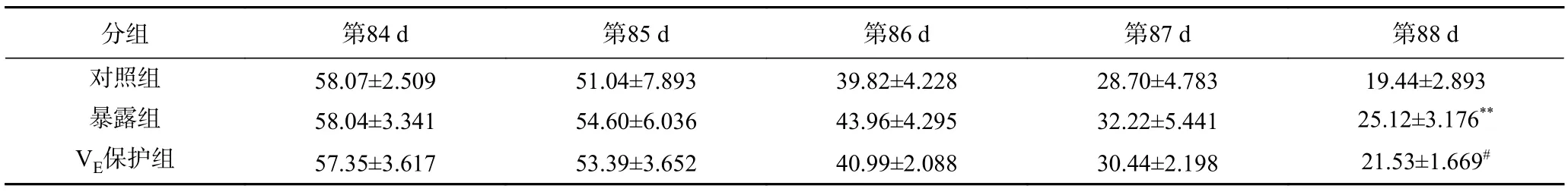
表1 小鼠逃逸潜伏期(s)Table 1 Escape latency (EL) of offspring mice of each training day (s)
2.3 跳台实验
跳台实验结果显示,与对照组小鼠相比,200 mg/kg·day 暴露组小鼠跳台潜伏期极显著性下降(图3A)而错误次数极显著上升(图3B)(P<0.01)。给与VE保护后,保护组小鼠跳台潜伏期与200 mg/kg·day暴露组小鼠相比显著性上升(P<0.05),同时错误次数显著性下降(P<0.05),但仍然显著高于对照组小鼠的错误次数(P<0.05)。

图3 跳台实验Fig.3 Step-down passive avoidance test
2.4 小鼠脑组织病理学观察
图4 显示ATBC 暴露之后小鼠脑海马和大脑皮层组织结构的变化。对照组小鼠脑海马CA1区锥体细胞分布均匀,细胞整齐排列,细胞形态完整,多数呈多角形,锥体细胞顶状树突明显可见,表现清晰。ATBC 暴露之后,锥体细胞排列松散,混乱,细胞肿胀变圆,顶状树突消失(图4A),还出现了Nissl 染色颜色变浅(图4C),Nissl 小体数量极显著下降(P<0.01,表2)。ATBC 暴露后,大脑皮层细胞虽未出现明显的形态结构改变和损伤(图4B),但神经元的数目发生了明显改变,ATBC 暴露组小鼠大脑皮层细胞数与对照组比,出现了极显著性的下降(表2)。而VE保护后,保护组和暴露组相比脑海马CA1区锥体细胞损伤明显改善,多数细胞恢复正常状态,同时Nissl小体数量也出现了明显上升,但和对照组相比依然有极显著的下降(P<0.01);大脑皮层细胞数量也显著增加(P<0.05),但仍然显著低于对照组(P<0.05)。

图4 小鼠脑海马和大脑皮层病理学观察(10×40,bar=50 μm)Fig.4 Mice brain histopathological observation of each group (10×40,bar=50 μm)
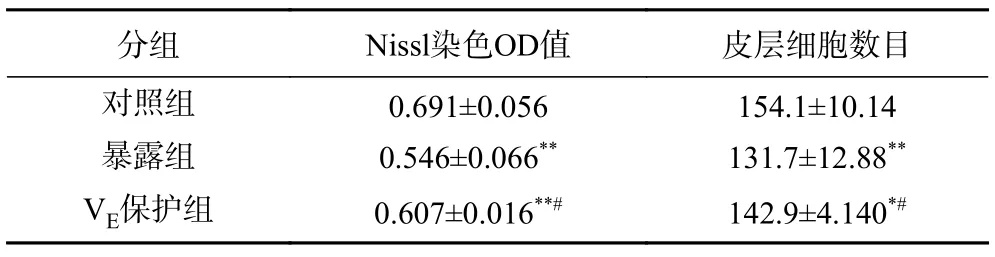
表2 Nissl 染色OD 值及大脑皮层细胞数统计Table 2 OD of Nissl staining and cell number of cerebral cortex
2.5 小鼠脑组织氧化应激和炎症水平变化
小鼠脑组织中氧化应激和炎症水平变化如图5和图6 所示。ATBC 暴露后小鼠脑组织中ROS 水平极显著性的升高(P<0.01,图5A),脂质过氧化物MDA 和4-HNE 含量的显著升高(P<0.05,图5B、图5C)。同时小鼠脑组织中GSH 含量和SOD 活性均出现了极显著性的下降(P<0.01,图5D、5E)。VE保护以后,保护组和暴露组相比脑组织中ROS、MDA 和4-HNE 含量均出现了显著下降(P<0.05),但ROS 水平依然显著性高于对照组(P<0.05);GSH含量和SOD 活性虽出现了显著性的上升(P<0.05),但和对照组比仍有显著性的降低(P<0.05)。图6 显示,ATBC 暴露后小鼠脑组织中NF-κb、TNF-α和IL-1β水平均极显著性的升高(P<0.01)。VE保护以后,保护组和暴露组相比脑组织中NF-κb、TNFα和IL-1β水平虽出现了显著下降(P<0.05),但仍然极显著高于对照组(P<0.01)。

图5 小鼠脑组织中氧化应激水平Fig.5 Oxidative level in mice brain
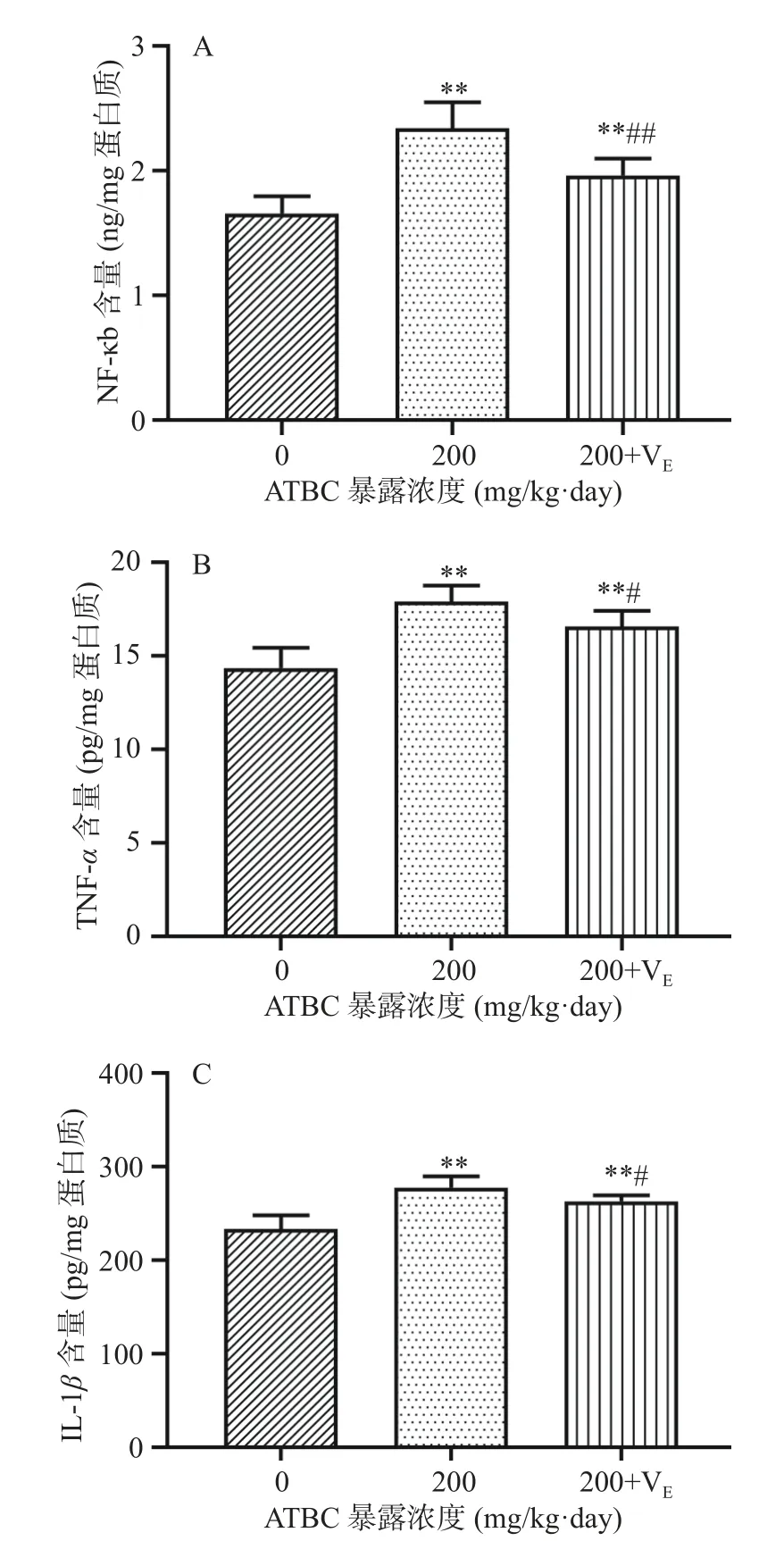
图6 小鼠脑组织中炎症反应水平Fig.6 Inflammation level in mice brain
3 讨论与结论
本研究分析了高水平ATBC 暴露后小鼠学习记忆能力的变化和脑组织损伤情况,同时采用VE作为保护剂对损伤进行保护,进一步探究保护效果和损伤机制。本研究结果显示,在水迷宫实验中,ATBC 暴露组小鼠不仅EL 显著高于对照组(P<0.05),同时在平台象限停留时间和进入次数发生了显著性的下降(P<0.05),游泳轨迹显示出盲目性。在跳台实验中,ATBC 暴露组跳台潜伏期显著下降(P<0.05),而错误次数显著上升(P<0.05)。脑海马组织和大脑皮层是认知能力和意识活动的基础,二者的损伤在PAEs 增塑剂的神经毒性研究中均有报道[8−9,14]。本研究的结果显示,ATBC 暴露导致了小鼠脑海马组织椎体神经元形态改变,Nissl 小体含量下降,Nissl 小体缺失提示椎体神经元神经递质的合成受到了影响[17];同时大脑皮层细胞数目显著减少(P<0.05)。脑海马组织和大脑皮层的损伤无疑会对脑内信号的传递、记忆的形成造成很大的影响。结果说明高水平的ATBC 的暴露导致了小鼠学习能力记忆的下降和脑组织病理学损伤。
氧化应激是引起机体细胞损伤、死亡的重要机制之一,在PAEs 类塑化剂的毒性研究中已被证实[18−21]。脑作为耗氧量和脂质含量高而抗氧化系统薄弱的组织,很容易受到氧化应激的影响[22]。体内ROS 积累,氧化应激水平提高会进一步导致生物大分子损伤[23−24]。根据氧化应激分级模型,持续的高水平氧化应激会进一步诱导炎症反应的发生,激活炎症信号通路,例如NF-κB 信号通路,可以将氧化应激信号转换成多种细胞内活动的信号,其中就包含增加炎症因子TNF-α和IL-1β的表达量[25−26]。本研究结果显示,高水平的ATBC 暴露会导致小鼠脑组织中ROS 的大量积累,机体氧化应激水平上升,脂质过氧化物MDA、4-HNE 含量显著升高(P<0.05),而GSH和SOD 等还原性物质的含量/活性则出现了下降。同时,持续的氧化应激诱导脑组织中转录因子NFκb 表达量上升,炎症因子TNF-α和IL-1β的含量上升。结果说明高水平的ATBC 暴露引起了小鼠脑组织氧化应激和神经炎症反应。
细胞内的氧化和抗氧化物质组成了一个复杂的网络,共同调节机体氧化水平,抗氧化物质不光有内源性的,还有很多外源性物质[27]。VE具有抗氧化特性,易被细胞吸收,且容易从食品、药品中获得。本研究的结果表明,添加外源VE作为保护剂后,小鼠学习记忆能力缺失有所改善,脑组织病理学损伤得到缓解,脑组织中氧化应激和炎症反应水平均显著下降(P<0.05);但是在很多指标的检测中保护组与对照组相比依然具有显著性的差异(P<0.05)。结果说明,VE可以通过下调脑组织氧化应激水平对高水平ATBC 暴露诱导的小鼠学习记忆能力缺失及脑组织损伤进行保护,也提示氧化应激是ATBC 暴露诱导神经毒性的机制之一。但是在本研究条件下VE并未使损伤完全恢复到正常水平。
综上,200 mg/kg·day ATBC 连续暴露90 d 会诱导小鼠出现学习记忆障碍、脑组织病理学损伤,脑组织中氧化应激和炎症反应水平显著上升,而VE可以通过降低脑组织中氧化应激水平,进而对ATBC 诱导的损伤进行一定程度的保护。

