中段胰腺切除术在胰腺实性假乳头状瘤治疗中的应用及疗效分析
李森,李炜,杨佳华,程鹏,陈诚,于昆,吴文韬,李刚
(1.上海中医药大学附属普陀医院 普通外科,上海 200062;2.海军军医大学附属长海医院 肝胆胰脾外科,上海 200433)
胰腺实性假乳头状瘤(solid pseudopapillary neopl-asm of the pancreas,SPNP)是一种好发于青年女性的低度恶性肿瘤,手术效果良好,复发率低[1]。影响SPNP患者预后的主要因素是围手术期并发症及残余胰腺内外分泌功能状态。中段胰腺切除术(central pancreatectomy,CP)最初用于治疗慢性胰腺炎及胰腺外伤[2-3]。1982年,Dagradi等[4]首次应用CP治疗胰腺颈部的胰岛素瘤获得成功。随着经验的积累,该术式在胰腺良性及低度恶性肿瘤的治疗中得到广泛应用。CP最大优势在于可有效降低患者术后发生胰腺内外分泌功能不足的风险,然而在术后并发症发生率方面目前仍有较多分歧。Crippa等[5]报道,相较于远端胰腺切除术(distal pancreatectomy,DP),CP的疗效相当,安全可行。而另有研究显示,CP增加了术后并发症尤其是胰瘘的发生率[6]。以往研究多为异质性病例,混杂了神经内分泌肿瘤、囊腺瘤、导管内乳头状黏液性肿瘤、实性假乳头状瘤等多种肿瘤。为排除病例异质性导致的结果偏倚,我们报道一组CP治疗胰颈部或近体部SPNP的病例,评估手术适应证,分析围手术期并发症及远期预后情况,旨在为CP在SPNP治疗中的合理应用提供一定依据。
1 资料和方法
1.1 一般资料
检索2010年1月至2015年12月在海军军医大学附属长海医院肝胆胰脾外科接受胰腺手术的患者临床病例资料。入组标准包括:(1)单发的肿瘤;(2)肿瘤位于胰腺颈部或近端胰体部;(3)接受中段胰腺切除术或远端胰腺切除术(保脾或不保脾);(4)术后病理诊断为胰腺实性假乳头状瘤。通过住院及门诊病历系统、电话随访统计患者的性别、年龄、症状、肿瘤大小及部位(影像学)、术中情况、术后并发症及远期预后等信息。所有患者均签署手术相关知情同意书,未成年(<18岁)患者由其监护人代签。
1.2 手术方案
1.2.1 中段胰腺切除术(CP)
探查:取上腹正中切口,探查盆腹腔,打开胃结肠韧带,进入小网膜囊。将胃向上、横结肠及系膜向下牵引,显露胰腺,评估残余胰腺大于5 cm。
切除:解剖分离肠系膜上静脉、门静脉、肝总动脉和脾动脉。打通胰颈后“隧道”(即胰腺颈部与肠系膜上静脉/门静脉之间隙)。于十二指肠侧距肿瘤1 cm处切断胰腺,将肿瘤及远端胰腺向上向左牵拉,在脾血管前方游离远端胰腺至肿瘤左侧1 cm处作为左切缘,继续游离远端胰腺约2 cm保证残端有一定的活动度以备吻合。切断胰腺,标本送术中冰冻病理(包括肿瘤及切缘)。
吻合:在胰头侧单独结扎主胰管,胰腺断端间断缝合。远端胰腺主胰管内置入支撑管,断端与空肠行黏膜对黏膜吻合法(Roux-en-Y法)(图1)。
1.2.2 远端胰腺切除术(DP)
探查步骤同CP。
保留脾脏:充分切开胰腺体尾部下缘腹膜,分离胰腺后方疏松间隙,将胰腺与脾静脉一起从腹膜后游离,于胰腺后方显露脾静脉及胰腺汇入脾静脉的静脉分支,均予以仔细结扎切断。沿胰腺上缘打开后腹膜,显露脾动脉主干,分离、结扎切断脾动脉向胰腺分出的各分支血管。于十二指肠侧距肿瘤1 cm处切断胰腺,在胰头侧单独结扎主胰管,胰腺包膜间断缝合。将肿瘤及远端胰腺向上向左牵拉,在脾血管前方游离远端胰腺至脾门部,完整切除远端胰腺(图2),标本送术中冰冻病理。

图2 保留脾脏的远端胰腺切除术
不保留脾脏:解剖分离肠系膜上静脉、门静脉、肝总动脉和脾动脉,打通胰颈后“隧道”。于根部结扎切断脾动脉,后在于十二指肠侧距肿瘤1 cm处切断胰腺,将肿瘤及远端胰腺向上向左牵拉,暴露脾静脉并于根部结扎切断,注意保护肠系膜下静脉。沿左侧肾血管及左肾表面游离远端胰腺及肿块直达脾门部;依次钳夹、切断、结扎脾结肠韧带、脾肾韧带、脾膈韧带、脾胃韧带,完整游离脾脏,移除标本送术中冰冻病理,单独结扎主胰管,胰腺断端间断缝合(图3)。

图3 不保留脾脏的远端胰腺切除术
1.3 术后并发症
胰瘘、出血、腹腔感染、胃排空障碍等并发症定义及分级标准均参考中华医学会外科学分会胰腺外科学组等在2017年公布的指南共识[7]。其中胰瘘的定义为:胰瘘是胰腺导管上皮与其他上皮表面的异常通道,内含源自胰腺富含酶类的液体。胰瘘诊断标准:术后≥3 d任意量的引流液中淀粉酶浓度高于正常血清淀粉酶浓度上限3倍以上,同时必须有相应临床表现。新发糖尿病,是指由于胰腺切除术或慢性胰腺炎等因素使胰腺实质缺失或弥漫性破坏,导致胰岛素缺乏及相关器官对胰腺激素的反应减弱,从而引起糖代谢受损[8]。胰腺外分泌功能不全,是指由于各种原因引起的胰酶分泌不足或胰酶分泌不同步,而导致患者出现营养消化吸收不良等症状[9]。
1.4 统计学分析
2 结果
共37例患者入组,所有患者均行手术治疗,术后病理证实为SPNP。其中CP组12例,DP组25例,两组患者在性别、年龄、肿瘤直径、基础疾病(如高血压、糖尿病)、腹部手术史、ASA分级等方面差异无统计学意义(P>0.05),组间具有可比性。具体见表1。
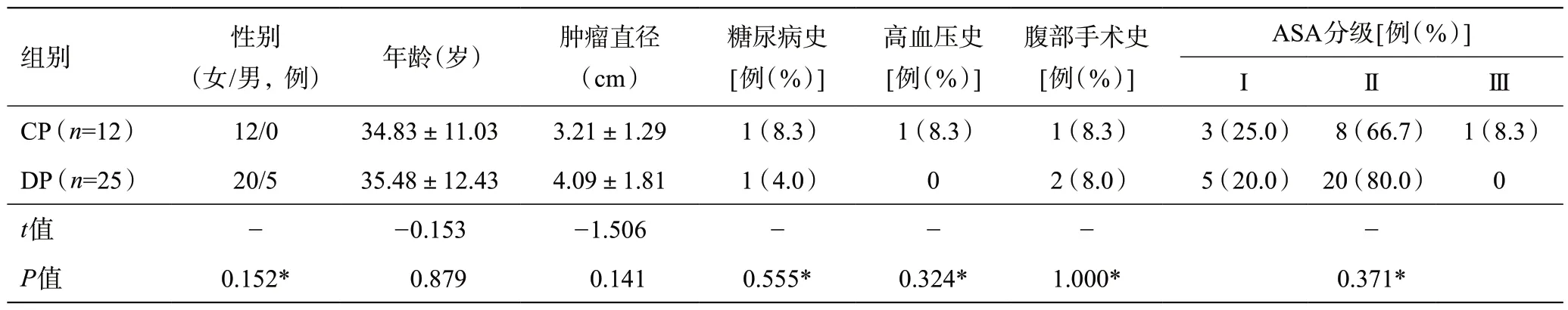
表1 两组患者术前一般资料比较
术中情况方面,两组在手术时间、失血量、术中输血量等方面差异无统计学意义(P>0.05);术后并发症方面,两组在B/C级胰瘘、出血、腹腔感染、胃排空障碍、住院时间等方面差异无统计学意义(P>0.05)。两组均无围手术期死亡病例。具体见表2。

表2 两组术中情况、术后并发症发生率比较
术后随访期截止至2018 年12 月。术后随访期间,共失访5例,其中CP组失访1例,DP组失访4例。CP和DP组出现新发糖尿病例数分别为1 例和6 例(9.1%vs28.6%,P=0.37),发生外分泌功能不全的病例数分别为0例和3例(0vs14.3%,P=0.53),无肿瘤复发病例。具体见表3。

表3 两组新发糖尿病、胰腺外分泌功能不全的比较[例(%)]
3 讨论
SPNP是一种具有复发及转移倾向的低度恶性肿瘤,其术后5年及10年无瘤生存期分别为95.4%及93.7%[10]。本研究中DP组和CP组均未发现术后复发病例,可见在肿瘤完全切除(R0切除)的情况下可获得良好的预后;影响患者预后的主要因素为术后并发症及胰腺内外分泌功能的保留情况。然而对于胰腺颈部或近体部肿瘤而言,DP将损失大部分胰腺实质,随之可能导致患者出现胰源性糖尿病及外分泌功能不全,从而严重影响患者的生活质量。虽有研究显示,保留25.0%的胰腺可维持正常的内分泌功能,而保留10.0%以上的胰腺组织可基本维持外分泌功能,但这与胰腺组织本身的结构及功能(如胰腺纤维化的程度、胰岛细胞的功能状态等)密切相关,多数胰腺大部分切除术后的患者仍需口服胰酶制剂以维持正常的胰腺外分泌功能[11-13]。因此最大限度地保留胰腺实质是降低新发糖尿病与胰腺外分泌功能不全发生率的根本办法。
CP是一项保留胰腺实质的手术,仅切除胰颈部和近端胰体部,保留胰头部和胰尾部。1957 年,Guillemin等[2]对一位慢性胰腺炎患者实施了CP;1959年Letton等[3]应用CP治疗胰腺横断伤;Dagradi等在1984年首次应用CP治疗胰颈部胰岛素瘤[4];均取得良好效果。随后该术式被广泛应用于治疗胰腺良性或低度恶性肿瘤,至今已有大量病例系列报道及荟萃分析。国外学者总结CP适应证包括[4]:良性或低度恶性肿瘤,如神经内分泌肿瘤、黏液性和浆液性肿瘤、非侵袭性导管内黏液性乳头状瘤、实性假乳头状瘤,CP可获得阴性切缘者,且远端残胰长度大于5 cm;小肿瘤但位于胰腺实质内部,不适合行剜除术者;肿瘤直径2~5 cm,剜除术可能导致主胰管损伤者;非肿瘤性囊性病变(如淋巴囊肿、皮样囊肿等)不适于剜除术者;胰颈部转移灶(尤其适用于肾癌转移)和转移性神经内分泌癌正接受综合治疗者;炎性肿块伴有主胰管局限性狭窄者。国内学者与上述观点基本一致[14]。本研究中术式选择参考上述适应证,其中CP组有1例肿瘤直径虽大于5 cm,但该患者术前有较重的2 型糖尿病,为尽可能保留胰腺内分泌功能仍行中段胰腺切除,术后随访糖尿病未见加重。可见尽管肿瘤体积较大,但在保证远端残胰大于5 cm的情况下,该术式仍不失为一种选择。其余11 例肿瘤均靠近主胰管,虽有1 例最小直径仅为1.5 cm,但其位置深,且术前未能排除胰腺导管腺癌,故仍行CP加术中冰冻而未行剜除术。根据我们的经验,SPNP在初期肿瘤较小时多表现为实性肿块,其生长方式更倾向于向内生长,后期肿瘤逐渐增大并发生囊性变后向胰腺外膨出。加之颈部或近体部为胰腺组织最薄处,即使肿瘤直径较小仍有很大机会贴及甚至侵及主胰管,故较少行剜除术。
目前CP在预防术后胰腺内外分泌功能不全中的作用已得到广泛认可,但在围手术期并发症,尤其是胰瘘的发生率上仍有分歧。Crippa等[5]研究发现,DP组患者术中出血量和输血量明显高于CP组。两组在总体并发症、腹部并发症、总胰瘘、B/C级胰瘘发生率方面无统计学差异,而DP组新发内、外分泌功能不全的发生率明显高于CP组。一篇荟萃分析结果也显示,DP组与CP组的B/C级胰瘘发生率无统计学差异[15]。Iacono等[6]的一项含94项研究共纳入963例患者的荟萃分析结果显示,与DP相比,CP具有明显更高的术后总并发症发生率(46%vs29%)和更高的胰瘘发生率(31%vs14%,P<0.001),但是发生胰腺内分泌功能不全的风险较低(4%vs23%)。我们认为,上述研究的病例异质性过大可能是胰瘘发生率结果相悖的原因之一。如上文Iacono等[6]的研究中包含17.9%的IPMN,该病主胰管被黏蛋白阻塞而使主胰管直径发生改变,同时反复发生胰腺炎导致胰腺纤维化的程度增加等情况均有可能影响胰瘘的发生率。有的研究中还包含胰腺导管腺癌[16],其胰腺纤维化程度较低度恶性肿瘤如胰腺实性假乳头状瘤、黏液性囊腺瘤等明显增高,根据我们的观察,这种质地坚韧的胰腺的胰瘘发生率较正常胰腺低。
在本研究中,37例均为实性假乳头状瘤,CP与DP两组患者新发糖尿病、外分泌功能不全的发生率均无统计学差异,考虑与病例数较少有关。尽管如此,我们仍可观察到CP在预防外分泌功能不全中所具有的优势。理论上讲CP存在两个胰腺残端,而且由于十二指肠乳头的存在,胰头侧胰管压力相对高,导致胰瘘发生率较高。而我们观察到本研究中两组B/C级胰瘘的发生率相近(16.7%vs12%)。我们认为胰瘘的发生率与两个胰腺残端的处理方式密切相关。本研究中远胰尾侧残端采用“远端胰腺空肠Roux-en-Y吻合”。亦有术者认为,与胰空肠吻合术相比,胰胃吻合术术后胰瘘的发生率更低,且内镜下可直接观察吻合口状态[17];但因为胃液使得消化酶失活从而发生外分泌功能障碍的风险更高[17-18],我们认为这与CP这一术式的核心优势存在矛盾。同时有学者研究报道,CP中应用胰空肠吻合(PJ)较胰胃吻合(PG)更有优势,因为前者的胰瘘发生率(37.5%vs76.9%,P=0.003)及B/C级胰瘤发生率(31.3%vs46.1%,P=0.012)均显著低于后者[19]。综上因素,笔者不推荐CP行胰胃吻合。近端残胰采用手工缝合法,即“近端主胰管结扎、胰腺包膜间断缝合”。目前研究未显示出闭合器法较手工缝合法有明显优势[20],而且在肿瘤较大且侵犯胰头侧较多时,手工缝合法更方便易行,易于保留更多的胰腺实质。也有外科医师采用双吻合法,但术后胰瘘发生率较高,可能与两个吻合口间肠袢内压高不利于吻合口愈合有关,目前较少采用[21]。亦有国外学者采用不吻合法,即结扎两侧主胰管并关闭两侧断端,术后未见胰瘘、出血,但远期疗效不明,且远端胰腺有显著的阻塞性胰腺炎风险[22],目前国内尚无应用经验。
随着微创外科技术的进展,腹腔镜和机器人辅助的CP也日趋成熟。已有部分研究显示,相较于传统开腹手术,微创CP具有其具有创伤小、术后恢复快以及切口感染率低等优点,而并不增加胰瘘、出血等风险[23-24]。
4 结论
综上,对于胰颈部或近体部胰腺实性假乳头状瘤而言,CP可达到根治效果,并能降低术后新发糖尿病及胰腺外分泌功能不全的风险,使患者获得更佳的生活质量。未来研究中,需开展大样本随机对照试验来证实其安全性及有效性。选用适宜的残端处理方法可有效控制胰瘘发生率,微创CP是未来的发展方向。

