基于HPLC-MS测定牛奶和奶粉中黄曲霉毒素方法的优化
曹叶中 蔡文


摘要 [目的]建立液相色谱-质谱联用技术(HPLC-MS)同时检测牛奶和奶粉中的5种黄曲霉毒素B1、B2、G1、G2、M1的方法。 [方法]样品用含0.5%乙酸乙腈为提取溶剂,通过硫酸镁和氯化钠促进水-乙腈分层,经正己烷除脂净化后用液质联用技术进行检测。[结果]各黄曲霉毒素线性范围为1.0~5.0 ng/mL,确定系数(R2)均大于0.999 0;牛奶加标平均回收率为77.06%~101.28%,RSD为2.38%~722%;奶粉加标平均回收率为57.00%~99.86%,RSD为2.00%~8.37%。 [结论]该方法可同时测定牛奶和奶粉中的5种黄曲霉毒素,具有操作方便、分析速度快、选择性强、定性准确等优点,可用作牛奶和奶粉中黄曲霉毒素的定量测定。
关键词 液相色谱-质谱联用技术;牛奶;奶粉;黄曲霉毒素;测定
中图分类号 TS.252.7文献标识码 A文章编号 0517-6611(2021)02-0201-03
doi:10.3969/j.issn.0517-6611.2021.02.054
开放科学(资源服务)标识码(OSID):
Optimization of Aflatoxin Determination Methods in Milk and Milk Powder by HPLCMS
CAO Yezhong, CAI Wen
(Suzhou Food Inspection and Testing Center, Suzhou, Jiangsu215000)
Abstract [Objective] To establish a high performance liquid chromatographymass spectrometry (HPLCMS) method for the detection of five aflatoxin B1, B2, G1, G2, M1 in milk and milk powder. [Method] The sample was extracted from acetonitrile containing 0.5% acetate, and the wateracetonitrile was stratified by magnesium sulfate and sodium chloride. Then the sample was purified by nhexane and then detected by HPLCMS. [Result] There was a good relationship between the area ratios of the monitored ion peaks and the mass concentration linearity in the linear range of 0-5.0 ng/mL. All the R2 were better than 0.999. The recovery range of milk was 77.06%-101.28%, and RSD was 2.38%-7.22%;the recovery rate of milk powder was 57.00%-99.86%, RSD was 2.00%-8.37%. [Conclusion] The method can be used for the quantitative determination of five aflatoxin in milk and milk powder at the same time, with the advantages of convenient operation, fast analysis, strong selectivity and accurate qualitative determination.
Key words High performance liquid chromatographymass spectrometry;Milk;Milk powder;Aflatoxin;Determination
黃曲霉毒素(Aflatoxin,AFT)是由黄曲霉、寄生曲霉和少量特异曲霉产生的次生毒性代谢物[1],常见类型分别为B1、B2、G1、G2、M1、M2等,其中B1对人类健康的危害最大,被世界卫生组织国际癌症研究机构列为1类致癌物[2]。人们接触黄曲霉毒素的主要来源是污染的食物,在热带和亚热带等湿热地区,黄曲霉毒素对花生、核桃、玉米、稻米、大豆、小麦等粮油产品的污染概率最高[3]。M1主要在牛奶中存在[4],养殖奶牛的饲料在被AFB1污染后,奶中会产生AFB1的羟基化代谢产物AFM1[5],对人类健康造成极大威胁。
目前国内外对牛奶和奶粉中的黄曲霉毒素,除了M1之外,其他均未单独制定残留限量标准。现行的行业标准SN/T 1664—2005[6]和国家标准GB/T 23212—2008[7]是采用液相色谱荧光检测法测定牛奶、奶粉中的5种黄曲霉毒素B1、B2、G1、G2、M1。此检测流程需要经过免疫亲和柱净化,再分别利用过溴化吡啶和三氟乙酸进行衍生化处理,最后通过带有荧光检测器的高效液相色谱仪测定[8-9]。但该检测手段操作繁琐、耗费时间长,且免疫亲和柱的成本颇高,同时受到氮气流强度等外界因素的影响,容易出现衍生化反应不稳定、回收率低和重现性差、假阳性结果等现象[10]。因此,建立简单、快速、准确的AFT检测方法十分必要。笔者基于HPLC-MS技术对5种黄曲霉毒素的测定方法进行优化,旨在为牛奶和奶粉中黄曲霉毒素残留的定量测定和确证检测提供参考。
1 材料与方法
1.1 材料
1.1.1 样品。
宁波鲜牛奶,惠氏奶粉(0~6个月段)。
1.1.2 主要仪器。
三重四级杆质谱仪(AB Scies API 4000,沃谱达仪器苏州有限公司);台式高速冷冻离心机(H1850R,湖南湘仪仪器厂);塑料离心管(Falcon,美国BD公司);套式恒温器(TC-15,新华医疗器械厂);高效液相色谱仪(Agilent 1290,美国Agilent公司);Analyst软件(Versin 2.4,美国应用生物系统公司)。
1.1.3 主要试剂。
黄曲霉毒素标准品B1、B2、G1、G2、M1:上海安谱科技公司;乙腈:色谱纯,美国TEDIA;氯化钠、硫酸镁:分析纯,国药集团化学试剂有限公司;乙酸:分析纯,上海阿拉丁生化科技有限公司;正己烷:分析纯,上虞市双良化工设备有限公司;N-丙基乙二胺(PSA):分析纯,北京中仪宇盛科技有限公司;C18粉:分析纯,上海博势生物科技有限公司。
1.2 方法
1.2.1 前处理条件的优化。
黄曲霉毒素不溶于非极性溶剂,但可以在有机溶剂中溶解,因此一般用甲醇或乙腈作为提取剂。虽然黄曲霉毒素难溶于水,但如果提取过程中有一定比例水存在,就可以在提取时提高有机溶剂的渗透率,萃取效率也会提高[11]。因此,该研究采用乙腈(含乙酸)和水混合液作为提取液。
目前检验检疫行业标准SN/T 1664—2005和国家标准GB/T 23212—2008中,主要是采用免疫亲和柱,在柱内形成特定的抗原-抗体复合物,这种净化方法专一性强。但对于企业来讲,该方法检测成本高,尤其对于牛奶和奶粉样品,加水后样品易混浊,过柱时间长。故该研究采用类似于QuEChERS[12]的前处理方法,即用5 g MgSO4∶NaCl(4∶1)进行提取,然后通过正己烷完成除脂净化,使提取过程更加方便经济。
1.2.2 样品前处理。
分别准确称取5.0 g牛奶和2.0 g奶粉(精確至0.001 g)到50 mL塑料离心管内,奶粉另加入2 mL超纯水。在样品中加入黄曲霉毒素标准溶液100 μL,加入乙腈(含0.5%乙酸)+水20 mL,样品经过5 min高速混匀后放入50 ℃水浴中超声15 min,然后高速离心5 min(转速8 000 r/min),取上清液10 mL至离心管中,采用4种不同的提取和净化方法(表1),用50 ℃下氮气流吹干,加入1.0 mL乙腈+水(含0.5%乙酸)(1∶1)将壁上的残留溶解,用0.22 μm尼龙滤膜过滤到进样瓶中。
1.2.3 液相条件的选择。
为优化5种黄曲霉毒素的分离条件,选择合适的色谱柱,经查阅相关文献[13-14],多采用BEH C18或类似色谱柱。该研究采用适于酸性条件的常用色谱柱SB-C18(4.6 mm×150 mm×5 μm),柱温35 ℃,进样量10 μL,流速0.8 mL/min,流动相A为乙腈(0.1%乙酸),流动相B为水(0.1%乙酸)。梯度程序为:3 min B 90%、10 min B 10%、12 min B 10%、12.1 min B 90%、15 min B 90%,2 μg/L。
2 结果与分析
2.1 提取溶剂、净化条件的选择
对牛奶和奶粉前处理中不同提取和净化过程的回收率进行比对,结果见图1。由图1可知,处理①牛奶中5种黄曲霉毒素的回收率较高,且较为稳定;奶粉中虽然采用处理④的回收率最高,但综合考虑回收率和成本等因素,处理①的净化过程对牛奶和奶粉的回收率较好。因此,本研究选用处理①的方法,即用5 g MgSO4∶NaCl(4∶1)进行提取,然后通过正己烷除脂净化。
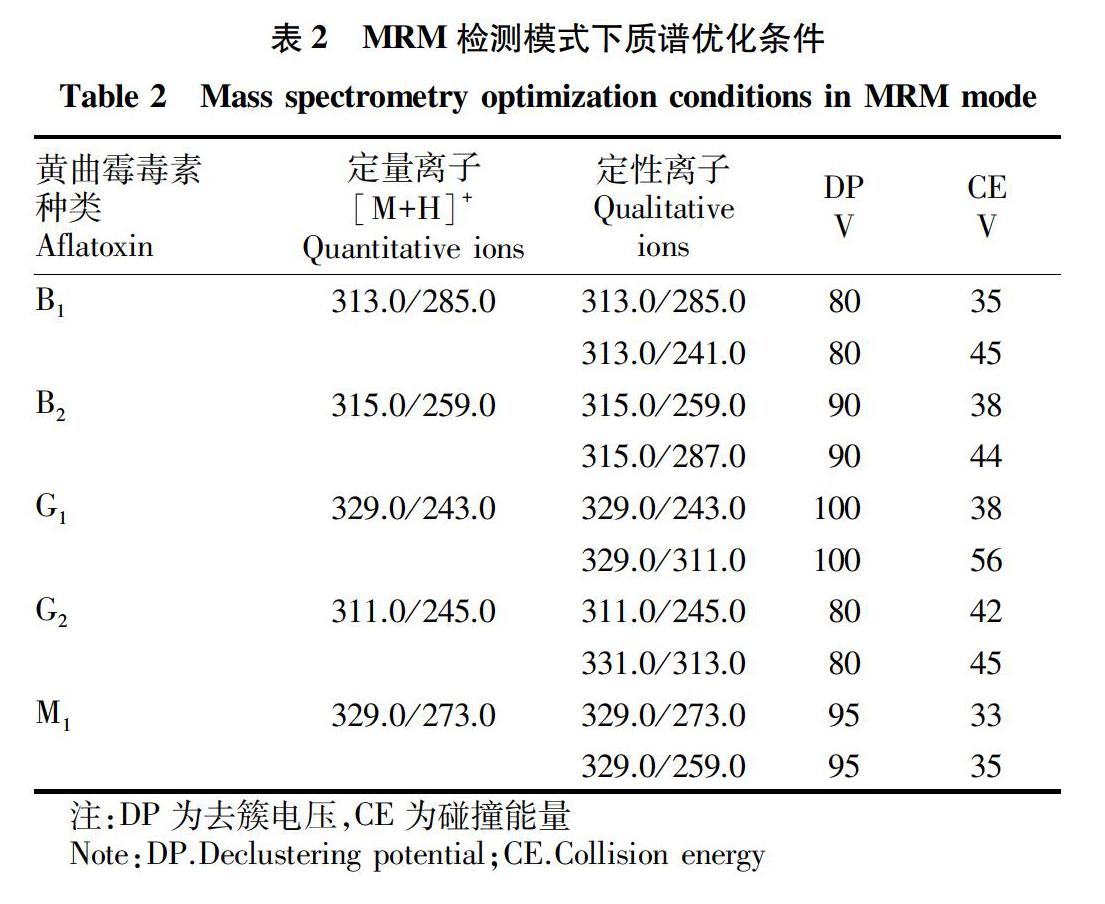
2.2 质谱优化条件
分别吸取5 μg/mL黄曲霉毒素标准溶液,运用电喷雾(ESI)电离,用针泵注入离子源时用10 μL/min流速,利用一级质谱分析(Q1扫描)技术,分析物在正离子扫描下可以得到分子离子峰。
在正离子模式下,5种黄曲霉毒素均可以得到很强的[M+H]+信号,对去簇电压优化,得到强度最大的分子离子峰,然后运用2级的质谱分析(子离子扫描)黄曲霉毒素化合物的分子离子峰,使碎片离子峰的强度提高可以通过优化碰撞能量实现。优化条件如表2所示。
为选取丰度较强、影响较小的2对子离子为定性离子需要优化撞击的能量。对其他参数数据进行调整优化,可以得到最佳质谱检测条件:离子喷雾电压IS,4 500 V;雾化气GS1,4.14×105 Pa;辅助加热气温度TEM,500 ℃;幕帘气CUR,1.38×105 Pa;碰撞气CAD,0.69×105 Pa;去溶剂气GS2,4.14×105 Pa;入口电压EP,10 V。
2.3 基质效应影响
有研究表明,样品基质会对大气压喷雾电离的离子源(ESI)产生一定的影响[15]。该研究采用外标定量法,能更好地降低基质效应带来的影响。为了测定结果更加准确,采用基质加标工作曲线,从而消除操作过程中的系统误差。结果显示,牛奶和奶粉的基质效应影响较小,均小于10%(表3)。
2.4 线性关系和检测限
用初始流动相制备黄曲霉毒素01、0.5、1.0、2.0、5.0 ng/mL不同基质的加标工作曲线,进行液质联用检测分析,
以峰面积(Y)为纵坐标、质量浓度(X)为横坐标,对峰面积与质量浓度进行线性拟合。
结果显示,监测的峰面积与质量浓度在1.0~5.0 ng/mL范围内线性关系良好,R2都大于0.999 0,能够满足样品测定标准及要求(表4)。根据各定量离子色谱峰3~10倍信噪比(S/N),计算检出限(LOD)和定量限(LOQ),结果见表4。
2.5 回收率及精密度
在不含黄曲霉毒素的空白样品牛奶中分别添加1.25、2.50、5.00 ng (即0.25、0.50、1.00 μg/kg)不同黄曲霉毒素水平,奶粉中分别添加1.0、2.0、4.0 ng (即0.50、1.00、2.00 μg/kg)不同水平黄曲霉毒素,每个水平独立测定6次。结果显示,牛奶加标回收率为77.06%~101.28%,RSD为2.38%~7.22%(表5);奶粉加标回收率的范围在57.00%~99.86%,RSD为2.00%~8.37%(表6),说明该方法的回收率和精密度良好。
3 结论
(1)该研究通过对各项试验结果的对比,得到最优的提取和净化方法,通过对质谱仪各项数据的调整,使检测灵敏度达到最佳。各黄曲霉毒素线性范围为1.0~5.0 ng/mL,R2均大于0.999 0,牛奶加标平均回收率为77.06%~101.28%,RSD为2.38%~7.22%;奶粉加标平均回收率为57.00%~99.86%,RSD为2.00%~8.37%,数据均符合标准。
(2)该研究建立了液质联用技术同时测定牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1的方法,该方法操作方便快速,准确度与灵敏度良好,可定量测定和确证检测牛奶和奶粉中5种黄曲霉毒素的残留。
参考文献
[1] ISMAIL A,GONALVES B L,DE NEEFF D V,et al.Aflatoxin in foodstuffs:Occurrence and recent advances in decontamination[J].Food research international,2018,113:74-85.
[2] KHAYOON W S,SAAD B,LEE T P,et al.High performance liquid chromatographic determination of aflatoxins in chilli,peanut and rice using silica based monolithic column[J].Food chemistry,2012,133(2):489-496.
[3] SPENCER SMITH J,PAUL WILLIAMS W,WINDHAM G L.Aflatoxin in maize:A review of the early literature from "moldycorn toxicosis" to the genetics of aflatoxin accumulation resistance[J].Mycotoxin research,2019,35(2):111-128.
[4] 李松励,闵力,高亚男,等.我国生鲜乳中黄曲霉毒素M1污染风险分析[J].动物营养学报,2018,30(12):5202-5209.
[5] 熊力力,吴文旋,王翀,等.湖北省奶牛精料原料及牛奶中黄曲霉毒素污染调查[J].中国畜牧杂志,2019,55(2):137-141.
[6] 李佐卿,康继韬,孙大为,等.牛奶和奶粉中黄曲霉毒素M1、B1、B2、G1、G2含量的测定:SN/T 1664—2005[S].北京:中国标准出版社,2006.
[7] 陈瑞春,段文仲,吕红英,等.牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1、M2的测定 液相色谱-荧光检测法:GB/T 23212—2008[S].北京:中国标准出版社,2009.
[8] 陈梦,邹小龙,范蕾,等.高效液相色譜法测定牛奶中黄曲霉毒素M1含量的不确定度评定[J].分析测试技术与仪器,2020,26(1):71-75.
[9] 李莉,金铭特.应用高效液相色谱法检测食品中黄曲霉毒素[J].食品安全导刊,2018(12):104.
[10] 刘明理,曹进,张庆生,等.牛奶及乳粉中黄曲霉毒素M1的液相色谱-质谱检测比较研究[J].药物分析杂志,2017,37(3):471-476.
[11] 刘英,胡建华,刘春朝.黄曲霉素毒理效应及检测方法[J].生物加工过程,2013,11(3):83-88.
[12] 凌阿茹,郭文博,杨俊花,等.QuEChERS-超高效液相色谱-串联质谱法同时测定畜禽组织中6种黄曲霉毒素和杂色曲霉素[J].色谱,2018,36(5):439-445.
[13] 郑润生,徐晖,王文丽,等.苦杏仁中黄曲霉毒素B1,B2,G1,G2的液质联用检测分析[J].中国中药杂志,2013,38(20):3534-3538.
[14] 童圆,张惠贤,周有祥,等.固相萃取-高效液相色谱荧光法测定液态奶制品中的黄曲霉毒素M1和B1[J].农产品质量与安全,2017(2):56-60.
[15] 苏萌,艾连峰.液相色谱-串联质谱基质效应及其消除方法[J].食品安全质量检测学报,2014,5(2):511-515.

