接种嗜热侧孢霉对堆肥木质纤维素降解的影响
罗晓莎 王明明 宋颀 陈舒 钱俊伟


摘要 以猪粪和木屑为堆肥试验材料,研究接种嗜热侧孢霉对堆肥温度、pH、含水量、木质纤维素相对含量、纤维素相关酶活及细菌、真菌群落结构的影响。结果表明,与对照组相比,接菌组升温较快,在堆肥第1天就达到了50 ℃,达到高温期后含水量下降较快。堆肥结束时,接菌组的纤维素和半纤维素相对含量分别下降了8.50%和16.86%,分别高于对照组的1.50%和13.53%。酶活分析表明,接菌后,β-1,4-葡聚糖酶活性明显提高,木聚糖酶活性出现3个峰值,其中最大峰值为7.90 U/g,是对照组的最大峰值的2.62倍。锰过氧化物酶的活性也有明显提高。接种嗜热侧孢霉在一定程度上也影响了堆肥的细菌及真菌群落结构变化。由此可见,在堆肥中接种嗜热侧孢霉可以加快堆肥升温,促进有机质分解和转化。
关键词 堆肥;嗜热侧孢霉;纤维素酶活;微生物群落
中图分类号 S141.4文献标识码 A文章编号 0517-6611(2021)02-0063-05
doi:10.3969/j.issn.0517-6611.2021.02.019
开放科学(资源服务)标识码(OSID):
Effects of Inoculating Thermophilic sporotrichum on Lignocellulose Degradation in Composting
LUO Xiaosha1,WANG Mingming1,2,SONG Qi1 et al
(1. BGI Institute of Applied Agriculture, BGIshenzhen, Shenzhen,Guangdong 518000;2.BGI Sanshengyuan Co. Ltd., BGIShenzhen, Shenzhen,Guangdong 518000)
Abstract Using pig manure and sawdust as compost test materials, the effects of inoculation hermophilic sporotrichum on compost temperature, pH, water content, relative lignocellulose content, celluloserelated enzyme activity, and bacterial and fungal community structure were studied.The results showed that compared with the control group, the temperature of the inoculated group was faster, reaching 50°C on the first day of composting, and the water content decreased faster after reaching the high temperature period.At the end of composting, the relative contents of cellulose and hemicellulose in the inoculated group decreased by 8.50% and 16.86%, respectively, which were higher than 150% and 13.53% in the control group.The enzyme activity analysis showed that after the inoculation, the β1,4glucanase activity was significantly increased, and there were 3 peaks in the xylanase activity, of which the maximum peak was 7.90 U/g, which was 2.62 of the maximum peak of the control group. The activity of manganese peroxidase was also significantly improved.The inoculation Thermophilic sporotrichum also affected the changes in the bacterial and fungal community structure of the compost to a certain extent.It can be seen that the inoculation Thermophilic sporotrichum in the compost can speed up the temperature of the compost and promote the decomposition and transformation of organic matter.
Key words Compost;Thermophilic sporotrichum;Cellulase activity;Microbial community
近年來,规模化养殖发展迅速,畜禽粪便产生量突增,2015年我国畜禽粪便产生量已达到60亿t[1]。畜禽粪便中含有未消化的淀粉、蛋白质等大分子营养物质,同时还有丰富的有机质、磷、氮和钾元素等,未经处理直接排放到环境中,不仅会造成养分的流失,还会对水源、大气和土壤环境造成严重的污染。现在畜禽粪便的主要处理方式有填埋法、焚烧法和堆肥法[2-3]。堆肥作为一种有效的处理有机废弃物的方法,可以利用微生物将有机物质快速降解成为稳定的有机营养物质或者腐殖质,实现废弃物资源的再利用[4]。
传统的堆肥发酵存在着发酵周期长、升温慢、腐熟不彻底等问题,这些问题与木质纤维素的降解紧密相关,因此如何加快堆肥进程中木质纤维素的降解一直是领域内研究热点[5-6]。有研究报道,加入功能微生物菌剂可以调节微生物群落结构,提高微生物活性,加速堆肥腐熟进程[7-8]。刘佳等[9]研究发现在牛粪堆肥中接种纤维素降解菌,加快了堆肥中的微生物增殖,缩短堆肥进程。尹静等[10]研究筛选了一株粉红粘帚霉,应用于堆肥中可促进堆肥腐熟,提高堆肥产品腐植酸含量。Wei等[8]在小麦、玉米和大豆堆肥中接种嗜热放线菌,结果表明放线菌的接种不仅改变了放线菌和细菌群落的结构,而且加速了纤维素、半纤维素和木质素的降解,并增加了堆肥(特别是小麦)中纤维素、半纤维素和木质素的关键酶活性。尽管这些研究取得了一定的促进堆肥进程的效果,但是更有效的功能性微生物产品仍需要进一步探索。
有文献报道,嗜热侧孢霉(Thermophilic sporotrichum)是一种分解纤维素的嗜热丝状真菌[11]。由于嗜热侧孢霉代谢作用快,纤维素降解率较高,同时较高的生长温度可以有效地抑制其他微生物的生长,在发酵生产上占有一定的优势,因此嗜热侧孢霉日益受到研究者的重视[12]。但是目前大部分研究都集中在嗜热侧孢霉的生物学特性和液体发酵上,对其在堆肥中的应用研究较少。
该试验以猪粪和木屑为堆肥原料,通过探究加入嗜热侧孢霉对堆肥中温度、含水率变化、木质纤维素的降解特性及真菌、细菌群落结构的影响,以期发现新的对缩短堆肥发酵周期、提高木质纤维素降解率有显著作用的外源堆肥菌剂,也为进一步研究嗜热真菌在堆肥木质纤维素降解机制中起到的重要作用奠定基础。
1 材料与方法
1.1 试验材料
所用菌种为嗜热侧孢霉D1,自前期羊粪堆肥样品中筛选出。堆肥原料为新鲜猪粪,选用杨木木屑作为调理剂,购自网上,猪粪取自广东惠州猪场。堆肥原料性质见表1。
1.2 堆肥设置
堆肥试验在华大农业大鹏试验基地进行,实行人工翻堆。共设置2个堆体,每个堆体高约1.2 m,直径约1.5 m。将猪粪与木屑按体积比3∶2混合,接菌组堆体接种1%的嗜热侧孢霉D1,搅拌均匀,将不接种的堆体作为空白对照组。堆体温度上升到50 ℃之后开始翻堆,高温期每2 d翻堆一次,温度下降到35 ℃之后每5 d翻一次,每天测定堆体上部(40 cm)、中部(70 cm)、下部(100 cm)的温度和室温。堆肥周期为50 d。
1.3 样品采集与指标检测
在堆肥的0、2、6、8、10、15、20、25、30、35、40和50 d取样,在上、中、下层随机取样,将取得的样品均匀混合,四分法保留300 g,密封置-20 ℃保存,以备分析测定待用。将样品风干粉碎后进行含水量、pH、碳氮比、全氮等指标的测定。测定方法根据中华人民共和国有机肥料农业行业标准NY 525—2012进行。纤维素、半纤维素和木质素相对含量的测定采用范式洗涤法。
1.3.1 堆肥基因组DNA的提取。
使用试剂盒Fast DNATM Spin Kit for soil提取堆肥样品DNA。
1.3.2 纤维素酶活的检测。
取0、2、4、6、8、10、15、20、25、30 d的样品进行酶活测定:纤维素酶测定采用3,5-二硝基水杨酸法;锰过氧化物酶测定采用Mn2+法;纤维二糖酶测定采用S-C1催化法;木聚糖酶测定采用DNS法[13]。
1.3.3 Illumina Miseq高通量测序。
提取微生物总DNA(浓度>10 ng/μL,总量>500 ng,OD260/280=1.8~2.0),进行目标片段PCR扩增:选取338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)作为细菌16S rRNA 引物;选取1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和2043R(5′-GCTGCGTTCTTCATCGATGC-3′)作为真菌ITS引物。PCR产物送往深圳华大基因公司测序平台进行上机测序和测序结果分析。
2 结果与分析
2.1 堆肥过程中温度的变化
在堆肥过程中,温度是一个十分重要的参数,能反映出微生物的活跃程度,故温度的變化与有机物的降解密切相关[14]。从图1可以看出,2组堆肥的温度变化均呈现了先升高后降低最后趋于稳定的变化趋势,与许多文献中报道的一致[15-16]。此次试验中,接菌组堆肥温度超过50 ℃的时间达30 d,对照组的也达到了29 d,长期保持堆体高温可以充分杀死堆肥中的病原微生物和虫卵等,从而达到粪便无害化标准[17]。
在堆肥初期,堆体自带的微生物通过分解有机物,为自身的大量增殖提供营养物质,这一过程会产生大量热量,从而导致温度迅速上升[18]。与对照组相比,接菌组初期升温较快,在堆肥第1天,温度就达到了51 ℃,对照组第1天温度为48 ℃,接菌组高温期平均温度高于对照组,且最高温度达74 ℃,比对照组最高温度(69 ℃)高出5 ℃,可能是由于嗜热侧孢霉可以在高温下生存,并且分解了堆肥原料种的木质纤维素,产生一定热量,从而提高了堆肥的温度。2组高温期分别维持了30和29 d,随着有机质的大量消耗,微生物代谢活动减慢,热量减少,2组温度在第33天迅速下降至43 ℃,然后缓慢下降至室温。
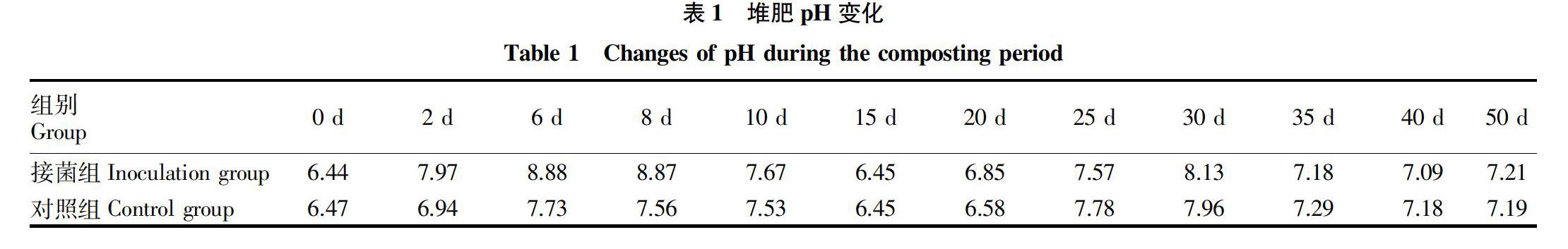
2.2 堆肥过程中含水量和pH的变化
由表1可知,堆肥过程中pH呈现一个先升高后缓慢降低的趋势,接菌组和对照组开始时(0 d)的pH分别为6.44和6.47,结束时(50 d)的pH分别为7.21和7.19,接菌组pH最高峰出现在第6天,为8.88,而对照组pH最高峰出现在第30天,为7.96。接菌组pH在前10 d明显高于对照组,这与温度趋势一致。发酵前期接菌组有机物分解较快,富氮有机物分解出氨,导致pH明显升高。
从图2可以看出,在整个堆肥过程中,2组堆体的含水率皆呈下降趋势,接菌组和对照组的起始含水率分别为69.6%和67.7%,试验结束时,接菌组和对照组的含水率分别为375%和38.0%,两者没有明显差异,高温期接菌组含水率低于对照组,可能是由于堆体温度较高,加速了水分丧失。
2.3 堆肥过程中木质纤维素含量的变化
木质纤维素物质的降解是堆肥过程中的关键环节。由图3可知,2组堆肥中纤维素和半纤维素的相对含量皆有所降低,在接菌组中,堆肥结束时的纤维素相对含量比堆肥开始时的下降了8.5%,高于对照组的1.5%;半纤维素的相对含量比堆肥开始时的下降了16.9%,高于对照组的13.5%,说明接种嗜热侧孢霉更利于纤维素的降解。而木质素由于其高度复杂和相对随机排列的分子结构,相对于纤维素和半纤维素更难降解[19-20]。由图3可知,2组堆肥中的木质素相对含量皆不降反升,可能是由于木质素的降解率低于其他物质,堆肥总体质量降低,故木质素的相对含量增加。王伟东等[21]的试验也有证明木质素在堆肥中几乎不发生降解,加入复合菌系也未见明显影响。
2.4 堆肥过程中酶活的变化
在堆肥中,木质纤维素物质的降解都是在微生物及各种酶的作用下进行的[22-23]。β-1,4-葡聚糖酶(又称纤维二糖水解酶)是一种重要的纤维素降解酶,主要作用于纤维素线状分子末端,水解β-葡萄糖苷键,切下一个纤维二糖分子之后,纤维二糖分子被β-葡萄糖苷酶水解成葡萄糖分子[24],故β-1,4-葡聚糖酶酶活变化与纤维素的降解密切相关[25]。从堆肥过程中β-1,4-葡聚糖酶酶活的变化趋势(图4a)可以看出,2组堆肥的β-1,4-葡聚糖酶的酶活变化趋势基本一致,皆出现3次高峰。2组最大峰值皆出现在第25天,其中接菌组的最大峰值为252.18 U/g,高于对照组的最大峰值(236.55 U/g)。接菌组的β-1,4-葡聚糖酶活性在堆肥全程均明显高于对照组,峰值皆出现在堆肥高温期,说明嗜热侧孢霉对β-1,4-葡聚糖酶酶活具有明显的促进作用,且有较强的耐高温能力,这对于提高纤维素的降解率十分重要。
与纤维素一样,半纤维素的降解也需要在相关酶的作用下完成。木聚糖酶是分解半纤维素的酶中一类主要的酶系,包括多种木聚糖内切酶和外切酶,能催化水解木聚糖,分解原料细胞壁以及β-葡聚糖,从而促进营养物质的吸收利用和有效物质的释放[26]。从图4b可以看出,接菌组的木聚糖酶酶活在堆肥过程中出现了3个峰值,分别出现在第10、20、30天,其中最大峰值出现在第30天,为7.90 U/g,此时堆肥温度为52 ℃;对照组的酶活峰值出现在第2天,为3.01 U/g,此时对照组堆肥的温度为49 ℃,表明50 ℃左右的温度可能是木聚糖酶反应的最适温度,这与冯焱等[27]的研究结果大致相同,同时也说明接种嗜热侧孢霉对木聚糖酶酶活具有明显的促进作用,有助于堆肥中半纤维素类物质的降解。
木质素结构复杂,在自然条件下很难分解或者基本不分解[28],在堆肥中降解率明显低于纤维素和半纤维素[29]。在分解木质素的酶系中,锰过氧化物酶、木质素过氧化物酶和漆酶被认为是最为重要的3类酶。其中锰过氧化物酶能氧化木质素中约占10%的酚结构,催化氧化Mn2+生成Mn3+,Mn3+能够穿透木材,氧化酚型有机物[30],在木质素降解中起重要作用。从图4c可以看出,在堆肥刚开始的前15 d,锰过氧化物酶酶活较低,对照组样品中检测不到,而接菌组在第6天和第10天能检测到的锰过氧化物酶酶活分别为0.009和0016 U/g。从第15天开始,2组的锰过氧化物酶酶活均有一定上升,出现2个波峰。2组酶活最大值皆出现在堆肥第30天,接菌组的最大值达到0.359 U/g,是对照组最大值(0.136 U/g)的2.64倍。表明接种嗜热侧孢霉可以提高锰过氧化物酶活性,对加速木质素类物质的分解有一定的促进作用。
2.5 堆肥过程中微生物动态变化
从图5可以看出,在门水平下,2组堆肥样品中相对丰度超过1%的细菌群落结构相似,主要细菌菌群包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bcateroidetes)、芽孢杆菌门(Gemmalimonadetes)、放线菌门(Actinobacteria)、綠弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、装甲菌门(Armatimonadetes)、栖热菌门(Thermi)、蓝藻门(Cyanobacteres)、软壁菌门(Tenericutes)和互养菌门(Synergistetes)。其中变形菌门、厚壁菌门、拟杆菌门、芽孢杆菌门、放线菌门和绿弯菌门是主要的优势菌群。这与王秀红等[31]的研究结果大致相同。
厚壁菌门是一类重要的水解酸化细菌,可以分泌胞外酶分解多种大分子有机物[32]。在堆肥初期,厚壁菌门细菌相对丰度较大。堆肥第2天,对照组和接菌组中厚壁菌门的相对丰度分别为70.5%和91.3%,表明堆肥初期的大分子有机物主要在厚壁菌门细菌的作用下迅速降解成为小分子有机物,接菌后促进了厚壁菌门细菌的生长;但是堆肥10 d后,厚壁菌门细菌的相对丰度逐渐减少,可能是因为温度升高导致厚壁菌门细菌大量死亡。放线菌是一类耐高温的细菌,可在高温的环境下利用分解木质纤维素进行大量增殖[33-34]。在此次研究中,堆肥前期虽然也有放线菌出现,但是所占比例并不大,从第10天起,放线菌迅速增殖,并且在堆肥中后期仍保持一定的数量优势;在堆肥第25天,接菌组放线菌门的相对丰度为59.7%,高于对照组,此时分解纤维素的相关酶活性皆出现了最高波峰(图4a)。表明放线菌的增殖促进了纤维素的降解。绿弯菌门细菌也是一类可以降解纤维素类物质的细菌[35]。在此次研究中,绿弯菌门在堆肥中后期才成为优势菌群。接菌组中的绿弯菌门相对丰度略高于对照组。
從图6可以看出,在属水平下,2组的真菌群落结构也有所不同。在发酵前2 d,2组样品中毛孢子菌属、节担菌属和假丝酵母属为优势菌群。到第10天,粪盘菌属(Ascobolus)成为主要优势菌群。Ascobolus是子囊菌纲中盘菌亚纲的一个属。在2组堆肥的整个发酵过程中,Ascobolus始终存在。有报道表明嗜热侧孢霉(Sporotrichum thermophile)归于毁丝菌霉属(Myceliophtora);Myceliophtora具有较高的产木聚糖酶和纤维素酶活性[36]。在该研究中,在堆肥第25天开始,Myceliophtora占比增加,而接菌组的Myceliophtora相对丰度迅速增加至68.3%,说明在此时Myceliophtora大量繁殖是由于接种了嗜热侧孢霉的缘故,也验证了该试验所选用的嗜热侧孢霉在堆肥中适应能力较强,作为接种物添加到堆肥中能加快其在高温期的定殖,对纤维素类物质的降解起到加速的作用。
3 讨论
堆肥是一个微生物参与的复杂的物质转化过程,其中木质纤维素类物质的降解是众多研究者关注的重点和难点。促进木质纤维素降解的途径有很多,但是外源补充功能性微生物是一条更为环保和生态的途径。该研究将一株嗜热侧孢霉接种于猪粪木屑堆肥中,接菌组达到高温的速度快,并且高温期持续时间长,说明接菌后促进了堆肥的快速启动和微生物的代谢作用,产热增多,提高了堆体中有机质的分解效率。同时,高温期延长,嗜热侧孢霉繁殖加快,代谢水平提高,大量纤维素酶类随之产生,纤维素酶和纤维二糖酶的酶活皆出现3次高峰。且与对照组相比,接菌组的纤维素酶和纤维二糖酶的酶活最大峰值出现时间较早,峰值较高。堆肥结束时纤维素的相对含量也低于对照组,说明接种嗜热侧孢霉有利于促进纤维素类物质的降解。在分解半纤维素物质中起主要作用的木聚糖酶酶活在第30天出现最大峰值,而对照组木聚糖酶酶活最大峰值出现在堆肥第2天,且远远低于接菌组。说明接种嗜热侧孢霉对木聚糖酶酶活具有显著促进作用,有助于堆肥中半纤维素类物质的降解。相对于纤维素和半纤维素来说,木质素更难降解,其相对含量在堆肥结束时甚至有所增长,这可能是由于木质素的降解率低于其他物质,堆体总质量降低,故木质素的相对含量增加。此结果与王涵[37]的研究结果相符。但接菌组中木质素相对含量的增长幅度要小于对照组。说明接菌处理对木质素的降解也有一定的积极作用。在门水平下,2组堆肥样品中相对丰度超过1%的细菌群落结构相似。变形菌门、厚壁菌门、拟杆菌门、芽孢杆菌门、放线菌门和绿弯菌门是主要的优势菌群。在属水平下,2组的真菌群落结构有所不同。高温期接菌组的嗜热侧孢霉相对丰度迅速增加,成为最主要的优势菌群,代谢活动加快,而β-1,4-葡聚糖酶活性在此时也明显提高。说明嗜热侧孢霉在一定程度上影响了堆肥的真菌群落结构,加速了纤维素类物质的降解。
4 结论
该研究以猪粪和木屑为堆肥原料,接种嗜热侧孢霉后,促进了堆肥的快速启动,延长了高温期并提高了温度峰值,明显提高了纤维二糖酶和木聚糖酶的活性,促进了堆体纤维素和半纤维素类物质降解,有利于促进堆肥腐熟,提高堆肥品质。说明该菌株在处理高木质纤维素类农业废弃物方面有一定的应用价值。
参考文献
[1] 刘玉莹,范静.我国畜禽养殖环境污染现状、成因分析及其防治对策[J].黑龙江畜牧兽医,2018(8):19-21.
[2] 高孟春,于安,杨丽娟,等.鸡粪/木屑强制通风堆肥的研究[J].环境科学与技术,2010,33(1):11-15.
[3] 王佳宁.猪粪堆肥复合菌剂制备及其效果评价[D].大连:大连理工大学,2017:5-6.
[4] BERNAL M P,ALBURQUERQUE J A,MORAL R.Composting of animal manures and chemical criteria for compost maturity assessment.A review[J].Bioresource technology,2009,100(22):5444-5453.
[5] JURADO M,LPEZ M J,SUREZESTRELLA F,et al.Exploiting composting biodiversity:Study of the persistent and biotechnologically relevant microorganisms from lignocellulosebased composting[J].Bioresource technology,2014,162:283-293.
[6] ZENG G M,YU M,CHEN Y N,et al.Effects of inoculation with Phanerochaete chrysosporium at various time points on enzyme activities during agricultural waste composting[J].Bioresource technology,2010,101(1):222-227.
[7] LIU Y W,FENG Y,CHENG D M,et al.Dynamics of bacterial composition and the fate of antibiotic resistance genes and mobile genetic elements during the cocomposting with gentamicin fermentation residue and lovastatin fermentation residue[J].Bioresource technology,2018,261:249-256.
[8] WEI Y Q,WU D,WEI D,et al.Improved lignocellulosedegrading performance during straw composting from diverse sources with actinomycetes inoculation by regulating the key enzyme activities[J].Bioresource technology,2019,271:66-74.
[9] 劉佳,李婉,许修宏,等.接种纤维素降解菌对牛粪堆肥微生物群落的影响[J].环境科学,2011,32(10):3073-3081.
[10] 尹静,刘悦秋,于峰,等.一株木质素降解菌的筛选鉴定及其在堆肥中的应用[J].中国土壤与肥料,2019(3):179-185.
[11] 许燕,陈如凯,张木清.嗜热侧孢霉生物学特性及其液体发酵研究[J].福建农林大学学报(自然科学版),2008,37(1):99-104.
[12] MAHESHWARI R,BHARADWAJ G,BHAT M K.Thermophilic fungi:Their physiology and enzymes[J].Microbiology and molecular biology reviews,2000,64(3):461-488.
[13] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:43-277.
[14] CZEKAA W,MALIN'SKA K,CCERES R,et al.Cocomposting of poultry manure mixtures amended with biocharThe effect of biochar on temperature and CCO2 emission[J].Bioresource technology,2016,200:921-927.
[15] JUSOH M L C,MANAF L A,LATIFF P A.Composting of rice straw with effective microorganisms(EM)and its influence on compost quality[J].Iranian journal of environmental health science & engineering,2013,10(1):17-25.
[16] 张玉凤,田慎重,边文范,等.有机物料对牛粪好氧堆肥过程的影响[J].山东农业科学,2019,51(5):76-82.
[17] 王伟东.木质纤维素快速分解菌复合系及有机肥微好氧新工艺[D].北京:中国农业大学,2005:69-70.
[18] TEUTSCHEROVA N,VAZQUEZ E,SANTANA D,et al.Influence of pruning waste compost maturity and biochar on carbon dynamics in acid soil:Incubation study[J].European journal of soil biology,2017,78:66-74.
[19] 路瑶,魏贤勇,宗志敏,等.木质素的结构研究与应用[J].化学进展,2013,25(5):838-858.
[20] 黄映芳,蔡明亮,吴敏雅.造纸黑液中木素降解的研究现状与进展[J].纸和造纸,2018,37(1):12-17.
[21] 王伟东,王小芬,朴哲,等.堆肥化过程中微生物群落的动态[J].环境科学,2007,28(11):2591-2597.
[22] PREZ J,MUOZDORADO J,DE LA RUBIA T,et al.Biodegradation and biological treatments of cellulose,hemicellulose and lignin:An overview[J].International microbiology,2002,5(2):53-63.
[23] SNCHEZ C.Lignocellulosic residues:Biodegradation and bioconversion by fungi[J].Biotechnology advances,2009,27(2):185-194.
[24] 刘洁丽,王靖.生物产纤维素酶研究进展[J].化学与生物工程,2008,25(12):9-12.
[25] 邓辉,王成,吕豪豪,等.堆肥过程放线菌演替及其木质纤维素降解研究进展[J].应用与环境生物学报,2013,19(4):581-586.
[26] 单志琼,周峻岗,周宇飞,等.产碱性木聚糖酶菌株的筛选及酶学性质[J].遗传,2012,34(3):356-365.
[27] 冯焱,白永胜,黄增辉.木聚糖酶的热稳定性以及最适pH值、温度的研究[J].饲料工业,2007,28(18):17-19.
[28]
IIYAMA K,STONE B A,MACAULEY B J.Compositional changes in compost during composting and growth of Agaricus bisporus[J].Applied and environmental microbiology,1994,60(5):1538-1546.
[29] JOURAIPHY A,AMIR S,EL GHAROUS M,et al.Chemical and spectroscopic analysis of organic matter transformation during composting of sewage sludge and green plant waste[J].International biodeterioration & biodegradation,2005,56(2):101-108.
[30] AMBERTBALAY K,DOUGHERTY M,TIEN M.Reactivity of manganese peroxidase:Sitedirected mutagenesis of residues in proximity to the porphyrin ring[J].Archives of biochemistry and biophysics,2000,382(1):89-94.
[31] 王秀红,李欣欣,史向远,等.好氧堆肥微生物代谢多样性及其细菌群落结构[J].环境科学研究,2018,31(8):1457-1463.
[32] STPIERRE B,WRIGHT A D G.Comparative metagenomic analysis of bacterial populations in three fullscale mesophilic anaerobic manure digesters[J].Applied microbiology and biotechnology,2014,98(6):2709-2717.
[33] 席北斗,刘鸿亮,白庆中,等.堆肥中纤维素和木质素的生物降解研究现状[J].环境污染治理技术与设备,2002,3(3):19-23.
[34] STEGER K,SJGRENM,JARVIS ,et al.Development of compost maturity and Actinobacteria populations during fullscale composting of organic household waste[J].Journal of applied microbiology,2007,103(2):487-498.
[35] RIVIRE D,DESVIGNES V,PELLETIER E,et al.Towards the definition of a core of microorganisms involved in anaerobic digestion of sludge[J].The ISME Journal,2009,3(6):700-714.
[36] BERKA R M,SCHNEIDER P,GOLIGHTLY E J,et al.Characterization of the gene encoding an extracellular laccase of Myceliophthora thermophila and analysis of the recombinant enzyme expressed in Aspergillus oryzae[J].Applied & environmental microbiology,1997,63(8):3151-3157.
[37] 王涵.堆肥中β-glucosidase家族微生物群落與纤维素降解的相关性研究[D].哈尔滨:东北农业大学,2016:17-18.

