胰激肽原酶对糖尿病大鼠视网膜病变的保护作用及对Notch1/Hes-1 信号通路的影响
田 勇,董其娟,于江红,韩 超
(1.河南中医药大学人民医院(郑州人民医院)内分泌代谢科,郑州 450003;2.郑州大学第一附属医院临床药学科,郑州 450052)
糖尿病(diabetes mellitus, DM)是全球发病率较高的代谢性疾病,以高血糖为主要特征,常伴随有眼、肾、心血管和神经系统的多种并发症[1]。 糖尿病性视网膜病变(diabeticretinitis, DR)是DM 并发症中较为常见的一种疾病,据统计,DM 患者视网膜病变的发生率为35%,是发达国家劳动人口失明的主要原因[2]。 DR 主要由慢性高血糖环境诱发,故目前治疗大多以控制DM 患者血糖为主,但仍有部分患者治疗效果不佳[3]。 研究证明,DR 的发生发展过程中伴随视网膜神经节细胞(retinal ganglion cells, RGCs)显著减少和凋亡,抑制RGCs 功能受损和丢失可显著减轻DR[4]。 胰激肽原酶又称为血管舒缓素,是存在于人和哺乳动物胰腺中的一种蛋白水解酶,具有扩血管、改善微循环的作用,临床主要用于治疗糖尿病肾病,防止糖尿病微血管病变[5]。近年来,胰激肽原酶在DR 的临床治疗中取得了较好的疗效,可与其他药物联合使用改善DR 患者视网膜血流动力学指标,增加视网膜厚度,提高患者视力[6-7]。 Notch 信号通路是一种在人和动物中高度保守的信号通路,与肿瘤、心血管和神经退行性疾病等多种疾病密切相关,Hes 已被证实是该信号通路的关键靶基因[8]。 研究证明,Notch 信号通路在DR 的发生发展中具有重要作用,可通过调节血管功能调控新生血管的重构或退化,是治疗DR 的潜在靶点[9]。 目前,虽已有研究证明胰激肽原酶能够治疗DR,但其具体作用机制尚不清晰。 本研究建立大鼠 DM 模型,观察胰激肽原酶对 DM 大鼠RGCs 的保护作用,并初步探究其作用机制。
1 材料和方法
1.1 实验动物
SPF 级 SD 大鼠 60 只,6 周龄,体重 180~220 g,雌雄各半,购自河南省实验动物中心[SCXK(豫)2017-0001],饲养在河南省实验动物中心实验室独立动物房[SYXK(豫)2016-0002]。 饲养条件:室温(22±2)℃,湿度(50±10)%,每天定时换气,保持12 h ∶12 h 光暗照明,食水不限。 研究方案获郑州人民医院伦理委员会批准(IACUC:ZZRMYY2019005),实验严格遵循实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
注射用胰激肽原酶(常州千红药业,批号:481912052A);链脲佐菌素(streptozocin,STZ,Sigma-Aldrich,批号:V900890-1G);HE 染色试剂盒、中性树胶、TUNEL 细胞凋亡检测试剂盒(北京索莱宝科技有限公司);蛋白定量试剂盒(博士德生物);RevertAidTMfirst Strand cDNA Synthesis Kit(美国Thermo Scientific);引物(日本 TaKaRa);Notch1、Hes1、GAPDH 兔源单克隆抗体,羊抗兔二抗(美国CST 公司);One Touch II 型血糖仪(美国强生公司);DYCZ-24KS 型双板垂直电泳仪(北京六一仪器厂);IX53 显微镜(日本奥林巴斯);G:BOX 多功能凝胶成像系统(Syngene);M ultiskan MK3 酶标仪(Thermo Fisher Scientific);TGL16 MB 高速冷冻离心机(长沙湘智离心机仪器有限公司);7500 型PCR仪(美国Applied Biosystems)。
1.3 实验方法
1.3.1 分组、造模与给药
将60 只SD 大鼠随机分为空白组、模型组和治疗组,每组20 只。 模型组和治疗组大鼠提前禁食12 h,腹腔注射60 mg/kg STZ 溶液,空白组大鼠腹腔注射等量0.1 moL/L 枸橼酸钠溶液。 造模72 h 后,各组大鼠尾静脉取血,检测血糖值≥16.7 mmol/L者即可认为DM 模型建立成功[10]。 经检测,模型组和治疗组造模成功的大鼠均为18 只。 造模成功后第2 天开始给药,治疗组大鼠腹腔注射胰激肽原酶0.8 U 治疗,空白组和模型组腹腔注射0.2 mL 生理盐水,每天1 次,连续2 周。
1.3.2 HE 染色观察RGCs 病理学变化
实验结束后,摘除大鼠左侧眼球,置于4%多聚甲醛中固定48 h,用于HE 染色和TUNEL 检测。 切片固定后蒸馏水清洗,然后置于不同浓度的乙醇中进行梯度脱水,制作组织蜡块,冰上预冷切片,切片厚度为4 μm,二甲苯脱蜡30 min,在不同浓度梯度的乙醇溶液中复水,使用苏木精和伊红染液分别染细胞核和细胞质,脱水、透明后用中性树胶封片,置于显微镜下观察各组大鼠视网膜各层病理变化,随机选取5 个高倍镜视野进行RGCs 计数,取平均值。
1.3.3 TUNEL 法检测RGCs 凋亡情况
切片制备方法同1.3.2。 切片标本常规脱蜡、复水,滴加蛋白酶K 溶液,室温水解15 min 去除组织蛋白,蒸馏水清洗后放置在含2%过氧化氢的PBS中反应5 min,滴加TDT 酶反应液2 滴,置湿盒中37℃孵育1 h,滴加50 μL 过氧化物标记的抗地高辛抗体,湿盒中室温孵育0.5 h,PBS 清洗后滴加DAB溶液,室温孵育3 ~6 min 显色,蒸馏水终止,苏木精染细胞核2 min,脱水、透明后用中性树胶封片,显微镜高倍镜下观察凋亡细胞阳性细胞率。
1.3.4 视网膜氧化应激水平检测
摘除大鼠右侧眼球,解剖镜下小心剥离视网膜组织,按照1 ∶4体积比在组织中加入PBS 冰上制备成匀浆,10000 r/min 离心10 min 取上清,离心半径为 12.5 cm,分装在 EP 管中,-80℃保存。 ①SOD 活性检测:取待测样品20 μL,依次加入SOD 检测缓冲液、WST-8 工作液和反应启动工作液,37℃孵育30 min,450 nm 波长测定吸光度(A)值,计算抑制百分率,抑制百分率=(ΔA空白-ΔA测定)/ΔA空白×100%,按照标准曲线计算待测样品的SOD 酶活力(U/mg)。②MDA 含量检测:取待测样品100 μL,依次加入工作液、蒸馏水和待测样品,置于100℃水浴中孵育60 min,冰浴冷却,9500 r/min 常温离心10 min,吸取200 μL 上清液加入玻璃比色皿中,测定各样品在450 nm、532 nm 和 600 nm 处的吸光度 A 值,计算ΔA450=A450测定-A450空白,ΔA532=A532测定-A532空白,ΔA600=A600测定-A600空白,MDA 含量(nmol/mg)= 5×[12.9×(ΔA532-ΔA600)-2.58×ΔA450]。
1.3.5 qRT-PCR 法检测大鼠视网膜组织Notch1、Hes-1 mRNA 表达
收集大鼠视网膜组织,方法同1.3.4。 将视网膜组织剪碎,加适量 TRIzol 裂解液提取组织总RNA,使用 RevertAidTMfirst Strand cDNA Synthesis Kit 逆转录试剂盒合成cDNA,作为荧光定量模版。引物由日本Takara 公司设计合成,所有样品均以GAPDH 为内参。 反应体系:dNTPs 0.5 μL+5×Buffer 5 μL+Taq 酶 0.3 μL+MgCl21.5 μL+cDNA 模板2 μL +上下游引物分别1 μL,加去离子水至总体积 25 μL。 反应条件为:95℃预变性 5 min,95℃变性 30 s、62℃退火 30 s、72℃延伸 30 s,重复 40 个循环,最后72℃延伸10 min,4℃ 5 min 终止反应,实验重复3 次。 采用2-△△CT的方法计算目的基因mRNA相对表达水平的变化。 引物序列见表1。
1.3.6 Western blot 法检测大鼠视网膜组织Notch1、Hes-1 蛋白表达
收集大鼠视网膜组织,方法同1.3.4。 各组视网膜组织用眼科镊剪碎,加入裂解液提取组织蛋白,BCA 蛋白定量试剂盒测定蛋白浓度,加入loading buffer,在EP 管中混匀后置于沸水中煮沸5 min 使蛋白变性。 配置15%的分离胶和5%的浓缩胶进行SDS-PAGE 电泳,上样后80 V 电泳2 h,60 V转膜2 h,5%脱脂奶粉封闭2 h,随后将条带放入10 mL Notch1(1 ∶1000)、Hes-1(1 ∶1 000)、GAPDH(1 ∶1000)兔源一抗稀释液中,稀释比例分别为,4℃环境下孵育12 h,第2 天用TBST 缓冲液清洗3 次,每次10 min,然后加入羊抗兔二抗(1 ∶2000)中,在37℃环境下孵育2 h,TBST 缓冲液清洗3 次后滴加ECL 发光液,反应1 min 后置于凝胶成像系统显影。免疫印迹实验的内参蛋白为GAPDH,用Image J 软件分析各个蛋白对应的灰度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。

表1 基因引物序列Table 1 Primer sequences of genes
1.4 统计学方法
应用SPSS 25.0 统计软件分析数据,GraphPad Prism 8.0 作图,实验重复3 次,计量资料以平均数±标准差()表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠RGCs 病理学变化
空白组大鼠的视网膜组织各层结构清晰,RGCs排列整齐有序,细胞核清晰;与空白组比较,模型组RGCs 排列紊乱、不规则,细胞核稀疏;与模型组比较,治疗组视网膜组织各层结构清晰,RGCs 细胞核较为清晰且排列整齐。 见图1。 空白组、模型组和治疗组RGCs 层细胞数量分别为(29.54±1.35)、(10.28±1.29)、(20.68±1.52),三组 RGCs 数量差异有统计学意义(F=52.36,P=0.0008);与空白组比较,模型组和治疗组RGCs 层细胞数量均降低(P=0.005,0.039);与模型组比较,治疗组RGCs 层细胞数量增加(P=0.028)。 见图2。
2.2 各组大鼠RGCs 凋亡情况比较
空白组大鼠视网膜RGCs 层偶见TUNEL 阳性细胞,与空白组比较,模型组可见较多的呈深棕色的TUNEL 阳性细胞染色;与模型组比较,治疗组虽有TUNEL 阳性细胞,但数量较少,阳性细胞染色较浅。 见图3。 空白组、模型组和治疗组RGCs 凋亡率分别为(0.55±0.20)、(33.33±0.25)、(16.51±0.23)%,三组间RGCs 凋亡率比较,差异有统计学意义(F=85.21,P=0.0003),进一步两两比较,模型组和治疗组RGCs 凋亡率显著高于空白组(P=0.005,0.008);与模型组比较,治疗组RGCs 凋亡率显著降低(P=0.017)。
2.3 各组大鼠视网膜组织SOD 活力和MDA 含量比较
空白组、模型组和治疗组 SOD 水平分别为(80.33±4.22)、(38.85±3.14)、(75.68±3.95)U/mg,三组间SOD 水平比较,差异有统计学意义(F=98.24,P= 0.000 1);MDA 含量分别为(0.81±0.09)、(3.70±0.12)、(1.52±0.10)nmol/mg,三组间SOD 水平比较,差异有统计学意义(F=69.73,P=0.000 5)。 与空白组比较,模型组大鼠SOD 水平显著降低,而 MDA 含量显著升高(P= 0.021,0.003);与模型组比较,治疗组SOD 活力显著提高,MDA 含量显著降低(P=0.035,0.024)。 见图 4。
2.4 各组大鼠视网膜组织Notch1、Hes1 mRNA 表达水平比较
空白组、模型组和治疗组Notch1 mRNA 相对表达量分别为(0.98±0.09)、(0.25±0.03)、(0.59±0.07),三组间Notch1 mRNA 比较,差异有统计学意义(F=39.21,P=0.002);Hes1 mRNA 相对表达量分别为(1.01±0.08)、(0.20±0.04)、(0.84±0.09),三组间Hes1 mRNA 比较,差异有统计学意义(F=56.32,P=0.000 6)。 与空白组比较,模型组大鼠视网膜组织Notch1、Hes1 mRNA 表达水平显著降低(P=0.005,0.006);与模型组比较,治疗组大鼠视网膜组织Notch1、Hes1 mRNA 表达水平显著升高(P=0.003,0.016)。 见图 5。
2.5 各组大鼠视网膜组织Notch1、Hes1 蛋白表达水平比较
空白组、模型组和治疗组Notch1 蛋白相对表达量分别为(0.99±0.09)、(0.26±0.05)、(0.48±0.06),三组间Notch1 蛋白相对表达量比较,差异有统计学意义(F=34.84,P=0.001);Hes1 蛋白相对表达量分别为(1.05±0.12)、(0.29±0.03)、(0.80±0.07),三组间Hes1 蛋白相对表达量比较,差异有统计学意义(F=29.58,P=0.003)。 与空白组比较,模型组大鼠视网膜组织Notch1、Hes1 蛋白表达水平显著降低(P=0.023,0.031);与模型组比较,治疗组大鼠视网膜组织Notch1、Hes1 蛋白表达水平显著升高(P=0.019,0.026)。 见图6。
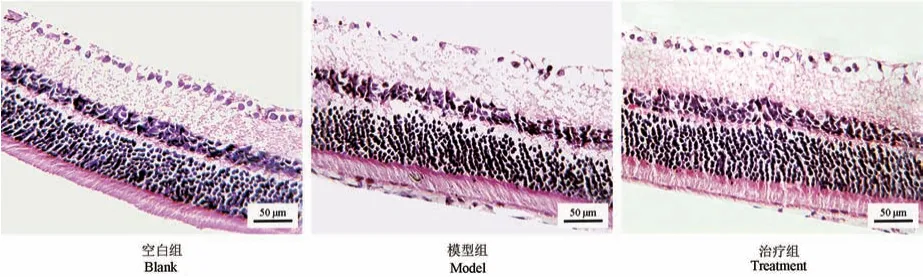
图1 各组大鼠RGCs 病理学变化(HE 染色)Figure 1 Pathological changes of RGCs in each group of rats(HE staining)
3 讨论
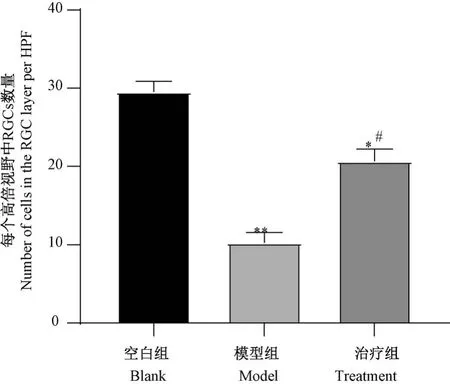
图2 各组大鼠RGCs 数量比较(¯x±s,n=18)Note. Compared with the blank group,*P<0.05, **P<0.01.Compared with the model group, #P<0.05.Figure 2 Comparison of the number of RGCs in each group
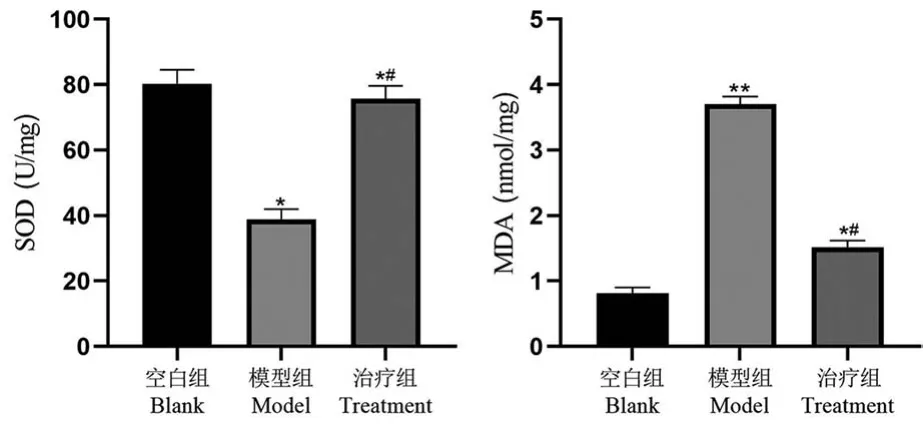
图4 各组大鼠视网膜组织SOD 活力和MDA含量比较(¯x±s,n=18)Note. Compared with the blank group, *P < 0.05, **P < 0.01.Compared with the model group, #P<0.05.Figure 4 Comparison of SOD activity and MDA content in retina tissue of rats in each group

图3 各组大鼠RGCs 凋亡情况比较(TUNEL 染色)Figure 3 Comparison of RGCs apoptosis in rats in each group (TUNEL staining)
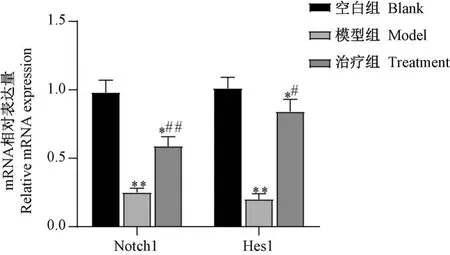
图5 各组大鼠视网膜组织Notch1、Hes1 mRNA表达水平比较(¯x±s,n=18)Note. Compared with the blank group, *P<0.05, **P<0.01.Compared with the model group, #P<0.05, ##P<0.01.Figure 5 Comparison of Notch1 and Hes1 mRNA expression levels in the retina of rats in each group
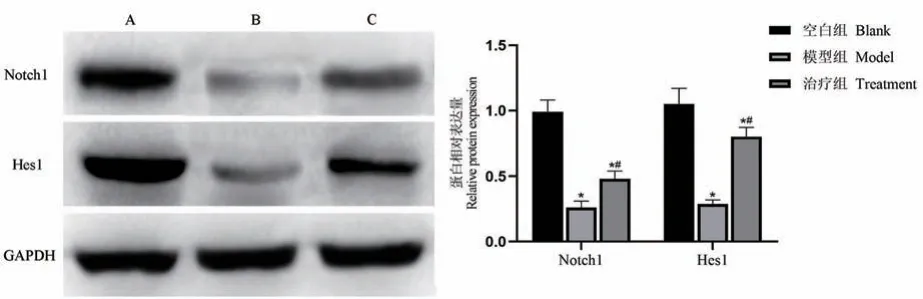
图6 各组大鼠视网膜组织Notch1、Hes1 蛋白表达水平比较(¯x±s,n=18)Note. A, Blank group. B, Model group. C, Treatment group.Compared with the blank group, *P <0.05. Compared with the model group, #P<0.05.Figure 6 Comparison of Notch1 and Hes1 protein expression levels in rat retina
DR 是DM 的常见并发症之一,可导致RGCs 大量凋亡,而RGCs 被损伤可直接影响患者视力,严重者可导致失明[11]。 DR 的发病机制复杂,可能的原因包括代谢紊乱、氧化应激损伤、神经营养因子缺乏等,而RGCs 损伤是多因素、多途径和多阶段共同作用的结果[12]。 目前,DR 的治疗方法包括药物、激光、手术及基因治疗,各种新的疗法和途径均在不断深入探索中[13]。 胰激肽原酶是一种具有扩张血管、改善微循环作用的蛋白水解酶,近年来,被广泛用于糖尿病肾病、周围神经性病变及DM 相关男性勃起功能障碍的治疗[5,14-15]。 Cheng 等[16]研究表明,胰激肽原酶能够预防DM 动物模型的视网膜病变,增加视网膜层厚度并减弱血管渗漏,是治疗DR的一种新的治疗剂,但其作用机制尚不清楚。 在本研究中,我们采用单次腹腔注射STZ 的方法建立大鼠DM 模型,观察胰激肽原酶对大鼠DR 的保护作用,病理切片结果显示,空白组大鼠的视网膜组织各层结构清晰,RGCs 排列整齐有序,几乎没有凋亡细胞,而模型组大鼠的RGCs 排列紊乱、不规则,细胞核稀疏,细胞数量显著减少,且凋亡细胞数量较多,阳性着色较深,与模型组比较,治疗组视网膜RGCs 细胞核清晰,排列整齐,RGCs 数量显著增加,凋亡细胞数量减少,阳性着色相对较浅,初步表明胰激肽原酶对DM 大鼠RGCs 具有保护作用,能够提高RGCs 数量,防止细胞凋亡。氧化应激是Ⅱ型糖尿病发生和发展的重要原因和过程,可导致胰岛β 细胞功能损伤及胰岛素抵抗,另有研究表明,氧化应激反应与DR、青光眼和视神经炎等多种疾病中RGCs 凋亡现象有关,抗氧化应激药物的使用则可有效保护RGCs,降低RGCs 凋亡率,从而控制疾病发展[17-18]。 SOD 是人体重要的自由基清除剂,可阻断氧自由基造成的细胞损害,保护受损细胞,MDA 是机体脂质过氧化反应产物,可使视网膜细胞的流通性和通透性改变,最终可导致视网膜结构损伤,当视网膜缺血缺氧情况下,氧化应激反应显著增加,表现为SOD 活力降低而MDA水平升高[19]。 在本研究中,我们检测了DM 大鼠视网膜组织中SOD 和MDA 含量,结果显示,与空白组比较,模型组大鼠SOD 水平显著降低,而MDA 含量显著升高,与模型组比较,治疗组SOD 活力显著提高,MDA 含量显著降低,表明胰激肽原酶能够抑制DR 氧化应激反应。 Notch 信号通路是一种进化保守的信号转导途径,已有研究证明,Notch 信号通路可调节细胞增殖、凋亡及血管新生,是机体新陈代谢的关键参与者,该信号通路的活化能够减轻氧化应激对机体的损伤[20-21]。 研究表明,Notch 信号转导途径在视网膜血管形成过程中定期表达,也通过调节血管直径保持视网膜血管成熟稳定,而Notch信号通路的表达缺失则使血管动态平衡被破坏,对维持静态内皮细胞的稳定至关重要[22]。 Li 等[23]研究发现,Notch 信号通路能够抑制急性高眼压大鼠RGCs 细胞凋亡,促进受损视神经的再生。 刘文强等[24]认为,激活Notch1/Hes-1 信号通路能够对DM状态下的RGCs 损伤产生神经保护作用。 与上述研究结果一致,本研究发现,模型组大鼠视网膜组织Notch1、Hes1 mRNA 和蛋白表达水平显著低于空白组,与模型组比较,治疗组大鼠视网膜组织Notch1、Hes1 mRNA 和蛋白表达水平显著升高,表明胰激肽原酶能够上调DM 大鼠视网膜组织Notch1/Hes-1 信号通路的表达水平,进而产生抑制RGCs 细胞凋亡和氧化应激损伤的作用。
综上所述,胰激肽原酶能够改善DM 大鼠视网膜病变,抑制RGCs 细胞数量减少和细胞凋亡,减少氧化应激损伤,其作用机制可能与激活Notch1/Hes-1 信号通路的表达有关。

