安罗替尼上调射频消融对肺鳞癌肿瘤组织杀伤作用的实验研究
李仙晓,李瑞生,李晓娟,晋 颖
(1.北京新里程肿瘤医院,肿瘤内科,北京 100161; 2.中国人民解放军空军总医院,肿瘤内科,北京 100142;3.中国人民解放军总医院第五医学中心,临床研究管理中心,北京 100039)
随着环境污染的不断加剧以及人口老龄化的趋势不断进展,肺癌(lung cancer)仍是我国发病率和死亡率最高的恶性肿瘤[1]。 分子靶向药物(molecular targeting agents)是肺癌的主要治疗策略之一,但目前分子靶向药物主要用于肺腺癌(lung adenocarcinoma, LAC)为代表的非小细胞肺癌(nonsmall cell lung cancer, NSCLC)的治疗,而多来源于气管鳞状上皮的肺鳞癌(lung squamous cell carcinoma, LSCC)尚无明确的分子靶向药物[2]。 因此,研究和发现适用于LSCC 的分子靶向药物,不仅有助于拓展LSCC 治疗的策略,同时也能够加深对分子靶向药物的认识。
另一方面,随着疾病进展LSCC 肿瘤组织体积不断增大易于引起支气管狭窄或阻塞性肺炎等,常见的治疗策略是外科手术切除等开放性手术治疗策略[3]。 射频消融治疗(radiofrequency ablation,RFA)是一种介入治疗策略,能够在精确毁损/消融肿瘤组织的同时最大限度的保护肿瘤组织周围的正常组织(即癌旁组织:para-tumortissues)免受损伤[4],这使得RFA 成为LSCC 治疗的理想策略:RFA一方面能够直接消融LSCC 组织以实现抗肿瘤作用,同时也能保护通过直接销毁LSCC 肿瘤组织以维系呼吸道的正常组织结构并直接缓解LSCC 组织占位引起的支气管狭窄或阻塞性肺炎。 已有研究表明,RFA 联合分子靶向药物治疗有助于实现更好地有效抗肿瘤效果的同时,规避各自的不良反应。
分子靶向药物安罗替尼(Anlotinib)已被应用于NSCLC 治疗[5]。 为拓展我们对LSCC 的分子靶向治疗的认识并利用动物模型探索RFA 对LSCC 的抗肿瘤作用,本研究首先检测了LSCC 的动物模型,在此基础上检测了LSCC 对Anlotinib 的敏感性,最终发现Anlotinib 能够上调 RFA 对 LSCC 肿瘤组织的杀伤作用。
1 材料和方法
1.1 实验动物
选 60 只雌性 SPF 级 BALB/c 裸鼠,4 周龄,体重13~14 g。 由斯贝福(北京)生物科技有限公司提供[SCXK(京)2016-0002];饲养于解放军总医院第五医学中心动物实验室[SYXK(军) 2017-0016]。实验动物的使用以及研究方案通过了解放军总医院第五医学中心动物伦理委员会审查(IACUC-2017-019)。 在实验过程中严格遵循3R 原则给予实验动物福利。
1.2 主要试剂与仪器
患者来源LSCC 组织(5 例)来自LSCC 外科手术的切除标本;DMEM 培养基、胎牛血清为美国Thermo 公司产品;分子靶向药物纯品安罗替尼(Anlotinib,产品编号为S8726)购买自美国Selleck公司;RNA 提取试剂盒、反转录试剂盒以及qPCR试剂盒购买自美国ABI 公司;吸入麻醉剂(异氟烷,isoflurane)购自深圳瑞沃德公司;甲状腺消融针(货号UniBlate 700-103587 17G)购自RITA 公司;有机溶剂 二 甲 亚 砜 (DMSO)、 吐 温 80、 聚 乙 二 醇(PEG400)均为国药集团北京公司产品;手术器械和材料均由本实验室保存。 qPCR 仪(美国ABI 公司,ABI-7500 型号。
1.3 实验方法
1.3.1 Anlotinib 药物工作液的配制
首先称取Anlotinib 的药物纯品粉末,再使用有机溶剂二甲亚砜(DMSO)、吐温80 以及聚乙二醇(PEG400)等对药物进行充分溶解。 进一步使用生理盐水进行稀释,最终获得动物实验使用的Anlotinib 溶液(其中DMSO 终浓度不超过1‰、吐温80 终浓度以及PEG400 终浓度不超过2‰)[6]。
1.3.2 qPCR
手术切除获得的30 对成对标本(外科手术切除、气管镜切除的LSCC癌旁非肿瘤标本)LSCC 肿瘤组织、癌旁组织依据ABI 公司提供的说明书提取组织中的RNA 样本(total RNA samples)进行反转录和qPCR 实验,确定组织标本中Anlotinib 的作用靶标及相关信号通路目的基因的表达水平进行检测。其中qPCR 实验目的基因表达水平的定量方法为SYBR Green 染色法(2-△△CT法)[7-8],具体以作为内参(loadingcontrol)的β 肌动蛋白(β-Actin)为标准,确定各目标基因的相对表达水平[9-10]。 结果显示为相对表达水平(目标基因相对于β-Actin 的倍数[folds])绘制的散点图。 qPCR 引物(5’→3’)与文献[11]相同。 对于E-Cadherin 的相对表达水平(相对倍数/relative folds)的计算方法为对照组E-Cadherin表达水平为单位1,Anlotinib 治疗组E-Cadherin 表达水平/对照组 E-Cadherin 表达水平即为 ECadherin 的相对表达水平。
1.3.3 裸鼠成瘤实验
将添加有20% FBS 的DMEM 在超净台中装入灭菌的50 mL 离心管中(每管中约20 mL),再收集手术切除的LSCC 肿瘤组织。 进一步在超净台中以灭菌的手术器械修整肿瘤组织获得组织微块(以精密天平进行称量,使得各个组织微块的重量在2 mg左右)。 裸鼠麻醉后,在裸鼠皮下接种上述获得的组织微块,具体方法为:以异氟烷对裸鼠进行吸入麻醉,再使用眼科镊钝性分离小鼠腹股沟附近皮肤以暴露出腹股沟附近裸鼠下肢内侧的股静脉,使用眼科镊将前一步骤叙述的LSCC 肿瘤组织微块接种至股静脉附近使LSCC 组织贴附在股静脉表面以形成皮下肿瘤组织。 由于肿瘤组织活性良好且接种方式利于肿瘤细胞生长(LSCC 组织贴附在股静脉表面为LSCC 的生长提供了良好的条件),在裸鼠体内都能够形成了皮下肿瘤组织。 本研究中共建立了5 个利用患者来源的LSCC(Patient-derived cell,PDC)建立的裸鼠皮下肿瘤模型,命名为PDC1(PDC No. 1)、PDC2(PDC No. 2)、PDC3(PDC No. 3)、PDC4(PDC No. 4)以及PDC5(PDC No. 5),在此基础上对于Anlotinib 治疗以及RFA 治疗方法:
(1)对于Anlotinib 单独作用实验:在裸鼠接种LSCC 组织微块后待小鼠接种LSCC 组织时的伤口愈合良好后,对裸鼠进行口服灌胃给药,给予动物Anlotinib(隔日灌胃一次),此时Anlotinib 的剂量分别为:3、2、1、0.5、0.2 mg/kg。 待治疗 10 次左右(约3 周)后,收集肿瘤组织,依据肿瘤重量、肿瘤体积计算Anlotinib 作用于LSCC 的抑制率,同时收集肿瘤组织以qPCR 检测Anlotinib 对肿瘤组织中EMT 相关因子表达的影响;选取Anlotinib 自身无明显细胞毒性而对LSCC 细胞EMT 有明确抑制活性的作用剂量进行下一步实验;
(2)对于RFA 联合Anlotinib 共同作用实验共分四组,每组6 只动物:在将LSCC 肿瘤组织接种裸鼠皮下后,经过2 ~3 周左右的生长(这一期间对动物进行定期观察[每3 日使用游标卡尺测量肿瘤组织体积一次,依据长轴×短轴×短轴/2 计算肿瘤体积])后,LSCC 组织微块能够在裸鼠皮下部位形成肿瘤组织(此时体积约为1500 ~2000 mm3),此时选取24 只动物随机分为4 组,①对于未治疗组,LSCC在裸鼠体内进行正常生长,不对动物进行任何干预;② Anlotinib 单纯治疗组:对裸鼠进行口服灌胃给药,给予动物 Anlotinib(隔日灌胃一次),此时Anlotinib 的剂量分别为0.5 mg/kg(Anlotinib 自身无明显细胞毒性而对LSCC 细胞EMT 有明确抑制活性的作用剂量);③ 对于RFA 单独治疗:依据Xie等[4]描述的方法,使用甲状腺消融针对皮下肿瘤组织进行RFA 处理(具体RFA 条件为55-60℃,消融2 min);④ 对于RFA 联合Anlotinib 治疗:对皮下肿瘤组织进行RFA 治疗后 [(2)部分步骤 ③方法],再通过口服灌胃给予Anlotinib 治疗[(2)部分步骤②方法];依据系列时间点的肿瘤体积绘制肿瘤生长曲线,确定 RFA、Anlotinib、RFA + Anlotinib 对LSCC 在裸鼠皮下生长的抑制作用,依据肿瘤生长曲线的曲线下面积(area under the proliferationcurves)确定不同组的整体抑制活性。 裸鼠皮下成瘤实验中,肿瘤组织的体积(Volumes)计算公式为:肿瘤长轴长度×肿瘤短轴长度×肿瘤短轴长度/2[9]。药物作用的抑制率为:(对照组肿瘤生长曲线的曲线下面积-治疗组肿瘤生长曲线的曲线下面积)/对照组肿瘤生长曲线的曲线下面积×100%。
1.4 统计学方法
2 结果
2.1 Anlotinib 对LSCC 的抗肿瘤活性检测
qPCR 结果显示了在LSCC 患者来源肿瘤组织中(PDTs)Anlotinib 作用靶标(包括系列受VEGFR、PDGFR 等体酪氨酸蛋白激酶;MAPK、PI3K/AKT 通路主要信号分子)的表达水平(见图1),上述因子在30 例LSCC PDTs 中均有表达,且表达量在LSCC 组织中均显著高于在癌旁组织(成对标本中的癌旁非肿瘤组织标本)。 这表明Anlotinib 可能对LSCC 具有杀伤作用。 进一步结果显示(见图2),Anlotinib能有剂量依赖抑制LSCC 在裸鼠皮下的成瘤作用。进一步检测了Anlotinib 对LSCC 在裸鼠皮下形成的肿瘤组织中,EMT 相关因子表达的影响。 结果如图2、表 1 和表 2 所示,0.5 mg/kg 剂量的 Anlotinib 其自身对LSCC 的细胞毒性较弱,但是能够在LSCC 肿瘤组织中上调细胞上皮特征标志物E-Cadhrin 的表达、下调间质特征标志物N-Cadherin、Vimentin 的表达水平。 因此,选取0.5 mg/kg 剂量的 Anlotinib 进行进一步实验。
2.2 Anlotinib 能够上调 RFA 对 LSCC 肿瘤组织的杀伤作用

图1 分子靶向药物作用靶标在肺鳞癌/癌旁组织标本中的表达检测Figure 1 Endogenous expression of RTKs and protein kinases in lung squamous cell carcinoma or the non-tumor tissues
结果如图3 所示,将LSCC 肿瘤组织微块接种裸鼠皮下形成肿瘤组织;在此基础上 RFA 处理LSCC 肿瘤组织后,LSCC 皮下肿瘤的生长速度明显减缓,0.5 mg/kg 剂量的Anlotinib 其自身对LSCC 的细胞毒性较弱,但能够显著增强RFA 对LSCC 在裸鼠皮下生长的抑制作用,此时肿瘤组织的生长不仅出现了生长抑制,RFA 联合安罗替尼治疗组肿瘤组织逐渐萎缩。 结果显示为各组LSCC 形成皮下肿瘤组织的照片(图3A),各组肿瘤组织的生长曲线(图3B),上皮间质转化(EMT)相关因子在肿瘤组织中的表达检测(E-Cadherin C、N-Cadherin D 以及Vimentin E),以及依据生长曲线的曲线下面积计算所得的抑制率(表3)。 这表明,Anlotinib 联合RFA治疗能够增加LSCC 对RFA 的敏感性。
3 讨论
目前,肺癌相关分子靶向药物以及研究工作的热点仍然主要是作用于 EGFR 等以易瑞沙(Gefitinib,吉非替尼)为代表的小分子蛋白激酶抑制剂,而对LSCC 的相关研究不足[2]。 尽管现有分子靶向药物的广泛应用能够显著延长患者生存期、改善患者的生存质量但是随着治疗的进行,患者易于出现药物耐受[10]。 为克服这些问题,以Anlotinib为代表的新型分子靶向药物被应用于NSCLC 治疗[3]。 与 Gefitinib 不 同, Anlotinib 是 作 用 于VEGFR、PDGFR 等的多靶标蛋白激酶抑制剂[3]。全球多中心临床试验的结果认为Anlotinib 能够有效发挥对NSCLC 的抗肿瘤作用并为患者带来新的希望,但是目前LSCC 的分子靶向治疗严重滞后,也未能因此足够重视。 为解决这一问题,本研究首先发现 LSCC 组织中 VEGFR、PDGFR 等 Anlotinib 的作用靶标有明确表达这一重要研究线索,在此基础上建立了LSCC 相关肿瘤模型并探索研究了Anlotinib对LSCC 的抗肿瘤活性。 结果表明,Anlotinib 对LSCC 在裸鼠皮下生长也有明确的抗肿瘤活性,Anlotinib 有望作为LSCC 的分子靶向药物,这不仅有重要的研究意义同时也有望为患者带来新的福音。
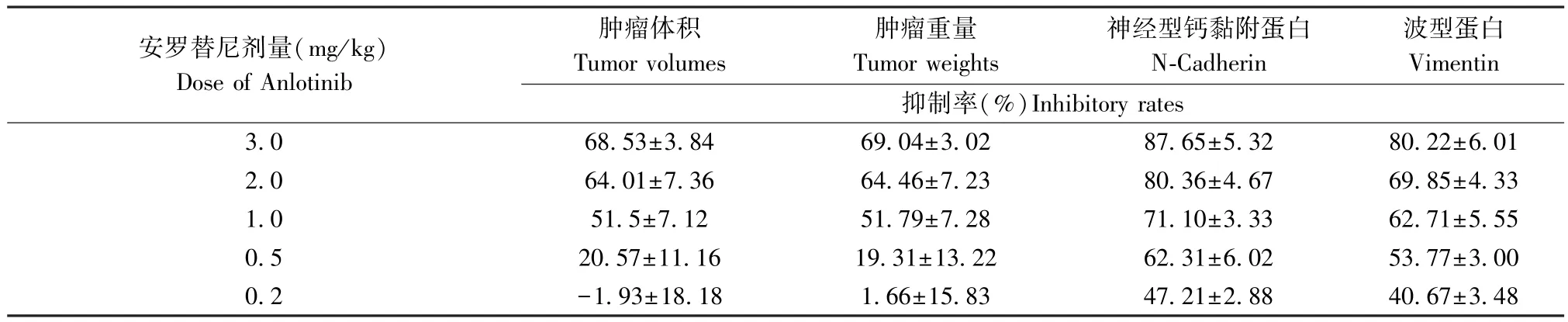
表1 安罗替尼对肺鳞癌组织皮下成瘤的抑制活性Table 1 Inhibitory effect of Anlotinib on subcutaneous tumorigenesis of lung squamous cell carcinoma

表2 安罗替尼上调肺鳞癌组织中E-Cadherin 表达水平Table 2 Treatment of Anlotinib enhanced the expression level of E-Cadherin in subcutaneous tumor tissues formed by lung squamous cell carcinoma cells
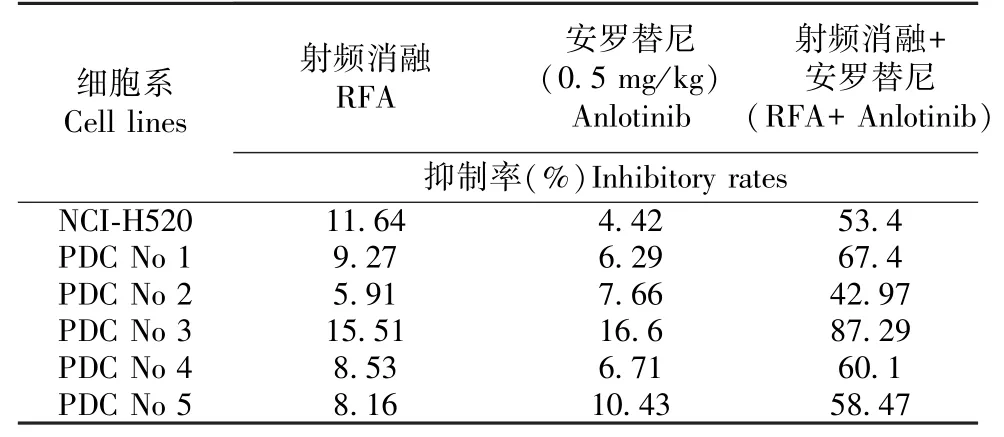
表 3 RFA、Anlotinib、RFA 联合 Anlotinib 对 LSCC肿瘤组织的抑制率Table 3 Inhibition rates of RFA, Anlotinib, RFA +Anlotinib on LSCC cells’ subcutaneous growth

图2 安罗替尼对肺鳞癌组织皮下成瘤的抑制活性Note. A, Pictures of tumor tissues. B, Tumor volumes. C, Tumor weights.Figure 2 The inhibitory effect of Anlotinib on subcutaneous tumorigenesis of lung squamous cell carcinoma

图3 安罗替尼能够上调射频消融RFA 对肺鳞癌裸鼠皮下肿瘤组织Note. A, Pictures of tumor tissues. B, Tumor growth curve. C, Expression level of E-cadherin. D, Expression level of N-Cadherin. E,Expression level of Vimentin.Figure 3 Anlotinib can upregulate RFA of lung squamous cell carcinoma in nude mice
进一步,LSCC 的治疗主要是手术切除治疗,但是胸腔的开放式手术会给患者带来很大损伤[12]。以射频消融(RFA)为代表的新兴的介入治疗策略能够实现对脏器肿瘤病灶的微创与精准治疗,目前主要应用在进展期HCC 相关治疗[4],而在LSCC 中的应用尚无报道。气管镜等相关诊疗技术的进展使得肺部介入治疗策略能够得以应用并实现介入的全肺抵达[13],因此气管镜与 RFA 联合策略在LSCC 治疗有良好的应用前景:在有效和直接消融堵塞呼吸道、气管、支气管的LSCC 组织并尽可能减少对呼吸道组织的损伤作用。 但另一方面,RFA 治疗也存在诸多挑战:(1)RFA 治疗的能量和治疗温度不能无限增高,可能会存在不完全消融的情况;(2)RFA 一方面能够发挥对LSCC 组织的杀伤作用,同时也有可能诱导LSCC 组织的 EMT 作用,引起LSCC 的复发或转移作用。 本研究选取了较为温和的RFA 条件(50℃~60℃,2 min),并辅以 Anlotinib治疗。 结果显示,Anlotinib 能够发挥对RFA 的增敏作用,显著加强RFA 对LSCC 在裸鼠皮下的增殖租用。 同时,Anlotinib 能够抑制 RFA 诱导的 LSCC 组织的EMT 作用。 因此,本研究不仅揭示了Anlotinib能够应用于LSCC 治疗,同时也建立了LSCCRFA 的研究模型,为今后的进一步研究奠定了坚实基础。
同时,本研究在技术上也具有重要意义:(1)目前肺癌常用的研究模型:以A549(肺腺癌)、H460(大细胞肺癌) 为代表的细胞系的组织来源以NSCLC 为主,而LSCC 细胞系很少,同时长期使用、体外培养的现有细胞系与患者体内的差异也在近年引起重视[14],因此本研究建立的LSCCPDCs 具有重要意义,为LSCC 相关研究奠定了坚实基础;(2)裸鼠皮下肿瘤模型易于观察与操作,易于进行经皮穿刺的 RFA 处理 LSCC 肿瘤组织;同时 RFA、Anlotinib 治疗的效果也能够依据肿瘤体积变化、肿瘤重量定量分析;(3)与气管、支气管等原发部位的肿瘤体积相当、可比性强,同时本研究的结果显示,RFA 联合Anlotinib 处理LSCC 肿瘤组织后肿瘤组织逐渐生长停滞和萎缩,这也为进一步奠定了坚实基础。
致谢:感谢中国人民解放军总医院第五医学中心介入科谢辉博士、副主任医师在裸鼠RFA 实验中给予的指导和帮助!

