瘦素受体敲除引起大鼠脑组织小胶质细胞活化
丁登峰,高 翔,张 旭,刘 旭,孙彩显,张 丽,张连峰,*
(1.北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,国家卫生健康委员会人类疾病比较医学重点实验室, 北京 100021. 2.北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,北京市人类重大疾病实验动物模型工程技术研究中心, 北京 100021)
瘦素受体(leptin receptor, LEPR) 是瘦素(leptin) 的功能性受体,Leptin/LEPR 轴能激活JAK2-STAT3、PI3K 和 AMPK 等信号转导通路,从而发挥抑制食欲、促进能量消耗,减少脂肪含量调节体重的功能[1-3]。 LEPR 的突变是啮齿类动物和人类肥胖/糖尿病突变的基础[4]。 LEPR 缺失的db/db小鼠(diabetes mouse),是典型的2 型糖尿病模型,能够反映肥胖、糖耐量进行性恶化、高血压和高脂血症等人类疾病的表型[5-6]。 LEPR 的突变的大鼠(zucker diabetic fatty rats, ZDF)也表现高胰岛素血症、高脂血症和高血压,并表现出糖耐量减低的2 型糖尿病症状[7-8]。 瘦素受体敲除大鼠表现为过度肥胖、多饮、多食、血糖高、对葡萄糖不耐受、高胰岛素血症和血脂异常[9-10]。
Leptin/LEPR 轴不仅与能量代谢有关,Leptin 和LEPR 在被发现脑中具有表达[11]。 那么,Leptin/LEPR 是否参与脑中免疫调节的问题,目前研究很少。 已知无论是在leptin 突变的 ob/ob 和 LEPR 突变的 db/db 小鼠,都有明显的脑损伤和神经炎症[12-13]。 小胶质细胞(microglia)是中枢神经系统的主要免疫细胞,与脑损伤与神经炎症有关[14-15],但目前瘦素受体与小胶质细胞、神经炎症的研究报道的很少,这将是本文的切入点,利用瘦素受体敲除大鼠阐述LEPR 与小胶质细胞之间的联系。
1 材料和方法
1.1 实验动物
LEPR 全身敲除大鼠(LEPR-/-)由中国医学科学院医学实验动物研究所遗传疾病模型工程平台培育,LEPR-/-繁育过程中所需的8 周龄SPF 级SD大鼠由中国医学科学院医学实验动物研究所提供[SCXK(京)2019-0011]。 雌雄各 10 只,体重在200~400 g 之间,按照雌雄比例 1 ∶1进行合笼繁育。 实验所需大鼠均饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2019-0014],饲养间温度(23±2)℃,12/12 h 明暗交替照明,动物自由饮水及采食。 本实验涉及到的所有实验动物程序均通过中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC ZLF18003)的批准,实验过程中遵循了3R 原则。
1.2 主要试剂与仪器
DMEM/F12 培养基、Neurobasal Media 神经元培养基、DPBS 缓冲液和Fetal Bovine Serum 胎牛血清购自于美国 Gibco 公司;FITC-Dextran 购自美国Sigma 公司;Aβ(1-40)购自于美国 AnaSpec 公司;TRIzol 购自于美国赛默飞公司;一抗leptin receptor、PI3K 和 AKT 购自于英国 Abcam 公司;RT-PCR 试剂盒购自于日本TaKaRa 公司;无水乙醇和异丙醇购自于北京化工厂有限责任公司;DNA 提取试剂盒和质粒小提试剂盒购自北京全式金生物技术有限公司;兔二步免疫组化试剂盒和DAB 染色液购自于北京中杉金桥生物技术有限公司;细胞培养板和细胞培养瓶购自于美国康宁公司;实时荧光定量PCR仪购自美国伯乐公司;激光共聚焦显微镜和双光子显微镜购自于德国莱卡公司;离心机和移液器购自于德国艾本德公司;6 孔板、24 孔板细胞爬片和10%福尔马林固定液购自于北京索莱宝科技有限公司;qPCR 引物购自于北京天一辉远生物科技有限公司; 生物安全工作台购自于苏州设备净化设备有限公司。
1.3 实验方法
1.3.1 大鼠原代神经元细胞、星形胶质细胞和小胶质细胞培养
LEPR+/-交配,选取同窝阴性对照(LEPR+/+)和敲除纯和子(LEPR-/-) 1 周龄新生 SD 幼鼠各20只,低温麻醉处死,用高压过的手术器械取出大脑置于含DPBS(Gbico)的圆皿中清洗,去除脑组织上面的脑膜和血块,然后在1 mL 胰酶中剪碎,再加入2 mL 胰酶转移到15 mL 离心管置于温箱中消化8 min,加10 mL 培养基混匀中和胰酶消化,将上清过滤到新的 15 mL 离心管中,1500 r/min,离心5 min,倒掉上清,保留管底沉淀,用1 mL 培养基吹打混匀后转移至75 cm2培养瓶中[16]。 将获得的细胞放在在含5% CO2, 37℃的细胞培养箱里常规培养7~14 d左右。 上述是三种细胞的共同培养步骤,但是培养基和分离方式不同,其中原代星形胶质细胞和小胶质细胞的培养基是含10%胎牛血清,1%非必需氨基酸,1%青霉素/链霉素和1%的谷氨酰胺的DMEM-F12 培养基(Gbico),上层细胞是小胶质细胞,37℃摇床,200 r/min 振荡分离2 h 即可获得,下层贴壁细胞是星形胶质细胞,用胰酶消化即可获得;原代神经元细胞的培养基是含有10% B27,1%非必需氨基酸,0.5%青霉素/链霉素和1%的谷氨酰胺的Neurobasal Media 无血清培养基(Gbico),其他细胞在此环境中无法存活,获得的细胞即为神经元细胞。
1.3.2 小胶质细胞吞噬的免疫荧光观察
在24 孔板中放置多聚赖氨酸包被过的爬片(Acmec),接种原代小胶质细胞,接种密度一般为60%~70%,完全培养基培养24 h, 随后换无血清培养液饥饿培养12 h,随后分别给予吞噬示踪剂FITC-Dextran(Sigma)和 Aβ(1-40)(AnaSpec),分别继续孵育 2 h 和 3 h,暗光处 PBS 洗 3 次,每次 3 min,4%多聚甲醛(碧云天)固定20 min,PBS 洗3次,每次3 min,DAPI(中杉金桥)封片,双光子显微镜(Leica)观察小胶质细胞吞噬。 每组30 个视野,根据小胶质细胞吞噬的荧光强度用Image J 软件计算每个小胶质细胞吞噬能力。
1.3.3 LPS 诱导致死性和脑组织小胶质细胞形态分析
选取8 周龄 LEPR+/+和 LEPR-/-大鼠,分为 4组,每组12 只大鼠,雌雄各6 只,雄性大鼠体重在200~450 g 之间,雌性大鼠体重在 200 ~350 g 之间,各个组分别为LEPR+/+组,LEPR-/-组,LEPR+/++LPS组,LEPR-/-+LPS 组。 LEPR+/+组和 LEPR-/-组腹腔注射0.2 mL PBS;LEPR+/++LPS 组和LEPR-/-+LPS组,根据体重分别腹腔注射LPS(Sigma),注射剂量为0.5 mg/100 g。 随后每1 h 观察大鼠情况,LPS 处理的大鼠濒临死亡时麻醉取材,PBS 组大鼠同时间点取材。 48 h 未死大鼠安乐死取材。 统计LPS 诱导致死的数量,并作生存曲线。 大脑组织福尔摩林固定,按一般病理程序石蜡包埋,制备 5 μm 切片[17],用 1 ∶100 稀释的抗 IBA-1 单克隆抗体(Abcam)标记脑组织的小胶质细胞,用兔二步法免疫组化试剂盒标记二抗,DAB 显色(中杉金桥),Pannoramic 扫描仪扫描(3DHISTECH),观察并统计小胶质细胞的不同活化形态。
1.3.4 蛋白提取与蛋白免疫印迹
收集LEPR+/+和LEPR-/-大鼠原代小胶质细胞,在细胞蛋白裂解液Pierce TM RIPA Buffer 中,加入1%PMSF,1%磷酸酶抑制剂和1%蛋白酶抑制剂(Thermo),冰上裂解 20 min。 4℃,10000 r/min 离心10 min。 用BCA 法测定蛋白浓度。 将蛋白样品按照等质量上样于10%的SDS-PAGE 电泳,冰水混合物中恒流湿转,5%封闭液(脱脂奶粉配置)室温封闭 1 ~ 2 h。 一抗 leptin receptor(5%BSA,1 ∶1000,Abcam)、PI3K(1 ∶1000,CST)、 p-PI3K(1 ∶1000,CST)、AKT(1 ∶1000, CST)、p-AKT(1 ∶1000, CST)。4℃孵育过夜。 TBST 洗膜 3 次,每次 10 min。 兔抗山羊IgG 二抗(1 ∶10000,CST)摇床低速振荡,室温孵育1 h,TBST 洗膜3 次,每次10 min,化学发光试剂盒进行曝光显影。
1.3.5 细胞RNA 提取和实时荧光定量PCR
收集LEPR+/+和LEPR-/-大鼠原代小胶质细胞,TRIzol 法(Thermo)提取 RNA,取1μg RNA 按照试剂盒方法(Takara)进行逆转录反应获取cDNA,RTPCR 检测 leptin receptor 以及 IL-6, i-NOS,IL1-β 等的表达。 以GAPDH 基因作为内参,定量分析。 引物序列见表1。
1.4 统计学方法
所有独立实验重复3 次,用Image J 软件计算蛋白免疫印迹条带灰度值和免疫荧光荧光值,采用GraphPad Prism 7.0 软件进行柱形图绘制和统计学分析,数据以平均数±标准差()表示,组间比较采用独立样本t检验,P<0.05 为差异有统计学意义,多组数据采用方差分析F检验,并得到F值。
2 结果
2.1 LEPR 的表达、敲除效率及 LEPR-/-大鼠对LPS 刺激不耐受
为了确定LEPR 在脑中表达的细胞类型,分离并培养大鼠原代小胶质细胞、星形胶质细胞和神经元,用RT-PCR 分析LEPR 的表达,结果表明,LEPR在小胶质细胞、星形胶质细胞和神经元中均有表达(图1A)。 分离 LEPR 基因敲除大鼠 LEPR-/-的原代小胶质细胞,Western blot 分析证实,LEPR 蛋白表达被完全剔除(图 1B)。 对比分析 LEPR+/+和LEPR-/-大鼠对LPS 刺激的反应性,表明LEPR 敲除增加了大鼠LPS 刺激的敏感性,LEPR-/-大鼠在LPS刺激下48 h 内生存率降低了75%。 (图1C、1D)
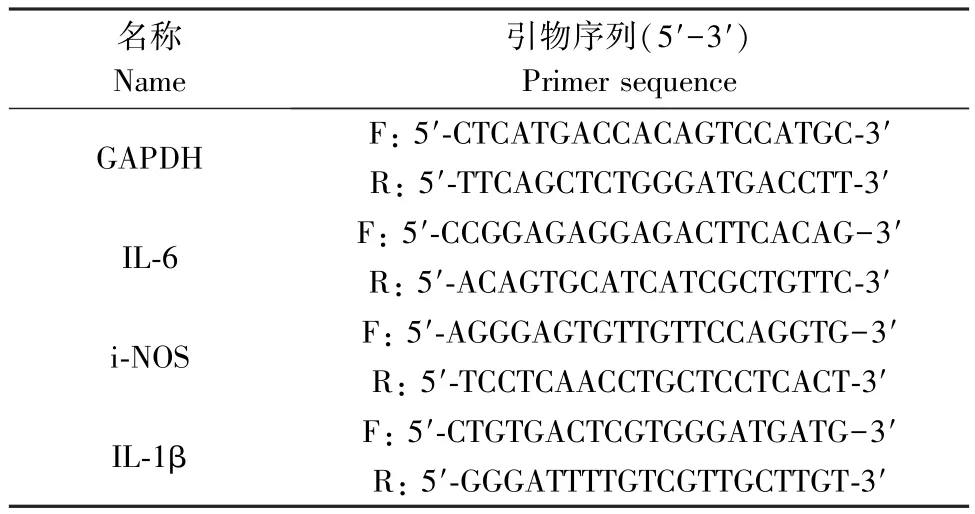
表1 引物序列Table 1 Primer sequence
2.2 小胶质细胞形态结构的变化情况
用小胶质细胞的标志分子Iba1 的抗体,比较分析LEPR+/+和LEPR-/-大鼠大脑组化中小胶质细胞的形态 (图2A、2C),相比于LEPR+/+,LEPR-/-脑组织中处于静息态(Resting)的小胶质细胞减少了55.2%(n= 6,P<0.001), 而趋于活化的肥大态(Hypertrophic)和阿米巴样态(Amoeboid)的小胶质细胞分别增加了34.7%和14.1%(n=6,P<0.01)。LEPR-/-大鼠对 LPS 刺激反应更强烈,相对于LEPR+/+(LPS), LEPR-/-(LPS)大鼠脑组织中处于静息态的小胶质细胞减少了 16.1%(n= 6,P<0.01), 而趋于活化的肥大态和阿米巴样态的小胶质细胞分别增加了 16.6%和 25.1%(n= 6,P<0.01)。 (图2B、2D)统计各种小胶质细胞形态的数目作图(图2E)。
2.3 LEPR 敲除大鼠小胶质细胞炎性因子分泌增加
为了进一步明确LEPR-/-对小胶质细胞的活化作用,分别分离了来源于LEPR+/+和LEPR-/-大鼠的原代小胶质细胞,用RT-PCR 对比分析了3 种炎性因子的mRNA 表达水平(图3A ~3C)。 不存在刺激因素的情况下,与LEPR+/+相比LEPR 敲除导致IL-6, i-NOS,IL-1β 表达分别增多了 61.4 倍,53.7 倍和2.7 倍。 在LPS 刺激的情况下,LEPR 敲除导致 IL-6, i-NOS,IL-1β 表达分别增多了 3.3 倍,1.8 倍和1.9 倍,同时在A-C 三个多组数据中得到的F值分别是94.47,86.95 和33.64。 见图 3D、3F,我们进一步对LEPR+/+小胶质细胞进行瘦素蛋白处理,反向验证了LEPR 的激活可以抑制炎性因子表达,证明敲除LEPR 会增强炎性因子表达。
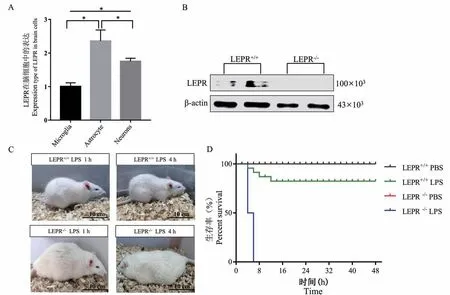
图1 LEPR 的表达、敲除效率及LEPR-/-大鼠对LPS 刺激不耐受Note. A, LEPR expression in microglia, astrocytes and neurons. B, The expression of LEPR gene in microglia of LEPR-/-was completely silenced. C/D, LEPR+/+ and LEPR-/-rat responses to LPS treatment and corresponding survival curves.Pairwise comparisons of the three groups of cells, *P<0.05.Figure 1 Expression and knockout efficiency of LEPR and LEPR-/- rat tolerance to LPS treatment
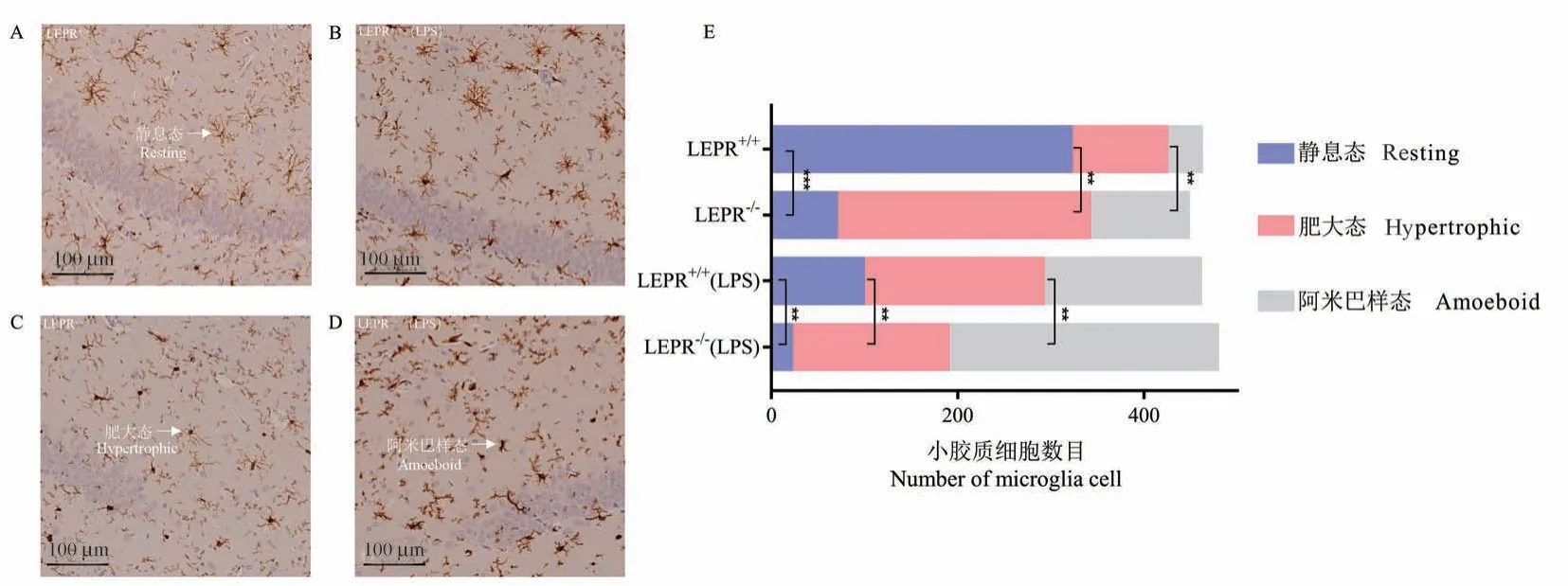
图2 小胶质细胞形态结构的变化情况Note. A/C, LEPR+/+ and LEPR-/- microglia morphology in rat brain slices. B/D,Morphology of microglia in brain slices,LEPR+/+(LPS) and LEPR-/-(LPS) rats. E, Microglia count.Compared with LEPR+/+rats and LEPR+/+(LPS) rats, **P<0.01, ***P<0.001.Figure 2 Changes of microglia cell morphology and structure
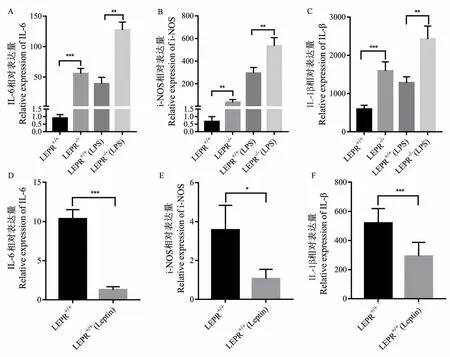
图3 LEPR 敲除大鼠小胶质细胞炎性因子分泌增加Note. A~C,Expression of IL-6,i-NOS,IL-1β in the presence or absence of LPS stimulation. D-F,IL-6,i-NOS,IL-1β expression of in response to leptin.Compared with LEPR+/+rats and LEPR+/+(LPS) rats,*P<0.05, **P<0.01, ***P<0.001.Figure 3 Increased secretion of inflammatory factors in microglia cells of LEPR knockout rats
2.4 LEPR 敲除大鼠小胶质细胞吞噬能力增强
小胶质细胞的活化一般会伴随着吞噬能力的增强,分离LEPR+/+和LEPR-/-原代小胶质细胞,对比分析其对Dextran 的吞噬(图 4A、4B)和 Aβ 的吞噬(图4C、4D),结果表明,相比于LEPR+/+小胶质细胞,LEPR-/-小胶质细胞Dextran 和Aβ 的吞噬分别增加了 10.3 倍和 6.5 倍(P<0.05)。
2.5 PI3K/AKT 信号通路可能参与小胶质细胞促炎促吞噬过程
分离 LEPR+/+和 LEPR-/-大鼠的脑组织,用Western blot 分析 JAK2、STAT3、PI3K、AKT、ERK1/2等信号分子的磷酸化(图5A ~C)。 LEPR 敲除没有明显改变JAK2、STAT3和ERK1/ 2的磷酸化水平(结果未见)。 LEPR 敲除反而激活了PI3K/AKT 通路LEPR-/-脑组织蛋白中PI3K 和AKT 的磷酸化分别增加了 2.9 倍和 1.6 倍(P<0.05)。
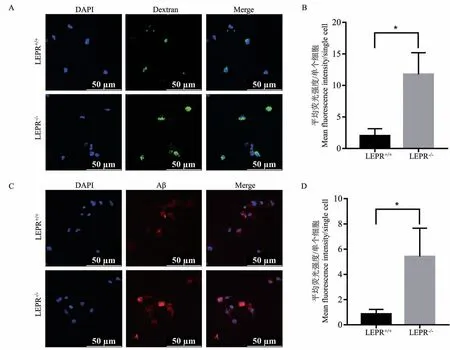
图4 LEPR 敲除大鼠小胶质细胞吞噬能力增强Note. A/B, Dextran phagocytosis. C/D, Aβ phagocytosis.Compared with LEPR+/+rats, *P<0.05.Figure 4 Enhanced phagocytosis of microglia cells in rats with LEPR knockout
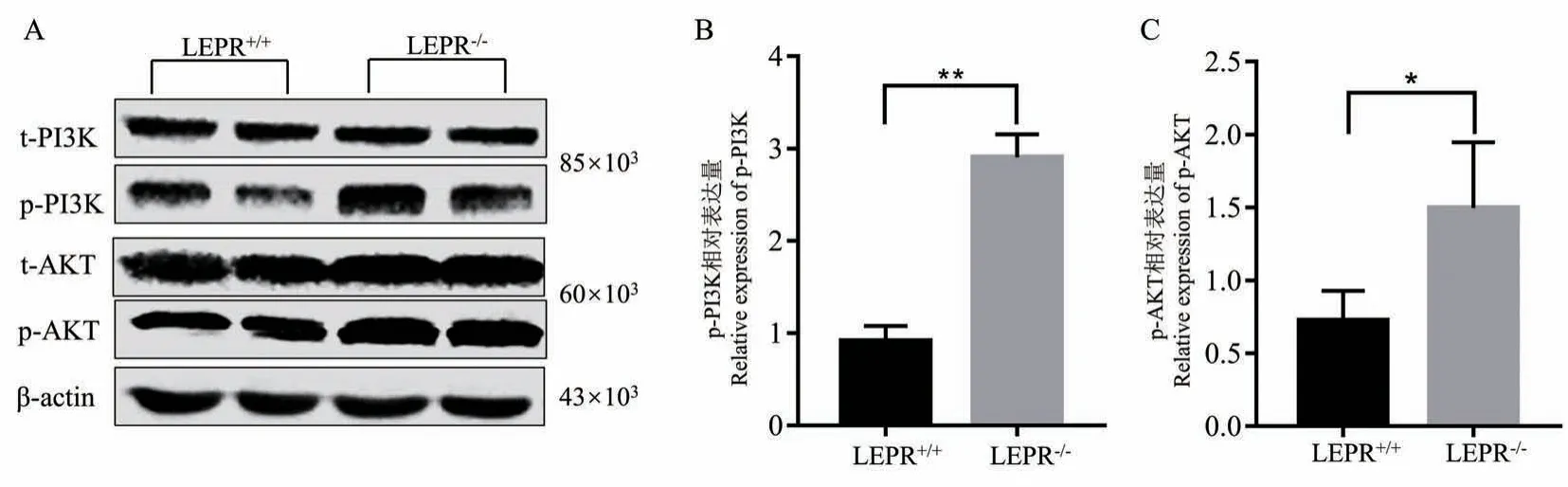
图5 PI3K/AKT 信号通路可能参与小胶质细胞促炎促吞噬过程Note. A, PI3K/AKT pathway. B, p-PI3K gray value. C, p-AKT gray value.Compared with LEPR+/+rats, *P<0.05.Figure 5 PI3K/AKT signaling pathway may be involved in the proinflammatory and phagocytic process of microglia cells
3 讨论
瘦素主要由脂肪组织分泌,与瘦素受体结合,除了调节能量代谢,还能作为炎性因子激活巨噬细胞,参与外周神经性疼痛[18-20]。 表达在巨噬细胞中的瘦素受体维持着其吞噬,清除的能力,影响炎性因子的分泌,并被证实瘦素受体可单独影响巨噬细胞不受其他因素干扰[21-22]。 小胶质细胞认为是脑组织中特化的巨噬细胞[14],但关于瘦素受体与小胶质细胞的报道却很少。 小胶质细胞不管是本身的生物学特性,还是微环境与巨噬细胞有一定的差别,对巨噬细胞的研究结论不能简单的推理至小胶质细胞。 本研究通过 LEPR 敲除大鼠明确了在LEPR 缺失的情况下,小胶质细胞会由静息状态转化为肥大形态和阿米巴样形态,并表现出促炎和促吞噬的表型。 推测Leptin/LEPR 在小胶质细胞中,应该是抗炎的,而不是巨噬细胞中的促炎作用。
LEPR 基因敲除导致小胶质细胞活化主要表现在三个方面:第一、LEPR-/-大鼠的脑组织中小胶质细胞由静息形态向肥大形态和阿米巴样形态转换,表现为胞体变大(图2)。 小胶质细胞的增生与肥大被认为是M1 型的极化,通常与炎症有关[23-25],阿米巴样形态的小胶质细胞更倾向于吞噬[26-28]。 第二、LEPR-/-小胶质细胞比LEPR+/+小胶质细胞表达更多的 IL-6,i-NOS 和 IL-1β 等炎性因子(图 3)。 小胶质细胞分泌IL-6 增多,通常认为与脑损伤,自闭症和多动症有关[29-30];IL-1β 和i-NOS 升高与神经炎症有关[31-32],在给予 LPS 刺激后,LEPR+/+组和LEPR-/-组的 IL-6,i-NOS 和 IL-1β 表达均升高,并且LEPR-/-组炎性因子升高更为明显,我们发现LEPR敲除后发生的内质网应激参与了炎症[10],提示内质网应激可能在LEPR-/-组在LPS 刺激后炎性因子明显升高中发挥作用;此外我们也做了肿瘤坏死因子TNF-α 的表达,发现 LEPR-/-组 TNF-α 的表达存在争议,这与我们预期不符(结果未显示),猜测LEPR的敲除会降低磷酸酶D1 的表达从而抑制了TNF-α的表达;第三、LEPR-/-小胶质细胞比LEPR+/+小胶质细胞表现出更强的吞噬Aβ 和Dextran 的能力(图4),这与小胶质细胞由静息形态向阿米巴样形态转变结果相符合。 无论是在 leptin 突变的 ob/ob 和LEPR 突变的db/db 小鼠,都有明显的脑损伤和神经炎症[12-13], 结合我们的研究结果,ob/ob 和db/db小鼠的神经炎症不仅仅是肥胖和2 型糖尿病引起的,一部分原因应该是leptin 和LEPR 的功能缺失引起的小胶质细胞活化。 我们对比分析了几种可能参与小胶质细胞活化的信号通路,发现LEPR 敲除没有明显改变JAK2、STAT3 和ERK1/2 的磷酸化水平,反而是激活了PI3K/AKT 通路(图5),有报道认为,PI3K/AKT 激活,能调节 IL-6,i-NOS,IL-1β,TNF-α 等炎性因子的表达[33-34],我们的结果未能解释LEPR 敲除如何激活了PI3K/AKT 通路,但是该通路的激活可能是小胶质细胞活化的信号通路之一。
综上所述,本研究在瘦素受体敲除的大鼠模型中发现小胶质细胞向着促炎促吞噬的表型转变,首次将瘦素受体与小胶质细胞和神经炎症联系起来,并揭示了LEPR/Leptin 可能通过小胶质细胞调节神经炎症,并可能在中枢神经系统里面发挥着某种保护性作用。

