诱导刺激猴外周血单核淋巴细胞亚群活化增殖研究
李国萃,陆佳涵,卢秋翰,杨晨波,丛 喆,魏 强
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
在许多免疫系统疾病的研究中,T 细胞激活和增殖程度可以反应疾病的进展状况。 通常将PBMC(外周血单个核细胞)作为靶细胞来研究细胞因子的分泌和表面活化标志物及增殖标志物的表达等。常用的 T 细胞刺激剂为 PMA+Ionomycin、α-CD2/α-CD3/α-CD28、PHA-P+IL-2 等。 T 细胞接受活化信号后,检测活化分子的表达是一种常规手段。 CD69分子是自然杀伤细胞受体家族的C 型凝集素,T 淋巴细胞被活化后,CD69 迅速被诱导表达,而且在短时间内很快便能达到高峰,因此CD69 被用作淋巴细胞活化的早期标志物[1-2]。 CD38 分子常作为一种用于诊断临床疾病的指标,同时也是T 细胞晚期活化标记物[3-4]。 HLA-DR 分子是MHC-II 类分子,主要起着抗原呈递的作用,也是T 细胞活化的常用标志物。 Ki67 常作为T 细胞增殖标记。 本研究拟通过流式细胞术检测T 细胞活化分子来比较几种不同T 细胞刺激剂的活化效果,以期为T 细胞激活相关研究选择合适的刺激剂奠定实验基础。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
3 只 SPF 级中国恒河猴,1 只雌性,2 只雄性,年龄为3~6 岁,体重约7 ~8 kg,均购自北京协尔鑫生物资源研究所[SCXK(京) 2015-0011]。 实验前通过免疫荧光法筛查,排除猴疱疹病毒,猴逆转录D型病毒,猴免疫缺陷病毒及猴T 淋巴细胞性I 型病毒。 实验动物的饲养及实验操作在中国医学科学院医学实验动物研究所生物安全三级实验室进行[SYXK(京) 2017-0027]。 实验进程遵循3R 原则。本实验使用的实验动物程序通过了中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)的批准(XJ19003)。
1.1.2 实验细胞
外周血单核细胞来源于健康恒河猴。
1.2 主要试剂与仪器
T 细胞刺激剂:Cell Stimulation Cocktail(Cat.No:00 - 4975 - 73) 购自 eBioscience 公 司; T Cell Activation/ Expansion Kit non-human primate(Cat.No:130-092-919)购自Miltenyi biotec 公司;PHA-P(Cat.No: L1668)购自 SIGMA 公司;IL-2(Cat.No:202-IL)购自R&D 公司[5-8];流式实验所用试剂为fixation/permeabilization concentrate (Cat. No: 00 -5123-43)、fixation/permeabilization diluent(Cat.No:00-5223-56)和 permeabilization Buffer 10×(Cat.No:00-8333-56) 购自 ebioscience 公司。 流式染色方案见表1。
流式仪:检测T 细胞表面活化标志物所用流式仪:型号为BD FACSAria II,产地为美国;检测T 细胞核内 Ki67 抗原所用流式仪:型号为 BD Accuri C6, 产地为美国;显微镜:型号为Nikon ECLIPSE Tiu, 产地为日本。
表1 抗体一览表Table 1 List of antibodies
1.3 实验方法
1.3.1 PBMC 的分离
采集健康恒河猴的外周血[9],离心后弃去上层血浆,加入与全血相等体积的1640 培养基进行稀释,吹打混匀,将稀释后的全血加入装有Ficoll 液体的离心管中,离心后吸取中间PBMC 细胞层至新的离心管中,加入1640 培养基进行洗涤,离心后弃去上清液体,轻轻弹起管底细胞团块,用1640 培养基重悬至所需要的浓度,进行后续的实验。
1.3.2 T 细胞刺激剂刺激PBMC
(1) 用 PMA + Ionomycin/PHA-P + IL-2 刺激PBMC
分离好PBMC 后[10],用含有10%FBS 和2%双抗的完全培养基重悬细胞,分装到48 孔板中,细胞浓度 为 每 孔 1 × 106mL, 每 孔 加 入 2 μL Cell Stimulation Cocktail/4 μg/mL 的 PHA-P 和 20 ng/mL的IL-2,用枪头吹打混匀,放入37℃,5%CO2孵箱中进行培养。 在不同时间点收取细胞,进行后续的流式实验。
(2) 用T Cell Activation/ Expansion Kit nonhuman primate 刺激 PBMC
取出装载好抗体的磁珠(抗体终浓度为10 μg/mL),加入含10%FBS 的X-VIVO 15TM培养基,离心后重悬备用。 同时将PBMC 用上述培养基重悬,并与重悬备用的磁珠混合均匀。 加入48 孔板中,细胞浓度为每孔1×106mL,37℃,5% CO2培养箱孵育,在不同时间点收集细胞,进行后续实验。
1.3.3 流式方法检测T 细胞表面活化标志物。
将孔板中的细胞悬液加入流式管中,同时加入CD3-BV605、 CD8-PE、 CD4-BV785、 CD69-BV421、CD38-FITC 和 HLA-DR-BV510,4℃下放置30 min,1%多聚甲醛溶液固定,最后上机检测染色情况[11]。
1.3.4 流式方法检测T 细胞核内Ki67 抗原
将孔板中的细胞悬液加入流式管中[12],并加入CD3-PerCP、CD4-APC 和 CD8-PE,4℃ 放置 30 min。随即加入配制好的固定/破膜液作用30 min。 加入Ki67-FITC 抗体,室温避光30 min,1%多聚甲醛溶液固定,上机检测分析结果。
1.4 统计学方法
流式数据用 FlowJo V10 软件进行分析,用GraphPad prism8 绘制图形,进行统计学分析时用平均数±标准差()表示实验结果,对不同T 细胞刺激剂的实验数据组间进行差异分析,“ns”表示P>0.05,没有统计学意义,P<0.05 表示具有统计学意义,用“*”表示。
2 结果
2.1 不同T 细胞刺激剂刺激PBMC 时,早期活化标志物CD69 分子的表达情况
PBMC 经 α-CD2/α-CD3/α-CD28 刺激后,2 h时在CD4+T 细胞和CD8+T 细胞上就可以检测到CD69 的表达,其中 CD69+CD4+T 细胞的比例为(18.000±1.908)%,CD69+CD8+T 细胞的比例为(14.867±1.762)%,2 h 后 CD69 在两种主要的 T 细胞亚群上的表达呈直线上升趋势。 24 h 时达到高峰,该时间点CD69 在CD4+T 细胞和CD8+T 细胞上所占比例分别为(94.333±1.365)%和(94.867±1.607)%,随即呈下降趋势(图1A);虽然PHA-P+IL-2 刺激下的CD69 在两种T 细胞亚群上的表达趋势与 α-CD2/α-CD3/α-CD28 作用后的趋势大致相似,但前者刺激下的CD69 的表达量远低于后者;在PMA+lonomycin 刺激后,CD69 的表达均呈低水平缓慢增加,在72 h 的占比分别为(13.233±1.986)%(CD69+CD4+T 细胞)和(11.667±1.850)%(CD69+CD8+T 细胞)。
将三种刺激剂作用72 h 后的CD69 的表达量分别进行两组间的比较分析,结果表明均具有显著性差异,且 α-CD2/α-CD3/α-CD28 刺激后的结果显著高于其他两种刺激剂(P<0.0005,图1B)。 从中可以看出,α-CD2/α-CD3/α-CD28 激活 T 细胞效率最高,PHA-P+IL-2 次之,PMA+lonomycin 激活效率最低。
2.2 不同T 细胞刺激剂刺激PBMC 时,晚期活化标志物CD38 分子和HLA-DR 分子的表达情况
α-CD2/α-CD3/α-CD28 作 用 于 PBMC 后,CD38+CD4+T 细胞和CD38+CD8+T 细胞所占比例均在120 h 时达高峰,比例分别为(90.533±1.986)%和(87.133 ± 2.511)%; 而 PHA-P + IL-2 作 用 于PBMC 后,CD38 的表达呈缓慢上升趋势,CD38+CD4+T 细胞和CD38+CD8+T 细胞在168 h 的占比分别为(89.300±2.524)%和(89.900±2.252)%;PMA+Ionomycin 刺激后,CD38+CD4+T 细胞和 CD38+CD8+T 细胞所占比例在6 h 到达高峰,之后呈下降趋势(图2A)。 和CD38 不一样,三种刺激剂作用后的 HLA-DR 的表达量均很低。 α-CD2/α-CD3/α-CD28 刺激下,HLA-DR+CD4+T 细胞在所有时间点中的最大比例为(4.150±1.570)%,HLA-DR+CD8+T细胞在所有时间点中的最大比例为(2.390 ±0.875)%;PHA-P+IL-2 刺激后,HLA-DR 在 CD4+T细胞和CD8+T 细胞上的最大表达量分别为(1.923±0.194)%和(1.430±0.166)%;PMA+Ionomycin 刺激72 h 后,HLA-DR+CD4+T 细胞和 HLA-DR+CD8+T细胞的占比分别为(4.010±0.783)%和(4.413±1.090)%(图2B),将三种刺激剂作用 72 h 后的CD38 在两种主要T 细胞亚群上的表达量进行组间比对,其中PMA+Ionomycin 与其他两种刺激剂组间比对均有统计学差异(P<0.01,图2C),而α-CD2/α-CD3/α-CD28 与 PHA-P+IL-2 组间比对表明 PMA+Ionomycin 刺激效果最差(无差异,图2C)。

图1 不同刺激剂作用后,CD4+T 细胞和CD8+T 细胞上CD69 的表达量变化Note. A, Expression of CD69 on T cells stimulated by different stimulants. B, Percentage of CD69+CD4+T cells and CD69+CD8+T cells stimulated for 72 h by different stimulants. C, Representative dot plots showing gating strategy for CD69 molecular.Compared with the group stimulated by α-CD2/α-CD3/α-CD28, ****P < 0.0001. Compared with the group stimulated by PMA+lonomycin , ****P < 0.0001,***P<0.001. Compared with the group stimulated by PHA+IL-2 , ****P<0.0001, ***P<0.001.Figure 1 Expression of CD69 on CD4+T cells and CD8+T cells stimulated by different stimulants
将三种刺激剂作用72 h 后的HLA-DR 的表达量进行组间比对,只有PMA+Ionomycin 与PHA-P+IL-2 组间有差异(P<0.01,图 2C)。
2.3 不同T 细胞刺激剂刺激PBMC 时,增殖标记Ki67 分子的表达情况
α-CD2/α-CD3/α-CD28 作用于 PBMC 后,Ki67+CD4+T 细胞和Ki67+CD8+T 细胞的比例在72 h 内快速上升,之后缓慢上升,120 h 后快速下降,所有时间点中最大比例分别为(87.067 ± 2.113)% 和(95.167±2.550)%;PHA-P+IL-2 刺激后,Ki67 在两种T 细胞亚群中的比例在168 h 内缓慢上升,168 h时Ki67+CD4+T 细胞的所占比例为(35.633 ±3.951)%,Ki67+CD8+T 细胞的所占比例为(22.933±2.804)%;PMA+Ionomycin 刺激后,Ki67+CD4+T 细胞和Ki67+CD8+T 细胞的比例在72 h 内缓慢下降(图3A)。 将三种刺激剂作用72 h 后的Ki67 的表达量进行组间比较,其中 α-CD2/α-CD3/α-CD28 与其他两种刺激剂组间比对均有统计学差异(P<0.0001,图3B)。 该结果与细胞图片结果趋于一致,细胞图片显示,相比正常 PBMC,α-CD2/α-CD3/α-CD28 刺激 PBMC 72 h 后,细胞形状变大,数量变多,呈梭状或圆形;PHA-P+IL-2 刺激 PBMC 72 h后,细胞黏附成团;PMA+Ionomycin 刺激PBMC 72 h后,细胞几乎全部死亡(图3C、3D)。
3 讨论
外周血单个核细胞因其重要的作用常被作为许多疾病中研究T 细胞激活的靶细胞。 由于不同刺激剂活化T 细胞所涉及的信号通路不一样,因此理论上T 细胞被激活的效率和规律也不一样[13-14]。为确定不同刺激剂诱导活化T 淋巴细胞的基本规律,本研究选用了 α-CD2/α-CD3/α-CD28、PHA-P+IL-2 和PMA+Ionomycin 三种常用的刺激剂组合,运用流式细胞术检测活化分子在两种主要T 细胞亚群上的表达量来确定T 细胞活化效率。
CD69 分子是T 细胞早期活化标志物。 T 细胞接受活化信号后,在2 h 就可以检测到CD69 的表达,在24 h 左右达到高峰,3 d 内在T 细胞表面平稳表达,之后开始下降[1-2]。 本研究中,经 α-CD2/α-CD3/α-CD28 和 PHA-P +IL-2 刺激后,T 细胞上CD69 的表达趋势与文献中基本相符。 三种刺激剂中,经 α-CD2/α-CD3/α-CD28 刺激后,T 细胞上CD69 的表达量显著高于其他两种刺激剂。 而PMA+Ionomycin 刺激后的CD69 的表达远远低于另外两种刺激剂,表明PMA+Ionomycin 刺激效率低下。
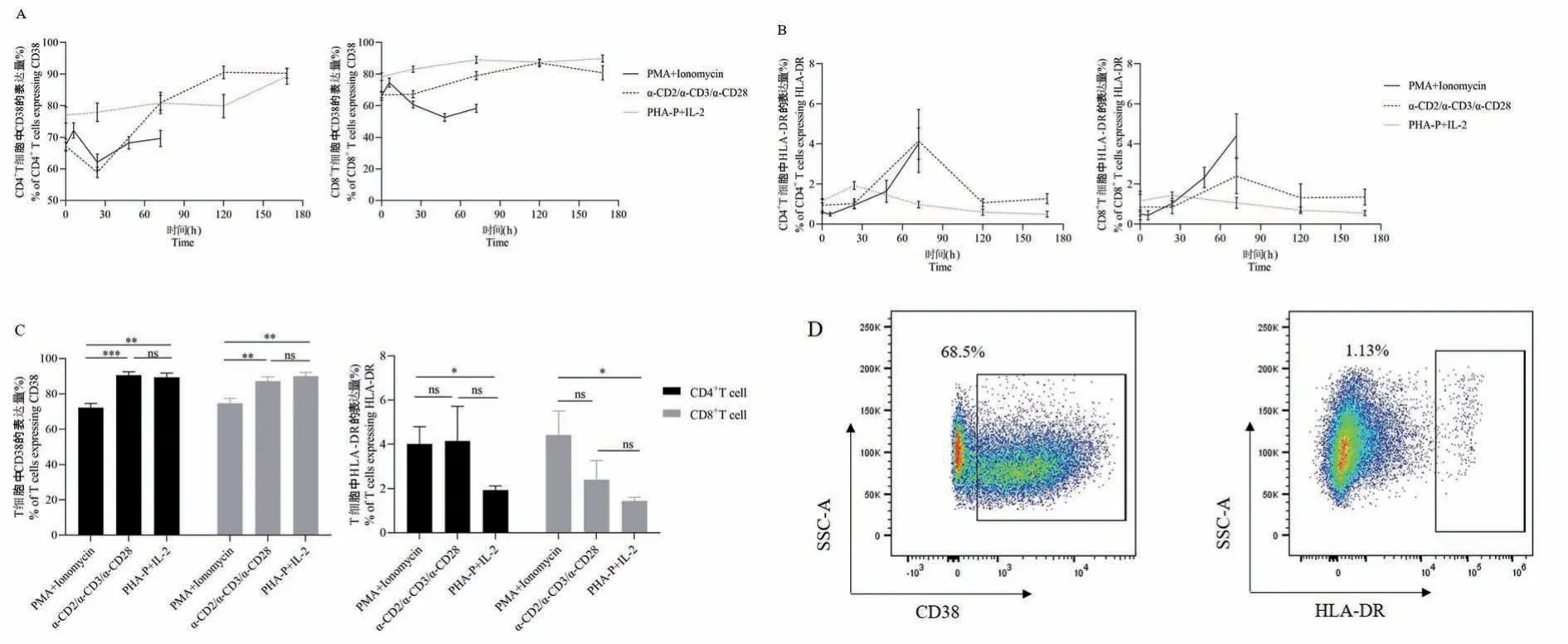
图2 不同刺激剂作用后,CD4+T 细胞和CD8+T 细胞上CD38、HLA-DR 的表达量变化Note. A, Expression of CD38 on T cells stimulated by different stimulants. B, Expression of HLA-DR on T cells stimulated by different stimulants.C, Percentage of CD38 and HLA-DRon CD4+T cells and CD8+T cells stimulated for 72 h by different stimulants.D, Representative dot plots showing gating strategy for CD38 molecular and HLA-DR molecular.Figure 2 Expression of CD38 and HLA-DR on CD4+T cells and CD8+T cells stimulated by different stimulants
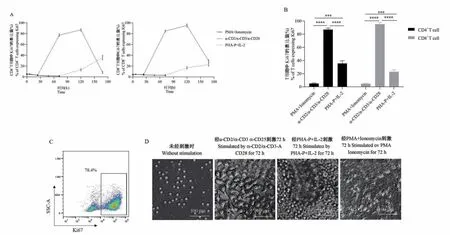
图3 不同刺激剂作用后,CD4+T 细胞和CD8+T 细胞上Ki67 的表达量Note. A, Expression of Ki67 on T cells stimulated by different stimulants. B,Percentage of Ki67+CD4+T cells and Ki67+CD8+T cells stimulated for 72 h by different stimulants. C, Representative dot plots showing gating strategy for Ki67. D, The PBMC befor and 72 h after stimulation.Figure 3 Expression of Ki67 on CD4+T cells and CD8+T cells stimulated by different stimulants
CD38 分子是一种常用的活化标志物,在T 淋巴细胞活化晚期表达[4],常与同为T 细胞晚期活化标志物的HLA-DR 分子联合使用[15-16]。 本研究中,经三种刺激剂作用72 h 后,CD38+CD4+T 细胞和CD38+CD8+T 细胞的占比在 α-CD2/α-CD3/α-CD28与 PHA-P + IL-2 组间无差异, 且高于 PMA +Ionomycin 刺激后的结果。 T 细胞上 HLA-DR 的表达量在三种刺激剂刺激后均很低,经 α-CD2/α-CD3/α-CD28 刺激 后的 HLA-DR+CD4+T 细胞 和HLA-DR+CD8+T 细胞的比例与另外两种刺激剂组间比对无差异,而PMA+Ionomycin 刺激后的HLADR 在两种主要T 细胞亚群上的表达量高于PHA-P+IL-2。
Ki67 是一种T 细胞增殖标记,在细胞周期的各阶段中除了G0 期外都会高度表达[17-18]。 本文中,经PMA+Ionomycin 刺激后,T 细胞上Ki67 的表达量低下,α-CD2/α-CD3/α-CD28 刺激后的 Ki67 表达量显著优于其他两种刺激剂。 且将三种刺激剂作用72 h 后的T 细胞上Ki67 的表达量进行组间比对,均显示有显著性差异(P<0.0001)。 细胞图片显示,在不同刺激剂作用PBMC 72 h 后,细胞或增大呈梭状圆形且数量增多(α-CD2/α-CD3/α-CD28),或黏附成团(PHA + IL-2), 或基本全部死亡(PMA +Ionomycin),这与不同刺激剂刺激后的Ki67 的表达相符:α-CD2/α-CD3/α-CD28 刺激后 72 h 时,Ki67+CD4+T 细胞和 Ki67+CD8+T 细胞的比例基本达峰值,PMA+Ionomycin 刺激后 72 h 时,Ki67+CD4+T 细胞和Ki67+CD8+T 细胞的比例在检测的所有时间点中最低。 PHA-P+IL-2 作用于细胞后,造成细胞黏附,在流式仪上样时可能会堵塞进样针,从而可能会造成实验结果的误差。
综上所述,α-CD2/α-CD3/α-CD28、PHA-P+IL-2和 PMA+Ionomycin 三种刺激剂中,α-CD2/α-CD3/α-CD28 活化 T 细胞的效率最优,PHA-P +IL-2 次之,PMA+Ionomycin 效率最差。 在 α-CD2/α-CD3/α-CD28 刺激下,CD69 和 Ki67 在两种 T 细胞亚群上的表达量显著高于其他两种T 细胞刺激剂。 同一种活化分子在不同T 细胞亚群上的表达量不一样,可能与T 细胞亚群的增殖速率不同有关,也可能与不同T 细胞亚群上表达的活化分子在疾病中所起的作用不同有关。 PMA+Ionomycin 的刺激效率最低,可能是因为其活化T 细胞涉及的信号通路不像α-CD2/α-CD3/α-CD28 能引起强烈的下游信号传导,也可能是因为PMA+Ionomycin 作用于细胞后,随着时间的延长,细胞死亡率增大,因此该刺激剂更适合作为短期刺激剂来使用。

