短期低频电刺激对长距离陈旧性(8 周)周围神经缺损再生能力的影响
焦海山,宋悦宁,肖 波,黄 健,李东印
(1.苏州卫生职业技术学院基础医学教研室, 江苏苏州 215009; 2.苏州卫生职业技术学院临床医学教研室,江苏苏州 215009)
周围神经损伤在临床上较为常见,按治疗原则应尽早恢复神经的连续性,但由于临床损伤的复杂性,受各种主观、客观条件影响,在急性期未得到及时处理而演变为陈旧性损伤的病例仍较多。 相对于急性神经损伤,陈旧性神经损伤中近端神经元的成活率,远端维持再生神经生长的微环境等条件皆较差,尤其是失神经支配的远侧断端和靶器官的等待时间将比急性损伤直接修复长,导致陈旧性神经损伤修复效果较差[1-4]。
1 材料和方法
1.1 实验动物
健康雌性SPF 级SD 大鼠30 只由中科院上海实验动物中心提供[SCXK(沪)2017-0005],7 周龄,体重160~180 g 左右,随机分为缺损8 周自体神经修复+SLES 组(实验组,n=15),缺损8 周自体神经修复组(对照组,n=15)。 动物实验在苏州大学实验动物中心完成[SYXK(苏)2016-0049]。 动物实验研究由苏州卫生职业技术学院实验动物伦理委员会审查并批准(SWAE202002),动物实验过程遵循3R 原则。
1.2 主要试剂与仪器
小鼠抗生长相关蛋白-43 (growth-associated proteins 43,GAP-43)单抗、兔抗脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)多抗、羊抗小鼠 IgG-FITC 二抗、羊抗兔 IgG-TRITC 二抗、小鼠抗神经丝蛋白(neurofilament, NF)单抗、兔抗可溶性蛋白-100(soluble protein-100, s-100)多抗(以上抗体皆来自武汉博士德生物工程有限公司);荧光金(Fluoro-Gold,FG)逆行示踪剂(Fluorochrome 公司, 美国);TI CFIS60 倒置荧光显微镜(Nikon 公司,日本);JEM1230 透射电镜(JEOL 公司,日本)。
1.3 实验方法
1.3.1 模型制备、修复及一般观察
以含3%的戊巴比妥钠的复合麻醉剂(30 mg/kg)对动物进行腹腔注射麻醉,麻醉成功后,选取左侧股中部切口,在无菌条件下切开并钝性分离暴露左侧坐骨神经,在股中部位置切除大鼠坐骨神经6 mm,神经切除后,将近、远侧断端神经分别翻转180°,以9-0 医用锦纶单丝线(上海浦东金环医疗用品有限公司)将神经断端分别缝合固定在不同的肌间隙中,避免神经自发再生。 手术完成后将动物继续饲养8 周,同前麻醉、自原切口无菌条件下进入,暴露损伤侧坐骨神经,修剪近、远侧神经断端,制成大鼠坐骨神经13 mm 缺损延迟8 周修复的陈旧性神经缺损模型。 无菌条件下切取对侧股中部13 mm 长正常坐骨神经桥接至左侧坐骨神经缺损。实验组动物在桥接后采用BL-420F 生物机能实验系统(成都泰盟科技有限公司)施以SLES 处理:阴性电极固定在近侧端神经干上,阳性电极固定于神经附近的骨骼肌上,予以1 h 的低频(20 Hz)方波电刺激(3 V, 0.1 ms),对照组桥接后同前放置电极,但不予刺激。 手术完成后缝闭切口,除用于观察神经元相关因子表达情况的动物外,皆继续常规饲养3个月取材。
1.3.2 取材观察
(1)神经元中相关因子表达观察
诺贝丽斯(Novelis)是全球领先的铝压延产品制造商,以及全球最大的铝回收利用公司。诺贝丽斯的运营覆盖全球10个国家,拥有约11 000名员工,其2017财年的收入约为100亿美元。诺贝丽斯为北美洲、欧洲、亚洲和南美洲的运输、包装、建筑、工业和消费电子市场提供优质铝板和铝箔产品。诺贝丽斯是铝和铜领域全球领导者印度铝工业有限公司(Hindalco Industries Limited)的子公司。
随机选取实验组、对照组修复术后1、2、7 d 的实验动物各2 只,同前麻醉后,经心脏灌注,取脊髓L4—L5 节段以及相应的背根节,经4%多聚甲醛后固定等处理后,冰冻切片,作抗GAP-43、BDNF 免疫荧光组织化学染色,(一抗:小鼠抗GAP-43 单抗,1 ∶300;兔抗 BDNF 多抗,1 ∶200;二抗:羊抗小鼠 IgG-FITC,1 ∶250;羊抗兔 IgG-TRITC,1 ∶250),TI CFIS60荧光显微镜观察并记录图像。
(2)荧光金逆行示踪实验
动物第2 次手术后3 个月,随机选取实验组和对照组3 只动物,同前麻醉后,在远侧吻合口以远5 mm 处使用微量进样针给每只动物注射5%FG 逆行示踪剂10 μL,动物注射示踪剂后继续饲养1 周取材,选取脊髓腰膨大段(L4—L5)以及相应的背根节,常规后固定等处理后冰冻切片,荧光显微镜观察并记录图像。 使用Abercrombie 等[11]报道的方法计数FG 标记的神经元数量。
(3)神经肌肉形态学观察和计量
剩余动物第2 次手术后3 个月取材,同前麻醉,切取实验侧腓肠肌,称重并计算相对湿重比(术侧腓肠肌重量/体重×100%),常规后固定梯度蔗糖沉底后冰冻切片,作Karnovsky-Root 运动终板胆碱酯酶组化染色,显微镜观察并记录图像。
切取桥接物及两端相连的神经,每组随机选取3 只,切取远端吻合口以远5 mm 处神经作电镜标本处理,常规铀-铅染色,JEM1230 透射电镜观察。 图像分析系统进行图像处理,计算有髓神经纤维轴突直径及髓鞘厚度等指标。
其余3 只选取桥接物中段作冰冻切片,分别作神经三色染色和抗NF、S-100 免疫荧光组织化学染色(一抗:小鼠抗 NF 单抗,1 ∶400;兔抗 S-100 多抗,1 ∶200;二抗:羊抗小鼠 IgG-FITC,1 ∶250;羊抗兔 IgGTRITC,1 ∶250),荧光显微镜观察并采图。
1.4 统计学方法
2 结果
2.1 神经元中相关因子表达观察
实验组脊髓运动神经元(图1)和背根节(图2)感觉神经元GAP-43 和BDNF 的表达在修复后1 ~2 d 增加,7 d 后逐渐下降。 而对照组修复术后 1、2、7 d,两种因子的表达上调较为缓慢,在第1、2 天几乎难以观察到因子表达,迟至第7 天才观察到少量神经元内出现GAP43 和BDNF 的表达。
2.2 荧光金逆行示踪结果
实验组与对照组动物术侧脊髓灰质前角及相应背根神经节中皆观察到被FG 逆行标记的神经元胞体(图3),但实验组与对照组中被FG 标记的神经元数量则未观察到明显差别(表1)。
2.3 再生神经形态观察
2.3.1 再生神经大体观察
两组再生神经与近远侧端神经连接良好,连接处无明显膨大、肿胀,无粘连,表面血管生长清晰可见。
2.3.2 光镜观察
两组中段神经组织横切面三色染色(髓鞘染成红色,轴突染成蓝绿色)和纵切面抗NF 与S-100 双重免疫荧光组织化学染色(髓鞘成红色荧光,轴突为绿色荧光)的切片上皆观察到发育良好的再生神经组织(图4、5),有髓神经纤维分布均匀,三色染色片中神经纤维间皆可见少量增生结缔组织,两种染色片中实验组相对于对照组皆未观察到明显优势,当然与正常神经相比,无论是髓鞘发育程度还是神经纤维密度等皆差异明显。
2.3.3 电镜观察
实验组与对照组远端神经电镜图片(图6)上,可见较多的有髓神经纤维,髓鞘结构致密均匀,板层结构清晰,再生神经纤维成簇分布。 形态学统计分析显示(表1),髓鞘厚度及神经纤维密度两项指标实验组虽略高于对照组,但未见明显组间差别(P值分别为0.767,0.908),轴突直径和G 比值两项指标对照组略高于实验组,但组间差异亦不明显(P值分别为0.960,0.565)
2.4 腓肠肌形态观察与计量
2.4.1 腓肠肌大体观
整个实验过程中,随时间的延长,缺损神经对应的靶肌肉萎缩情况逐渐加重。 桥接修复时观察到两组动物术侧腓肠肌较相应的非手术侧均有不同程度的萎缩。 取材时发现,两组动物术侧靶肌肉萎缩明显,肉眼观与对照组类似。
2.4.2 相对湿重比
实验组术侧腓肠肌相对湿重比略高于对照组(表1),但组间差异亦不明显(P=0.760)。
2.4.3 光镜观察
在两组动物实验侧腓肠肌Karnovsky-Root 运动终板胆碱酯酶组化染色切片上(图7),皆观察到一定数量的运动终板,呈类圆形或椭圆形、深棕色,肌纤维横纹清晰,可见有未着色的运动神经纤维(研究中曾采用镀银复染证实其为神经纤维)与运动终板相连。
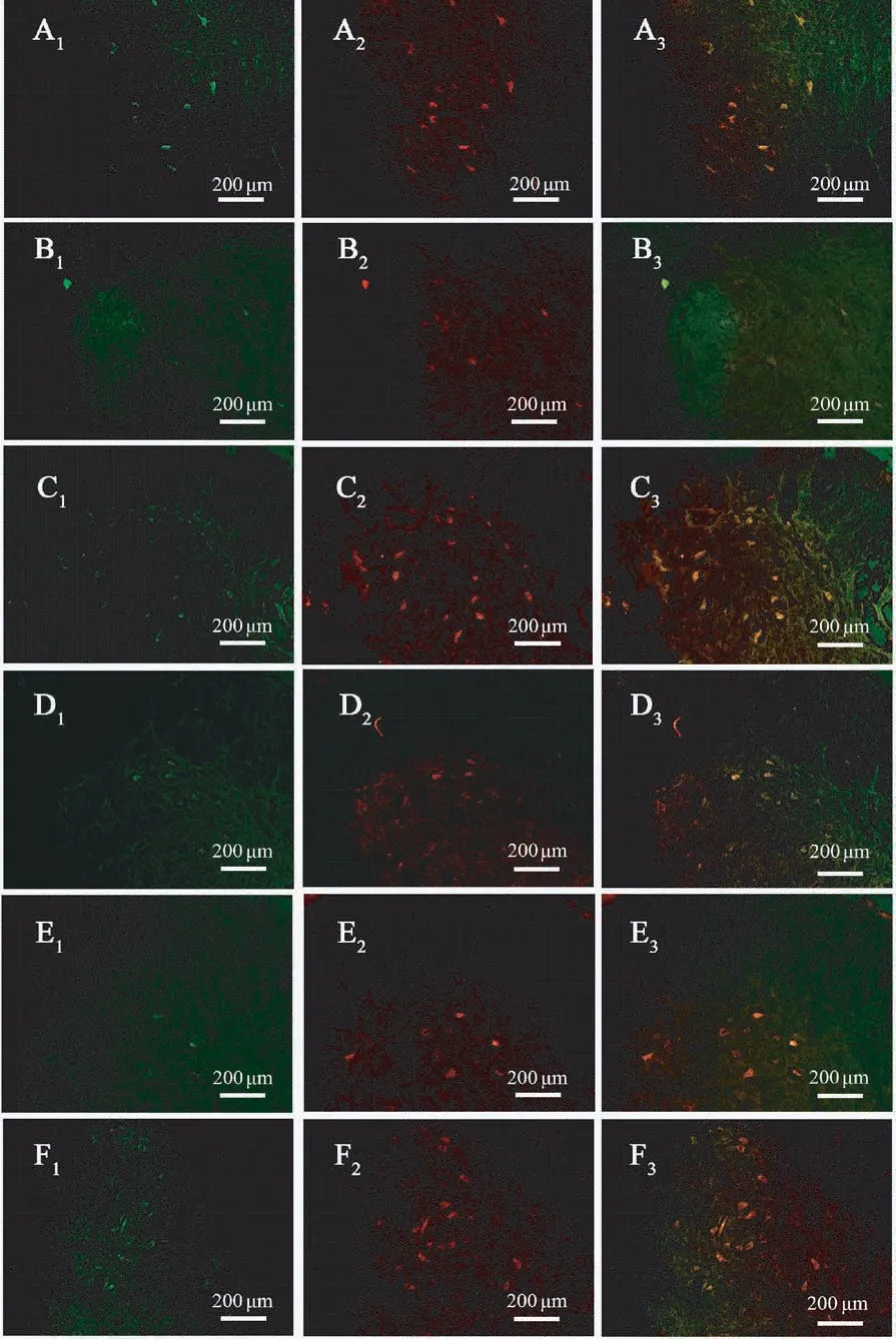
图1 神经缺损8 周修复术后不同时间段脊髓横切面抗GAP43 和BDNF 双重免疫荧光组织化学染色Note. Staining for GAP43 (A1-F1,green) and BDNF (A2-F2,red) (merged in A3-F3) in the experimental group (A1-A3、C1-C3、E1-E3) or control group(B1-B3、D1-D3、F1-F3) at 1,2, 7 days after repair, respectively. The same as below.Figure 1 Light micrographs following double staining for GAP43 and BDNF on the transversely sectioned spinal cord after repair of the 8-week-delayed defective nerve
3 讨论
周围神经缺损再生是世界性难题,陈旧性周围神经再生修复更是困难。 由于受传统理论的影响,特别是在学术界长期占据统治地位的“神经损伤一年以上无修复价值”观念的影响[1-3],致陈旧性周围神经缺损是否有修复价值一直存在争论,另一方面,由于神经再生速度缓慢,再生神经到达靶器官前,肌肉已经发生不可逆性萎缩,特别是对于效应器距离损伤部位较远的外周神经高位损伤,即便神经再生能够实现,但再生的神经末梢与萎缩的肌纤维之间也很难重新建立有效的神经-肌接头,从而使神经再生的效果大打折扣。 这些客观现实都在一定程度上形成了临床工作者在面对陈旧性周围神经缺损治疗时的消极心理,甚至放弃积极修复转而行肌腱转位或肌腱固定等功能重建手术。
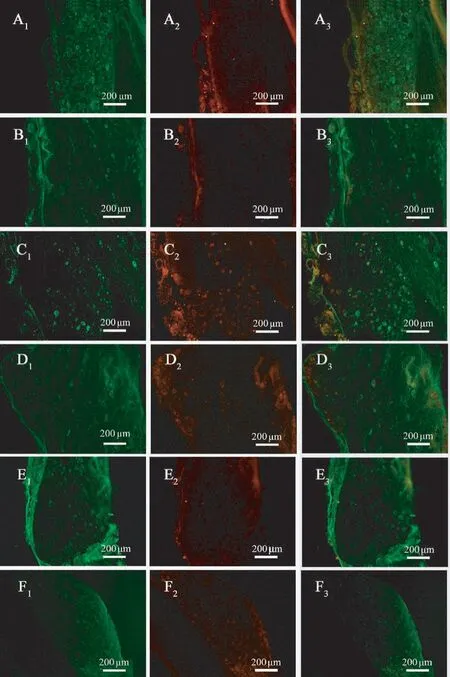
图2 神经缺损8 周修复术后不同时间段背根节横切面抗GAP43 和BDNF 双重免疫荧光组织化学染色Note. A/B, Experimental group. C/D, Control group.Figure 2 Light micrographs following double staining for GAP43 and BDNF on the transversely sectioned DRGs after repair of the 8-week-delayed defective nerve
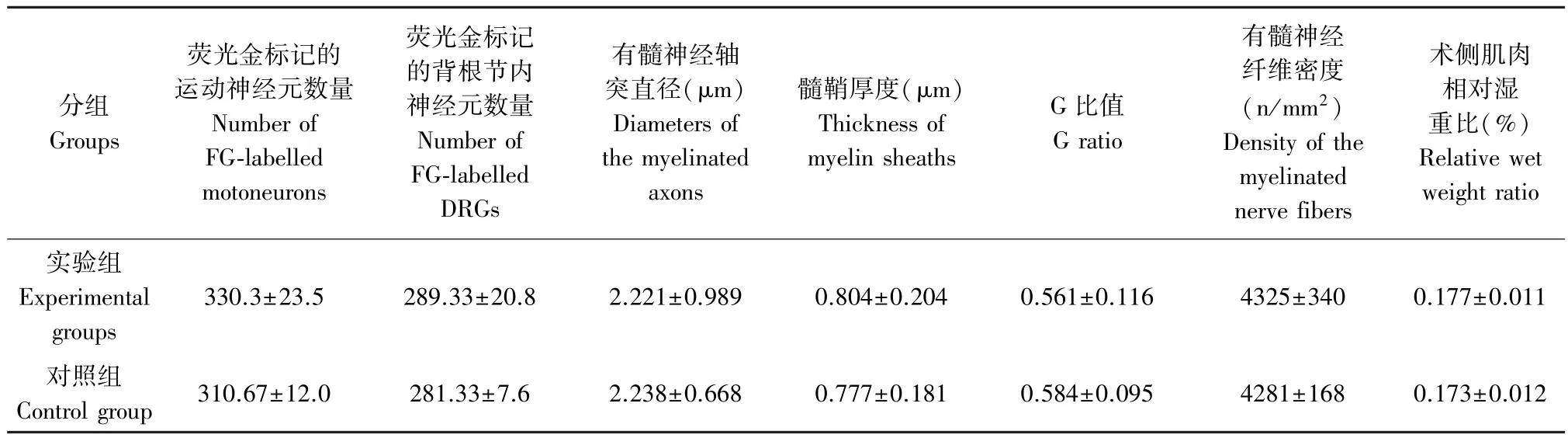
表1 逆行示踪、再生神经形态学、腓肠肌相对湿重定量比较(¯x±s, n=3)Table 1 Quantitative comparison of the retrograde labeling,morphology of regenerative nerve and the relative wet weight of gastrocnemius muscle
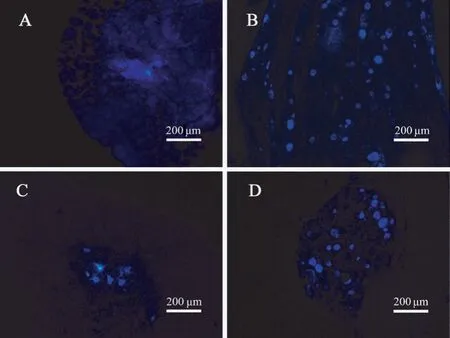
图3 FG 逆行示踪脊髓(A、C)和背根节(B、D)观察Note. A/B, Experimental group. C/D, Control group.Figure 3 Light micrographs following FluoroGold retrograde tracing of spinal cord (A, C) and DRGs (B, D)
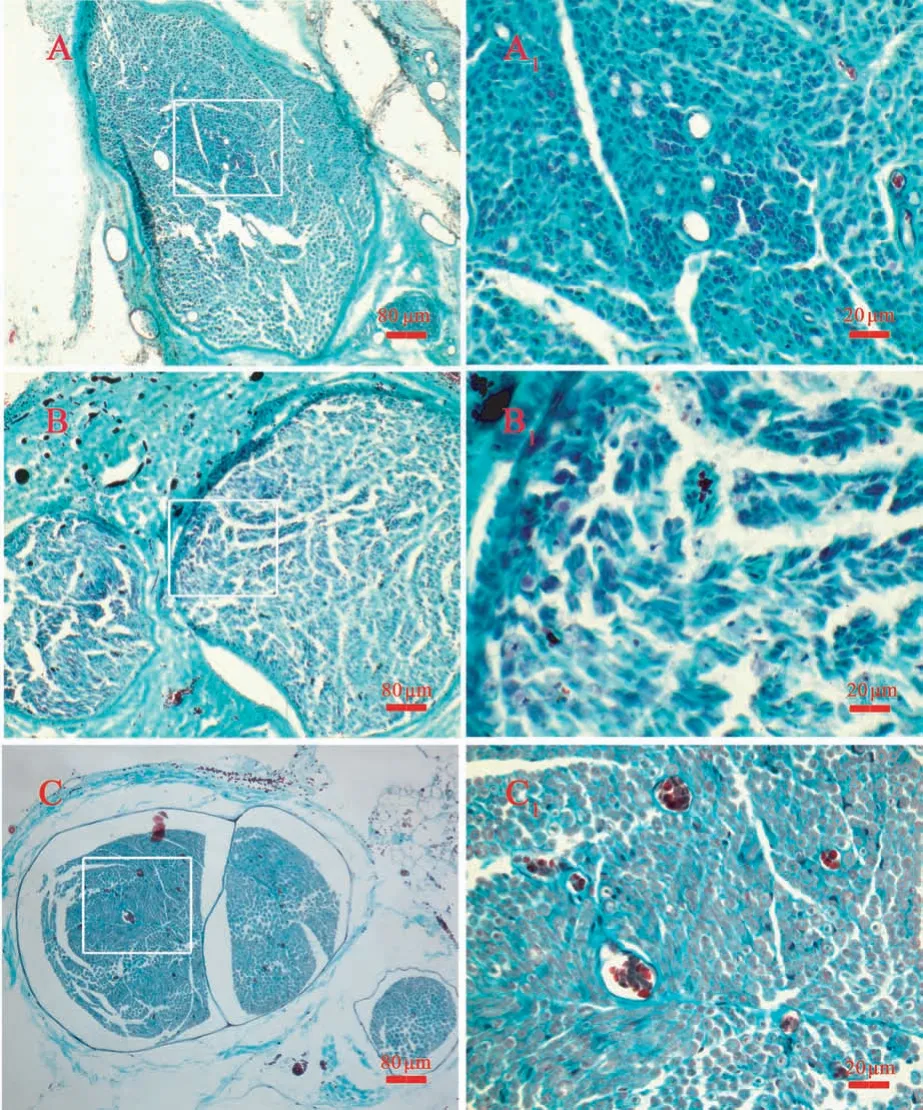
图4 桥接物中段横切面神经三色染色Note. A, Experimental group. B, Control group. C, Normal nerve.A1-C1, Higher magnifications of the boxed areas in A-C.Figure 4 Light micrographs following Meyer’s modified trichrome staining on transversely sectioned mid-portion of the regenerated segment at the operated side
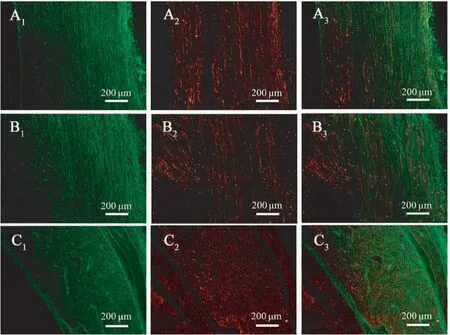
图5 桥接物中段横切面抗NF 与S-100 双重免疫荧光组织化学染色Note. A1-A3,Experimental group. B1-B3, Control group. C1-C3,Normal nerve. A1-C1, Staining for NF. A2-C2, S-100. A3-C3,merged.Figure 5 Light micrographs following double staining for NF and S-100 on the transversely sectioned mid-portion of the regenerated segment

图6 术侧坐骨神经远端电镜观察Note. A, Experimental group. B, Control group. A1, Higher magnifications of the boxed areas in A.Figure 6 Transmission electron micrographs of distal sciatic nerve portion at the operated side
对周围神经损伤再生过程而言,其难度主要包括:近端神经元再生率低;轴突再生速度慢,再生距离长;远端再生微环境逐渐退变,难以维持“漫长”的再生时间等[12],对陈旧性神经损伤,远端靶器官所经历的长时间等待就更长了。 因此,能促使上述神经再生过程有些许缩短的因素都将对提高陈旧性神经损伤的再生效果提供帮助。
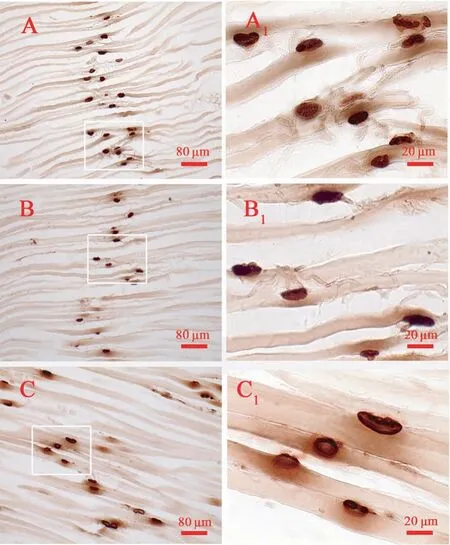
图7 术侧腓肠肌Karnovsky-Root 运动终板胆碱酯酶组化染色光镜观察Note. A, Experimental group. B, Control group. C, Normal nerve.A1-C1, Higher magnifications of the boxed areas in A-C.Figure 7 Light micrographs following Karnovsky-Root cholinesterase staining of the motor endplate on transverse sections of gastrocnemius muscle at the operated side
外周神经损伤后,远侧端的再生微环境对再生轴突的支持作用固然重要,但由于来自远侧端施万细胞所提供的GDNF、BDNF 等营养因子表达较慢且难以在早期对轴突再生提供有效支持,对陈旧性神经损伤来说,这种支持显然大为降低,因此来自近端神经元的神经营养因子显得尤为关键,其表达水平与时效性在促进神经再生中发挥着重要作用。
文献报道显示低频电刺激可能是通过激活神经元胞体上的电压依从性钙通道(这种短期电刺激对神经再生的作用可被钠通道阻滞剂TTX 阻断构成了这一推断的间接证据),进而激活胞内腺苷酸环化酶/cAMP-依赖性蛋白激酶系统[13-14],促使胞体内cAMP 水平上升,激活下游的PKA、CREB,进而启动 BDNF、trkB、Tα1-tubulin 及 GAP-43 等系列内源性因子的表达,促进神经轴突早期再生,并帮助再生的轴突通过损伤点进入远端,缩短整体再生时间[7,15-19]。 上述通过影响近端神经元发挥促神经再生作用的可能机制也被认为是电刺激促神经再生的主要途径。 本实验观察了桥接修复早期动物相应神经元内源性神经因子的表达,观察到SELS对神经元内源性因子表达的促进作用,与前述文献报道基本一致。
相关研究发现神经干切断后1 个月时,近端脊髓前角中神经元数量丢失最多,减至对照侧60%,神经元胞体则经历先肿胀后缩小的变化,至2 ~3 个月左右,神经元胞体形态趋于稳定,以后形态、数量变化不大,直到12 个月[20-21]。 损伤侧近端脊髓中神经元的这些形态、数量的变化较大程度上影响了陈旧性神经缺损模型近端神经元对SLES 的响应速度和相关因子的上调水平,从而影响了SLES 对陈旧性损伤的周围神经再生的促进作用。
Han 等[22]、Xu 等[23]的研究认为电刺激能对延迟修复的陈旧性神经损伤发挥促神经再生作用,但延迟期超过1 个月的神经损伤,电刺激发挥的促神经再生作用则较为有限。 Huang 等[24]最近的研究指出,电刺激可以促进陈旧性神经缺损的神经再生,最长延迟期可达24 周。 这可能与实验中使用的神经缺损模型不同有关。 本研究所制备的陈旧性周围神经缺损模型为无自发再生可能的长距离神经缺损(对大鼠而言,>12 mm 被认为是长距离神经缺损[25-26]),缺损距离长达13 mm, 比Huang 等[24]研究中的 5 mm 神经缺损模型距离长。 Elzinga等[27]使用交叉缝合模型来研究电刺激对陈旧性神经损伤的作用,发现电刺激对延迟达3 个月的陈旧性神经损伤仍然有促进作用。 交叉缝合模型采用的是无缺损的直接端对端吻合,与本研究所用的长距离神经缺损模型相比,神经损伤程度、神经修复和再生的难度皆有较大区别。 但 Huang 等[24]、Elzinga 等[27]的研究是有价值的,显示了电刺激对陈旧性神经损伤修复的积极作用。
综上所述,在本研究中,我们虽然在实验组中观察到SLES 对神经元相关神经因子表达的一定促进作用,但在神经纤维发育、靶器官再支配和肌肉宏观相对湿重比等方面,实验组动物均未表现出明显优势。 这些结果表明,SLES 对延迟至8 周修复的陈旧性坐骨神经损伤的积极作用难以抵消延迟时间延长导致残存神经元再生率下降、远端再生微环境支持能力减弱、靶肌萎缩等不利因素。 因此,对于陈旧性周围神经损伤,有必要进一步优化电刺激的方式,比如术中直接刺激与术后的体外刺激相结合,刺激近端神经元与激活远端再生微环境、保护靶器官相结合,多措并举,使电刺激更好的发挥对陈旧性周围神经再生的促进作用。

