α-倒捻子素对免疫抑制小鼠免疫功能的影响
秦艳萍,李晓龙,李慧茹,陆春果,杨 粤,张钧雄
(广西医科大学,南宁 530021)
免疫功能作为人体自身的防御机制,对维持免疫系统正常发挥保护作用具有重要意义,一旦某种原因使其不能正常工作,机体极易感染细菌、真菌、病毒等,最直接的表现就是容易生病。 因此,通过提高机体免疫功能进而改善生命质量,是一个值得探讨研究的问题,尤其在疫情突发的非常时期,探索对抵御有害刺激具有较好预防作用,提高人体免疫功能的药物更具意义。 目前已有的研究报道显示,自然界丰富的天然药物宝库以及我国丰富的中药宝典中,有不少的天然药物,具有对人体适应性及免疫双向调节的功能,即通过服用此药物使机体处于非特异性防御能力提高状态,促进抗体形成,以提高解毒能力;同时诱生干扰素以对抗病毒;此外,对于亚健康人群,此类药物在恢复健康方面亦有很好的调整作用[1]。 本文研究的是α- 倒捻子素(α-mangostin),一种氧杂蒽酮化合物,存在于藤黄科藤黄属植物山竹(garcinia mangostanal)果壳中(约80%)[2-4]。 已有的研究表明,α-倒捻子素具有多种显著的生物学效应及药理活性,如抗氧化、抗炎、抗过敏、抗菌及抗病毒、抗肿瘤、镇痛等,在一些东南亚地区被用作治疗腹痛、腹泻、痢疾等疾病的传统药物,但在我国这种 药物的使用并不普及[5-7]。 此外,α-倒捻子素能够通过影响细胞增殖、阻滞细胞周期、诱导细胞凋亡等作用途径,抑制肿瘤的生长和转移,对结肠癌、前列腺癌、乳腺癌、胃癌等均表现出抗肿瘤活性[8-10]。 然而,基于目前研究发现,有关α-倒捻子素对机体免疫功能的影响未见详细报道,鉴于山竹果壳在其他方面具有多种药用价值,但其对机体免疫功能是否具有影响尚未可知,因此值得探讨研究。 本研究以免疫抑制小鼠为研究对象,旨在探讨α-倒捻子素对免疫抑制小鼠免疫功能的调节作用,为α-倒捻子素后续的研究及开发增强免疫功能新药提供重要实验依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
50 只 6~8 周龄雌性 SPF 级 KM 小鼠购自广西医科大学动物实验中心[SCXK(桂)2020-0003],体重(20±2)g。 饲养于广西医科大学实验动物中心[SYXK(桂)2020-0004],经由广西医科大学实验动物福利与伦理委员会审批通过(201907018),实验研究过程中遵循3R 原则,置于清洁的动物房内饲养,给予充足的颗粒饲料和水,循环灯光(明/暗12 h)代替自然光照,室温控制在22℃左右,湿度60%~80% 。 2 d 观察适应后进行分组 。
1.1.2 实验细胞
人肝癌细胞SK-HEP-1(中国科学院上海生命科学研究所)。
1.2 主要试剂与仪器
α-倒捻子素(购自成都普瑞法科技开发有限公司,Cas 号:6147-11-1);注射用环磷酰胺(CTX)(江苏恒瑞医药股份有限公司,H32020857);补体(正常豚鼠血清) (上海源叶科技有限公司,S27068);含10%胎牛血清的1640 培养液(上海善然生物科技有限公司,11011-8611);刀豆蛋白A(ConA)(北京索莱宝科技有限公司,C8110);MTT试剂(北京索莱宝科技有限公司,C8110);二甲基亚砜(DMSO)(北京索莱宝科技有限公司,D8371)等。
电子天平(北京赛多利斯仪器系统有限公司);酶标仪(美国Thermo 公司);超净工作台(上海博迅视野有限公司医疗设备厂);CO2细胞培养箱(美国Thermo 公司);离心机(湖南湘仪实验室仪器开发有限公司)等。
1.3 实验方法
1.3.1 动物分组和给药方式
将全部小鼠随机分为空白对照组、免疫抑制组、低剂量组、中剂量组和高剂量组,每组10 只。 动物分组后,实验分2 步进行:
实验总共21 d,每天定时对小鼠进行灌胃,灌胃的剂量通过总结已有的研究,对不同剂量的效果进行对比来设置。 前7 d,空白对照组小鼠每天灌胃0.3 mL 生理盐水,其他四个组小鼠建模,每天均灌胃0.3 mL 环磷酰胺溶液(CTX)[剂量30 mg/(kg·d)]。 后14 d,空白对照组小鼠继续灌胃同等剂量的生理盐水,免疫抑制组小鼠灌胃0.3 mL/d 玉米油,低剂量组小鼠灌胃0.3 mL α-倒捻子素溶液[剂量10 mg/(kg·d)],中剂量组小鼠灌胃 0.3 mL α-倒捻子素溶液[剂量 30 mg/(kg·d)],高剂量组小鼠改灌胃0.3 mL α-倒捻子素溶液[剂量100 mg/(kg·d)]。 实验期间定期更换垫料,所有小鼠进行自由采食和饮水,每天仔细检查小鼠活动状况,包括采食、饮水、反应等),进行体重称量并记录。 末次给药24 h 后,分别进行迟发型变态反应(DTH)检测:足趾增厚法,巨噬细胞吞噬功能的测定:碳廓清实验,免疫器官(脾、胸腺)指数测定,血清溶血素测定,自然杀伤细胞(NK 细胞)活性测定,外周血白细胞计数的测定和脾淋巴细胞增殖实验。
1.3.2 迟发型变态反应(DTH)检测:足趾增厚法
实验进行至第17 天时,采用腹腔注射5%(v/v)鸡血红细胞(每个小鼠0.2 mL)进行致敏。 4 d后,选取同一左后足趾部位,连续测量其厚度3 次,取平均值,作为攻击前足趾厚度;第21 天时,在测量部位皮下注射20%(v/v)鸡血红细胞(每个小鼠20 μL),于注射后24 h 测量左后足趾部厚度3 次,取平均值,作为攻击后足趾厚度。 DTH 程度用足趾肿胀程度即攻击前后足趾厚度差值来表示。
1.3.3 巨噬细胞吞噬功能的测定:碳廓清实验
小鼠置于固定器中,尾静脉注射50%的印度墨汁(0.1 mL/10 g),注射后立即计时,并于第3 min(A3)、11 min(A11),分别用毛细玻璃管从内眦静脉丛取血20 μL,加入2 mL 0.1% Na2CO3溶液中,混匀。 以0.1% Na2CO3溶液作为空白对照,3 复孔,每孔100 μL,运用酶标仪在600 nm 波长处测定A3和A11的密度值OD。 按下列公式计算碳廓清指数K 和吞噬指数a。
K=(logA3-logA11)/(t11-t3)
a=体重/(肝质量+脾质量)×3K
1.3.4 免疫器官指数测定
采血完成后,处死小鼠,用无菌处理过的剪刀和镊子取出肝、胸腺和脾,除去多余的结缔组织和脂肪,称重计算胸腺(A)指数和(B)指数:
A=小鼠胸腺质量/小鼠体重;B=小鼠脾质量/小鼠体重
1.3.5 血清溶血素测定(HC50)
实验进行至第17 天,连续5 d 采用腹腔注射法注射0.2 mL 的5%鸡血红细胞,进行预免疫,末次给药24 h 后取血,血液离心(3000 r/min,10 min),取上层血清,加入生理盐水稀释100 倍,取稀释后的血清与5%鸡血红细胞悬液、10%的补体、生理盐水各0.5 mL,混匀,放入37℃水浴锅中静置30 min后,立刻转入冰水浴中终止反应,再次离心(2500 r/min,10 min)后取上清液,每孔100 μL,3 复孔,运用酶标仪于540 nm 波长处测定光密度值(A)。 用半数溶血值(HC50)来表示血清溶血素含量:
HC50=样品光密度值A×稀释倍数(100 倍)/鸡血红细胞半数溶血时的A 值
测定鸡血红细胞半数溶血时的A 值,取稀释后的血清与10%补体各0.5 mL,再加入5%鸡血红细胞悬液0.25 mL 和生理盐水0.75 mL。
1.3.6 外周血白细胞计数的测定
小鼠眼球取血后,取 20 μL 全血,加入 380 μL 2%的乙酸,混匀,取12 μL 混合液用细胞计数板测定外周血白细胞。
1.3.7 脾淋巴细胞增殖实验:MTT 法
无菌条件下取脾,剪碎研磨,过200 目细胞筛,用无菌PBS 洗涤细胞,放入离心机(1500 r/min,5 min)离心,细胞沉淀加入2 mL 灭菌双蒸水,吹打混匀,立即加入等体积1.8%的无菌盐水充分混匀,再用无菌的PBS 洗涤细胞,最后用含10%胎牛血清的RPMI1640 培养液悬浮细胞,调整细胞个数为5×105/mL,加入96 孔板中,设空白对照组(只加细胞悬液)和 ConA 组(加终质量浓度为5μg/mL ConA和细胞悬液),每组设3 个复孔,每孔80 μL,置5%CO2、37℃恒温培养箱中培养48 h 后加入5 mg/mL MTT 15 μL,再培养4 h 后,每孔加入二甲基亚砜(DMSO)200 μL,混匀,待结晶完全溶解后于570 nm波长处测定OD 值。 细胞增殖率=(OD 实验组-OD对照组)/OD 实验组×100%。
1.3.8 自然杀伤细胞(NK 细胞)活性测定:MTT 法
将靶细胞(人肝癌细胞SK-HEP-1)稀释至2×105/mL,制备好的脾细胞悬液和靶细胞悬液按50 ∶1的比例加入 96 孔板,3 复孔,每孔 100 μL。 设不加靶细胞的效应细胞对照孔和靶细胞对照孔,各孔用RMPI1640 培养液调零,置于5%CO2、37℃的恒温培养箱培养6 h,每孔加入5 mg/mL MTT 15 μL,继续培养4 h 后,每孔加入二甲基亚砜(DMSO)200 μL,混匀,待结晶完全溶解后于570 nm 波长处测定OD值。 NK 细胞的杀伤活性=[1-(OD 效靶细胞-OD效应细胞)/OD 靶细胞]×100%。
表1 α-倒捻子素对免疫抑制小鼠迟发型变态反应(DTH)的影响(,n=10)Table 1 Effect of α-mangostin in the delayed allergic reaction of immunosuppressed mice

表1 α-倒捻子素对免疫抑制小鼠迟发型变态反应(DTH)的影响(,n=10)Table 1 Effect of α-mangostin in the delayed allergic reaction of immunosuppressed mice
注:与空白对照组比较,*P <0.05,**P ≤0.01;与免疫抑制组比较,△P<0.05,△△P≤0.01。 下同。Note. Compared with normal control group,* P < 0.05, **P ≤ 0.01.Compared with immunosuppression,△P<0.05, △△P≤0.01. The same below.
ps α-倒捻子素剂量(mg/(kg·d))Dose of α-mangostin足趾肿胀度DTH(mm)Paw thickness index照组trol group 0 0.39±0.16制组ssion group 0 0.35±0.09组Low dose group 10 0.45±0.11中剂量组Middle dose group 30 0.40±0.10高剂量组High dose group 100 0.50±0.07*△
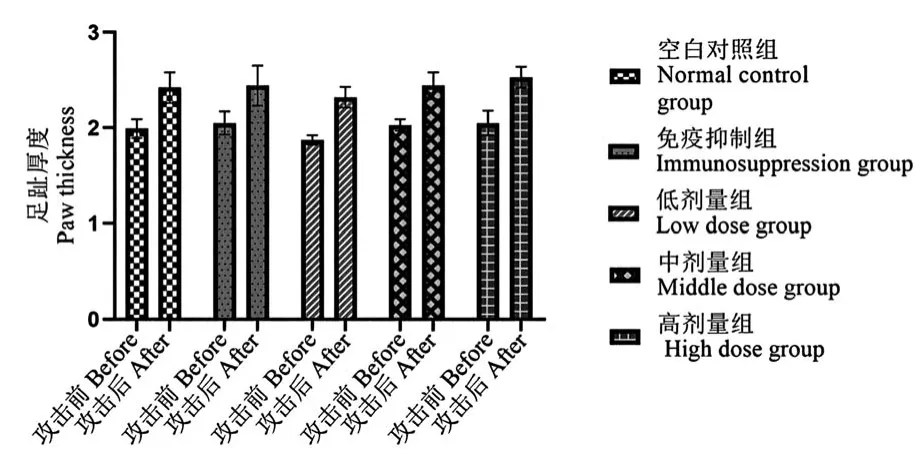
图1 攻击前、后足趾厚度(mm)Figure 1 The paw thickness index before and after the attack
1.4 统计学方法
采用SPSS 24.0 对实验数据进行方差分析处理,数据用平均数±标准差()表示,P<0.05 为差异显著,有统计学意义。
2 结果
2.1 α-倒捻子素对免疫抑制小鼠迟发型变态反应(DTH)的影响
测定结果显示(表1、图1),免疫抑制组小鼠足趾肿胀度平均数在数值上低于空白对照组,但差异不显著(P>0.05)。 实验组中的低剂量组、中剂量组与空白对照组及免疫抑制组比较均无显著差异(P>0.05)。 高剂量组小鼠足趾肿胀度平均数,其数值显著高于空白对照和免疫抑制组,与空白对照组及免疫抑制组比较,差异显著(P<0.05)。
2.2 α-倒捻子素对免疫抑制小鼠巨噬细胞吞噬功能的影响
根据测定结果显示(表2),各剂量组的碳廓清指数K 及吞噬指数a 与空白对照组及免疫抑制组比较均无显著差异(P>0.05)。
2.3 α-倒捻子素对免疫抑制小鼠胸腺及脾脏指数的影响
测定结果显示(表3),免疫抑制组小鼠胸腺指数、脾指数在数值上均显著低于空白对照组,且具有显著差异(P<0.05)。 可见环磷酰胺对小鼠脾、胸腺的生长发育产生了明显抑制作用,免疫抑制模型制备成功。 如图2、图3 所示,免疫抑制组的胸腺与脾均发生了萎缩,体积减小,而高剂量组与中剂量组的体积均比免疫抑制组的体积大。 与空白对照组比较,α-倒捻子素低剂量组、中剂量组、高剂量组小鼠胸腺指数、脾指数数值上均有所减小,并且减小程度各异。 其中胸腺指数中,中剂量组、高剂量组与空白对照组的差异显著(P<0.05),低剂量组无显著差异(P>0.05)。脾指数中,各剂量组均与空白对照组有显著差异(P<0.05)。 与免疫抑制组比较,三个剂量组小鼠的胸腺指数和脾指数在数值上均有所增大,且增大程度各异。 与免疫抑制组比较,高剂量组小鼠胸腺指数、脾指数平均数增大程度最显著,分别达到(3.38±0.94)和(4.46±0.39)mg/g,α-倒捻子素可显著提高高剂量组的胸腺指数和脾指数,差异显著(P<0.05);同时,α-倒捻子素还可显著提高中剂量组的胸腺指数(P<0.05),但脾指数则无显著差异(P>0.05);此外,α-倒捻子素对低剂量的脾指数无显著的提高作用,无显著差异(P>0.05),但对低剂量组的胸腺指数可显著提高,具有极显著的差异(P≤0.01)。
2.4 α-倒捻子素对免疫抑制小鼠血清溶血素的影响
测定结果显示(表4),免疫抑制组小鼠半数溶血值HC50低于空白对照组,具有显著差异(P<O.05),可见免疫抑制模型制备成功。 各剂量组其数值均高于空白对照组和免疫抑制组且高剂量组的数值最高。 与空白对照组比较,α-倒捻子素中剂量组具有显著差异(P<0.05),低剂量组和高剂量组具有极显著的差异(P<0.01)。 与免疫抑制组比较,中剂量组无显著差异(P>0.05),低剂量组具有显著差异(P<0.05),而高剂量组具有极显著的差异(P<0.01)。
2.5 α-倒捻子素对免疫抑制小鼠外周血白细胞计数
测定结果显示(表5),高剂量组的数值最高。与空白对照组比较,除高剂量具有极显著差异外(P<0.01),其他组均无显著差异(P>0.05)。 与免疫抑制组比较,各剂量组除高剂量具有极显著差异外(P<0.01),低剂量组及中剂量组均无显著差异(P>0.05)。

图2 α-倒捻子素对免疫抑制小鼠胸腺生长情况的影响Note. Normal control group, Saline. Immunosuppression group,0.3 mL/d of corn oil. Middle dose group,30 mg/(kg·d) of αmangostin. High dose group, 100 mg/(kg·d)of α-mangostin.The same as below.Figure 2 Effect of α-mangostin on the thymus index of immunosuppressed mice

图3 α-倒捻子素对免疫抑制小鼠脾生长情况的影响Figure 3 Effect of α-mangostin on the spleen index of immunosuppressed mice
表2 α-倒捻子素对免疫抑制小鼠巨噬细胞吞噬功能的影响(, n=10)Table 2 Effect of α-mangostin on the activity of natural killer cells of immunosuppressed mice

表2 α-倒捻子素对免疫抑制小鼠巨噬细胞吞噬功能的影响(, n=10)Table 2 Effect of α-mangostin on the activity of natural killer cells of immunosuppressed mice
组别G空白Normal c免疫Immunosup低roups α-倒捻子素剂量(mg/(kg·d))Dose of α-mangostin碳廓清指数K/10-3 The K value for clearance of carbon particles吞噬指数a The phagocytic index对照组ontrol group 0 3.20±2.06 3.91±1.50抑制组pression group 0 1.77±1.46 2.68±0.95剂量组Low dose group 10 2.47±1.29 3.77±3.04中剂量组Middle dose group 30 3.31±1.28 4.20±1.99高剂量组High dose group 100 2.29±1.97 2.72±0.69
表3 α-倒捻子素对免疫抑制小鼠胸腺及脾指数的影响(, n=10)Table 3 Effect of α-mangostin on the thymus and spleen index of immunosuppressed mice

表3 α-倒捻子素对免疫抑制小鼠胸腺及脾指数的影响(, n=10)Table 3 Effect of α-mangostin on the thymus and spleen index of immunosuppressed mice
组别Groups α-倒捻子素剂量(mg/(kg·d))Dose of α-mangostin胸腺指数(mg/g)Thymus index脾指数(mg/g)Spleen index空白对照组Normal control group 0 4.42±0.69 4.61±0.59免疫抑制组Immunosuppression group 0 2.15±0.42* 2.73±1.09*低剂量组Low dose group 10 4.23±0.46△△ 2.45±0.73*中剂量组Middle dose group 30 2.90±0.80*△ 3.17±0.77*高剂量组High dose group 100 3.38±0.94*△ 4.46±0.39*△
2.6 α-倒捻子素对免疫抑制小鼠脾淋巴细胞增殖的影响
测定结果显示(表5),与空白对照组比较,免疫抑制组小鼠脾淋巴细胞增殖率显著低于空白对照组,但无显著差异(P>0.05)。 各剂量组对应的脾淋巴细胞增殖率数值上均高于空白对照组和免疫抑制组,高剂量组的数值最高。 与空白对照组比较,低剂量组和中剂量组差异显著(P<0.05),而高剂量组的差异极显著(P≤0.01)。 与免疫抑制组比较,中剂量组可提高脾淋巴细胞增殖率(P<0.05)而低剂量组和高剂量组更明显,差异极显著(P≤0.01)。
2.7 α-倒捻子素对免疫抑制小鼠自然杀伤细胞(NK 细胞)活性的影响
测定结果显示(表5),与空白对照组比较,免疫抑制组小鼠NK 细胞活性低于空白对照组,无显著差异(P>0.05)。 各剂量组相对应的NK 细胞活性数值均高于空白对照组和免疫抑制组。 与空白对照组比较,各剂量组均有显著差异(P<0.05)。 与免疫抑制组比较,α-倒捻子素三个剂量组都能提高NK细胞活性(P<0.05),而高剂量组可明显提高NK 细胞活性,差异极显著(P<0.01)。
3 讨论
动物机体的免疫功能主要是由细胞免疫、体液免疫及非特异性免疫组成,免疫系统的稳定是保证内环境稳定的关键,同时免疫功能的正常水平与各器官功能正常发挥具有密切联系[11-12]。 在已有的研究中,不少学者是通过免疫器官指数测定、血清溶血素的测定以及碳廓清实验等来分别检测机体的细胞免疫状态、体液免疫状态及非特异性免疫状态[13]。 免疫抑制是机体非特异性免疫功能异常的一种现象,是指免疫应答的抑制作用,表现为机体免疫系统对抗原信息的刺激应答反应迟缓、滞后,甚至不产生应答,从免疫器官的发育到体内各种免疫功能的指标均大大低于正常动物[14]。 研究发现,目前建立免疫抑制模型比较常用药物有环磷酰胺、氢化可的松和地塞米松等[15]。 本实验采用灌胃免疫抑制剂环磷酰胺(CTX)来制备小鼠免疫抑制模型,通过免疫抑制组与空白对照组比较,证明了小鼠免疫器官的发育受阻以及免疫功能降低,免疫抑制模型制备成功。 在机体的免疫功能下降时,胸腺、脾会相应发生萎缩和体积减小,很多研究通过测定胸腺指数和脾指数来间接反映机体的免疫水平[16-18]。 本研究通过对环磷酰胺所致免疫抑制小鼠的胸腺、脾指数进行检测,发现三种剂量的α-倒捻子素对小鼠的胸腺指数具有不同程度的提高作用(P<0.05),但并不随着剂量的增加而进一步升高,同时与免疫抑制组比较,只有高剂量组的脾指数和胸腺指数均具有显著差异(P<0.05),表明α-倒捻子素对免疫抑制小鼠的免疫功能具有改善作用且存在其最适宜剂量。
表4 α-倒捻子素对免疫抑制小鼠血清溶血素的影响(, n=10)Table 4 Effect of α-mangostin on the hemolysin in serum(HC50) of immunosuppressed mice
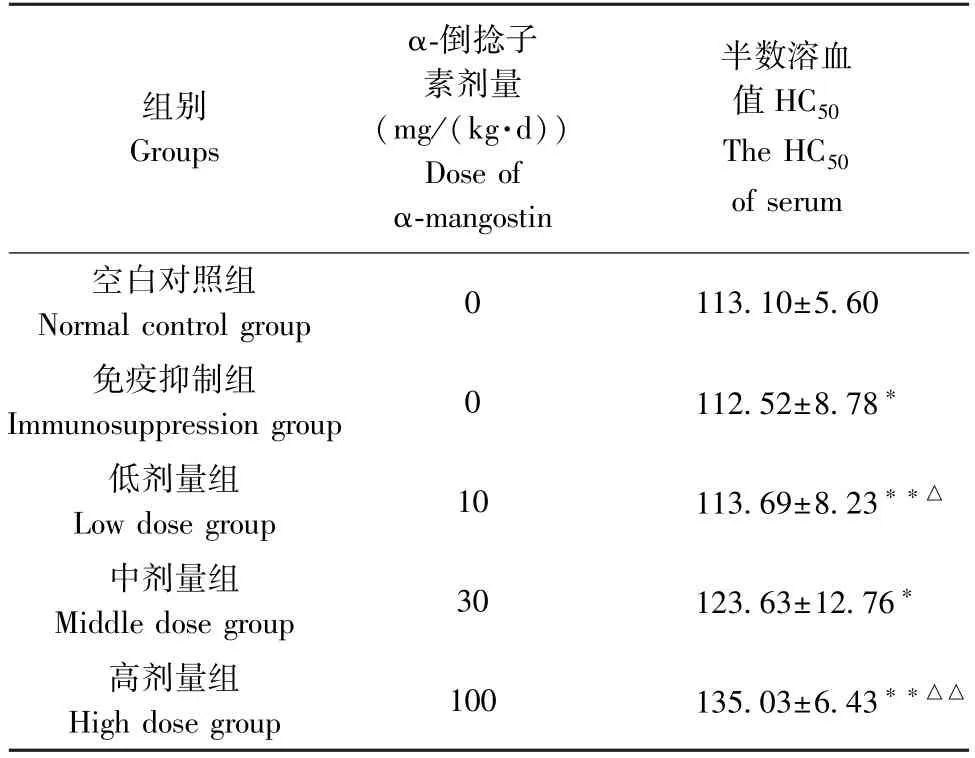
表4 α-倒捻子素对免疫抑制小鼠血清溶血素的影响(, n=10)Table 4 Effect of α-mangostin on the hemolysin in serum(HC50) of immunosuppressed mice
组别Groups α-倒捻子素剂量(mg/(kg·d))Dose of α-mangostin半数溶血值HC50 The HC50 of serum空白对照组Normal control group 0 113.10±5.60免疫抑制组Immunosuppression group 0 112.52±8.78*低剂量组Low dose group 10 113.69±8.23**△中剂量组Middle dose group 30 123.63±12.76*高剂量组High dose group 100 135.03±6.43**△△
表5 α-倒捻子素对免疫抑制小鼠外周血白细胞计数(, n=10)Table 5 Effect of α-mangostin on the peripheral blood leukocyte count, splenocytes proliferation and the activity of natural killer cells (NK cells) of immunosuppressed mice
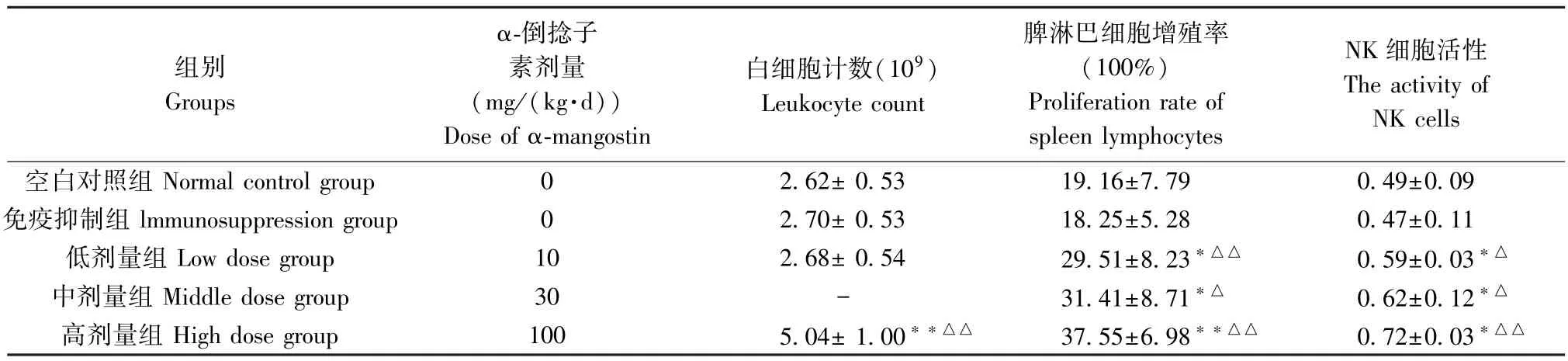
表5 α-倒捻子素对免疫抑制小鼠外周血白细胞计数(, n=10)Table 5 Effect of α-mangostin on the peripheral blood leukocyte count, splenocytes proliferation and the activity of natural killer cells (NK cells) of immunosuppressed mice
组别Groups α-倒捻子素剂量(mg/(kg·d))Dose of α-mangostin白细胞计数(109)Leukocyte count脾淋巴细胞增殖率(100%)Proliferation rate of spleen lymphocytes NK 细胞活性The activity of NK cells空白对照组 Normal control group 0 2.62± 0.53 19.16±7.79 0.49±0.09免疫抑制组 lmmunosuppression group 0 2.70± 0.53 18.25±5.28 0.47±0.11低剂量组 Low dose group 10 2.68± 0.54 29.51±8.23*△△ 0.59±0.03*△中剂量组 Middle dose group 30 - 31.41±8.71*△ 0.62±0.12*△高剂量组 High dose group 100 5.04± 1.00**△△ 37.55±6.98**△△ 0.72±0.03*△△
已有研究表明脾脏和胸腺作为重要的免疫器官,具有丰富的淋巴细胞,而淋巴细胞是体内免疫活性细胞,其增殖能力的强弱,一定程度上可以反映免疫功能的高低[19-21]。 机体发生炎症时,白细胞数目将大量增加,从而达到刺激动物免疫功能增加的作用[22]。 溶血素作为体现体液免疫的一种途径,通过改变血液的粘稠性,使其保持在适当的范围内,当其生成增多时,红细胞溶血会出现吸光度值提高的现象,表明机体的体液免疫有所增强[23-24]。巨噬细胞属免疫细胞,具有吞噬、杀伤及消化病原体的功能,并在特异性免疫应答中参与抗原的加工与呈递及免疫调节,巨噬细胞的激活可使机体抗感染能力提高,从而增强机体的非特异性免疫功能[16,19]。 本研究结果显示,与免疫抑制组比较,中剂量组可提高脾淋巴细胞增殖率(P<0.05)而低剂量组和高剂量组更明显,差异极显著(P≤0.01),表明最适宜剂量存在一定范围内。 而在血清溶血素实验中,与免疫抑制组相比,中剂量组无显著差异(P>0.05),低剂量组可提高半数溶血值(P<0.05),高剂量组可显著提高半数溶血值(P<0.01)。 NK细胞作为免疫调节细胞以及固有免疫的效应细胞,具有重要的免疫调节作用[25-26],研究结果显示,α-倒捻子素三个剂量组也都能提高NK 细胞活性(P<0.05),但只有高剂量组可明显提高NK 细胞活性,差异极显著(P<0.01)。 与此同时,在外周血白细胞计数测定及迟发型变态反应中,与免疫抑制组比较仅有高剂量组有显著差异(P<0.05)。 综合上述分析,研究结果显示高剂量组小鼠免疫功能的改善效果最为明显,表明α-倒捻子素的最适剂量更偏向于高剂量,在一定范围内具有剂量依赖性。 本研究中α-倒捻子素对小鼠机体的细胞免疫及体液免疫的提高作用由以上实验数据分析可得,但在碳廓清实验中,本研究的各剂量组均无统计学意义,对比黄伟宽、刘哲慧等学者在此类研究中的所设计的实验方法与所得实验结果[13-14,19],本实验中出现的个别实验结果异常以及各实验结果之间的差异,可能是由药品种类差异、剂量差异、实验方法不完善及实验的动物数量有限等原因造成,因此仍需要进一步研究验证。 免疫功能是多方面免疫能力共同作用的结果,α-倒捻子素对小鼠不同方面免疫能力的影响存在差异,但在整体上未影响本研究对免疫力作用结果的判断。
综上所述,我们的研究表明α-倒捻子素通过改善和提高免疫抑制小鼠免疫器官的修复能力及免疫细胞的增殖能力,对其免疫功能进行调节和提高,α-倒捻子素对免疫抑制小鼠免疫功能改善的最适宜剂量更偏向于高剂量,在一定范围内具有剂量依赖性。 而关于α-倒捻子素如何诱导免疫抑制小鼠免疫功能改善和提高的机制还需要深入研究,为α-倒捻子素的临床应用提供新的依据。

