Mn对超富集植物青葙Cd毒害的缓解效应
程艳,刘杰,2,*,蒋萍萍,2,俞果,2,蒋旭升,丁志凡,雷玲,张冰
1. 桂林理工大学,广西环境污染控制理论与技术重点实验室,桂林 541004
2. 自然资源部南方石山地区矿山地质环境修复工程技术创新中心,桂林 541004
重金属Cd与Hg、As、Cr、Pb被称为“五毒元素”,广泛存在于岩石、土壤及沉积物中[1-2]。《全国土壤污染状况调查公报》显示,Cd在所有重金属污染物中超标率最高,被认为是土壤环境中危害最大的污染物之一[3]。土壤Cd污染是影响作物的生长和农产品安全生产的重要原因[4]。当Cd在植物体内积累到一定浓度时,会对植物产生毒害作用,导致其生长受到抑制,主要表现为叶片褪绿、植株矮小、产量下降甚至死亡等症状[5-6]。Cd会使植物的膜透性增加,进而使膜系统受到损伤,植物体内的丙二醛(MDA)含量会增加,叶绿素降低[7-9]。葛依立等[10]研究发现,水蓼(PolygonumhydropiperL.)生物量和叶绿素含量随Cd处理浓度升高而显著降低。目前,寻找缓解Cd毒害的方法,降低Cd的生态风险,已成为生态环境领域的研究热点。
Mn是植物与人类正常生长发育的必需微量元素之一,也是植物维持叶绿体结构重要元素[11-12]。研究表明,Mn能够影响Cd的生理代谢活动,并缓解Cd对植物的毒性效应[13]。在水稻(OryzasativaL.)中,施加Mn可缓解Cd的毒性,降低植物对Cd的吸收和积累[14],在超富集植物美洲商陆(PhytolaccaamericanaL.)和富集植物白羽扇豆(Lupinusanbus)中,均发现Mn能有效缓解Cd的毒性[15-16]。在水培实验中,Mn显著降低了Cd在超富集植物青葙中的生物累积性[17]。施加Mn2+抑制了黑麦草(LoliumperenneL.)根系对Cd的吸收[18],大豆(Glycinemax(Linn.) Merr.)中,施加Mn2+可以抑制Cd2+从根向芽的吸收转移[19]。对玉米增加Mn供应可抑制Cd的吸收,从而缓解Cd对玉米的毒害[20]。另外,在豇豆(Vignaunguiculata(Linn.) Walp)中发现,MDA随着Cd浓度的增加而增加,说明膜结构严重受损,且叶绿素随着浓度的增加而减少,在Cd暴露下施加Mn,MDA的浓度降低,且豇豆的叶绿素显著增加,推测Mn2+和Cd2+在豇豆体内存在拮抗作用[21]。然而,也有研究表明,施加过量的Mn增加了油菜根部和地上部的Cd含量[22]。在水培条件下,Mn显著增加水稻对Cd的积累[23]。这说明,Mn缓解植物Cd毒性的机理尚不清楚,因此,研究Mn对植物Cd毒害的缓解效应和机制十分必要。
青葙是近期发现的一种可同时超富集Cd和Mn的植物[24]。前期研究发现,Mn显著影响青葙对Cd的积累和耐受性,但作用机制尚不明确[17]。本文通过水培实验研究了不同浓度的Mn对Cd胁迫下青葙的生长、Cd吸收和生理的影响,以期为阐明Mn缓解青葙Cd毒性的效应和机制奠定基础,为Cd和Mn复合污染土壤的植物修复提供理论依据。
1 材料与方法(Materials and methods)
1.1 植物培养
青葙种子采集于广西壮族自治区桂林市阳朔县。将青葙种子采用体积分数为1%的H2O2溶液浸泡消毒后,选取颗粒饱满的种子播种于育苗盘中,置于温室中培养并且保持温室温度在25~30 ℃,光照时间为14 h。在育苗托盘内培育至约5~6 cm高,4~6片真叶时挑选生长一致的幼苗分别栽进装有1/2Hoagland营养液(由购买的全营养液配制)的1 L塑料烧杯中,分2批进行培养,每5天更换营养液一次,置于温室中培养。第1批只用1/2Hoagland营养液进行培养,植物种植2周后测定青葙根部Cd2+流速。第2批进行Cd和Mn处理,Mn和Cd以MnCl2·4H2O和CdCl2·2.5H2O的形式加入营养液中混合均匀配制成水溶液,其中,含Mn浓度(Hoagland溶液中Mn的浓度)为5、100和1 000 μmol·L-1,含Cd浓度为0、5和25 μmol·L-1。每处理3个重复,植物生长3周后收获,用于测定Cd、叶绿素和MDA的含量。
1.2 叶绿素含量的测定
称取青葙新鲜叶片0.2 g,加入2~3 mL体积分数为95%的乙醇,研磨成匀浆,再加入乙醇10 mL,继续研磨,静置3~5 min,以4 000 r·min-1的转速离心10 min,上清液在紫外可见分光光度计(UV-5800PC Spectrophotometer,上海元析,中国)上于649 nm和665 nm这2个波长下测定吸光度(A),叶绿素含量按以下公式计算:叶绿素a(Ca)=13.95A665-6.88A649,叶绿素b(Cb)=24.96A649-7.32A665[25]。
1.3 MDA含量的测定
采用硫代巴比妥酸(TBA)法,称取青葙新鲜叶片0.2 g,加入1 mL体积分数为5%的三氯乙酸(TCA)研磨。匀浆在9 600 r·min-1下室温离心15 min,保留上清液。然后吸取2 mL上清液,加入2 mL体积分数为0.5%的TBA(溶解在体积分数为20%的TCA中),混合均匀后在96 ℃下(水浴)保温25 min,然后放到冰浴上迅速冷却,把冷却之后的混合液在12 000 g离心5 min,600、532和450 nm波长下测得上清液的吸光度。MDA含量采用公式C(mol·L-1) =6.45(A532-A600)-0.56A450[25]计算。
1.4 Cd含量测定
青葙收获后分为根、茎和叶三部分,用自来水先把根、茎和叶表面的灰尘洗净,随后用去离子水冲洗3次,置于烘箱中105 ℃杀青30 min,70 ℃烘干至恒重后用电子天平测其干重。烘至恒重后的叶、茎和根于植物粉碎机中粉碎,粉碎后的样品(约0.2 g)采用HNO3+HCLO4进行消解,Cd含量采用电感耦合等离子体光谱仪(PerkinElmer Optima 7000 DV,美国PerkinElmer公司)进行测定。
1.5 植物根部不同区域的Cd2+流速测定
利用非损伤微测系统(Non-invasive Micro-test Technology, NMT)完成。以非损伤性扫描离子选择电极术获取进出青葙根系的Cd2+离子浓度(mmol·L-1级)、流速及流向信息。离子选择性电极由玻璃微电极、Ag/AgCl导线、电解质及液态离子交换剂(LIX)组成。本实验所用微电极均为美国扬格公司提供。Cd2+选择性微电极前端灌充4~5 μm Cd2+离子的液态交换剂液柱,后端灌充有1 cm左右的电解液柱(10 mmol·L-1Cd(NO3)2·4H2O),将电极固定器上的Ag/AgCl丝从电极后面插入,使其与电解液接触。固体电极作为参比电极。玻璃微电极需要校正后使用,校正液中Cd2+的浓度分别设置为0.5 mmol·L-1和0.05 mmol·L-1,其他成分与测试液相同。幼苗在测量前10 min转移到装有测试液(0.1 mmol·L-1CdCl2、0.1 mmol·L-1KCl和0.3 mmol·L-12-吗啉乙磺酸(MES),pH值5.8)的测试盒中平衡。测试时,将幼苗根系置于测试液中,用滤纸条将测试部位固定,再用树脂块压好。测量区域是位于距离根尖200、800和1 600 μm的位置(图1)。将植物放入测试盒中平衡10 min之后测定Cd离子流速,数据稳定后,用移液管将不同量MnCl2·4H2O的储备液依次加入测试盒中,得到最终Mn浓度为0、10和50 μmol·L-1,记录瞬时Cd2+流速,直到分别达到10 min的稳态Cd2+流速的2点电压差。每个处理测量至少6次。

图1 在距根尖200、800和1 600 μm的位置测量青葙根系的Cd2+流速
1.6 数据处理与分析
所有数据均采用单因素方差分析和邓肯检验进行统计学分析,用SPSS20.0软件分析2种分析方法的显著性差异(P<0.05)。采用Excel软件和Origin8.0进行统计分析作图,每个处理重复3次。
2 结果与分析(Results and analysis)
2.1 Cd毒害下施用Mn对青葙生长的影响
在Mn处理为5 μmol·L-1时,施加Cd浓度为0、5和25 μmol·L-1时,青葙根、茎和叶干重随Cd浓度增加而减少。在Cd浓度为5 μmol·L-1时,施加1 000 μmol·L-1的Mn,青葙的根、茎和叶干重和总干重分别比5 μmol·L-1的Mn增加了76%、83%、55%和63%。在高Cd浓度(25 μmol·L-1)处理组,施加Mn后,青葙根、茎和叶干重和总干重都显著增加(图2)。在高Cd浓度处理下,施加Mn可以减轻毒害效用,可增加植株高度,减轻黄化现象(图3)。在5 μmol·L-1和25 μmol·L-1Cd处理组中,施加Mn(1 000 μmol·L-1)后,总叶绿素显著增加(图4)。在Cd处理为5 μmol·L-1,Mn处理为1 000 μmol·L-1时,叶绿素a、叶绿素b和总叶绿素分别比5 μmol·L-1的Mn处理增加了1.66倍、1.60倍和1.63倍,随着Cd处理浓度的升高,MDA含量呈上升趋势,在Cd处理为25 μmol·L-1时达到最大值,比对照增加了1.22倍,但是当在Cd浓度分别为5 μmol·L-1和25 μmol·L-1时,施加Mn浓度为100 μmol·L-1和1 000 μmol·L-1时,MDA含量较施加Mn浓度5 μmol·L-1时显著降低(图5)。但是施加高浓度的Mn降低效果较低浓度差,这可能因为Mn也是重金属,过量的Mn也会对植物造成影响。结果表明,在Cd毒害作用下,施加一定浓度的Mn能缓解Cd的毒性,从而促进青葙的生长。
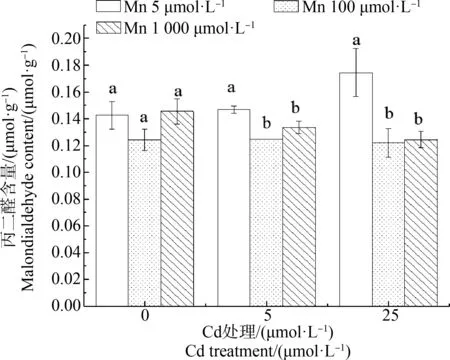
图5 Mn对不同Cd浓度胁迫下青葙叶片丙二醛(MDA)含量的影响
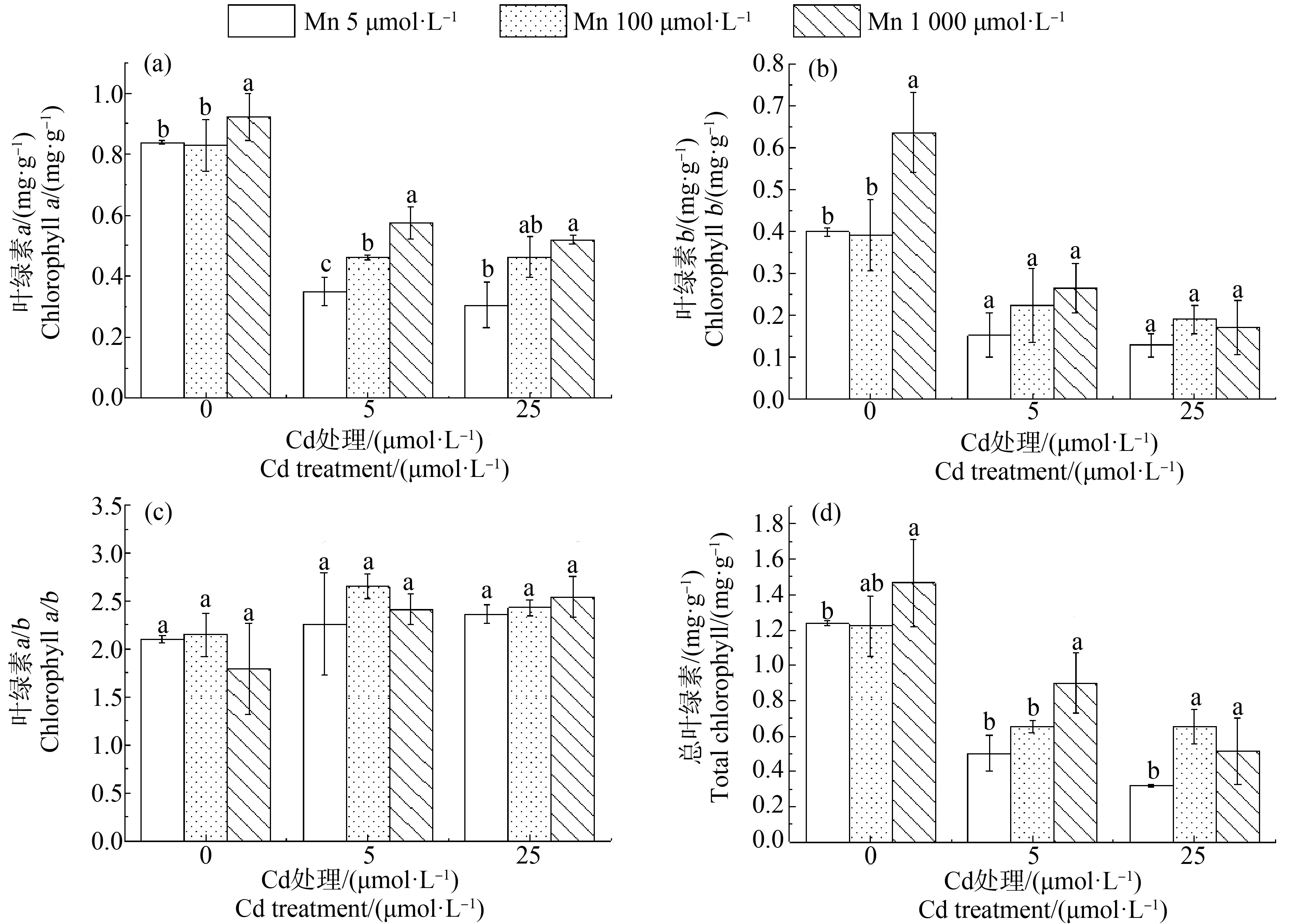
图4 Mn对不同Cd浓度胁迫下青葙叶片中叶绿素含量的影响

图3 不同Mn浓度对Cd胁迫下青葙生长的影响
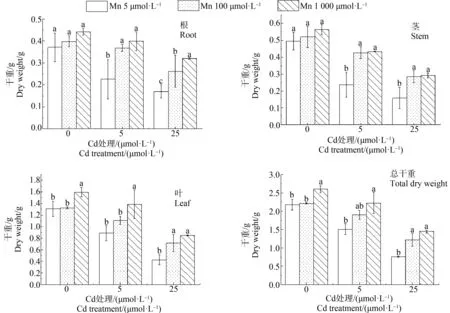
图2 Mn对不同Cd浓度胁迫下青葙根、茎、叶和总干重的影响
2.2 Mn对青葙Cd含量的影响
由图6可知,施加5 μmol·L-1的Mn时,随着Cd处理浓度的增加,青葙叶、茎和根的Cd含量也随之增加。在Cd处理为25 μmol·L-1、Mn处理为1 000μmol·L-1时,青葙茎和根的Cd含量显著降低,分别较施加5 μmol·L-1的Mn处理降低41.4%和41.5%。Cd处理浓度为5 μmol·L-1时,施加不同浓度的Mn均使根的Cd含量显著减低,在青葙叶片中,Cd处理浓度为5 μmol·L-1和25 μmol·L-1时,施加100 μmol·L-1的Mn时,叶中的Cd含量分别降低了4.4%和8.2%。且Cd处理浓度分别为5 μmol·L-1和25 μmol·L-1、施加1 000 μmol·L-1Mn时,青葙叶中Cd含量显著降低。但施加100 μmol·L-1的Mn处理组与施加5 μmol·L-1的Mn处理组相比并无显著差异。结果表明,在水培条件下,通过外源施加Mn会抑制青葙对Cd的吸收和积累,从而缓解Cd对青葙的毒害作用。
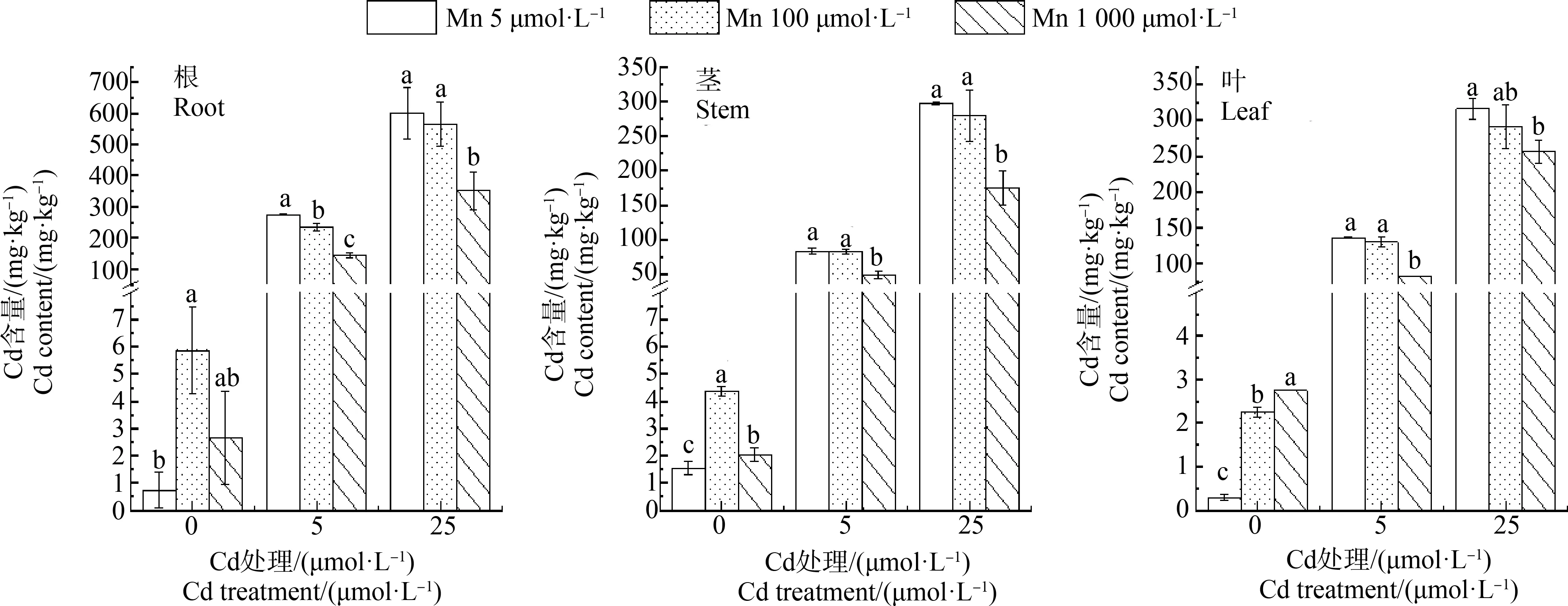
图6 Mn对不同Cd浓度胁迫下青葙根、茎和叶Cd含量的影响
2.3 Mn对青葙根部不同区域Cd2+流速的影响
根系是植物吸收营养和水分的主要器官,在Cd环境下,根系不同部位的Cd2+流速存在差异。利用非损伤微测系统(NMT),在距根尖200、800和1 600 μm处测定了青葙根系的Cd2+流速。流速为正值表示Cd2+从根部流出,为负值表示Cd2+流入根部。
结果表明,未施加Mn时在距根尖200 μm处Cd2+显示为内流,当在测试时加入不同浓度的Mn均不同程度地抑制了Cd2+的内流,然而,10 μmol·L-1Mn处理组的Cd2+进入根系的速率明显高于50 μmol·L-1Mn处理组的Cd2+流速。在加入Mn浓度为50 μmol·L-1时,Cd2+内流受到严重抑制,此时施加Mn对Cd2+流速的最大抑制率为71.4%(图7(a));平均Cd2+流速表明,施加Mn显著抑制了根表面的Cd2+流速,此外,这种抑制作用依赖于Mn供应的浓度,在Mn施加浓度为10 μmol·L-1和50 μmol·L-1时,Cd2+的平均速率分别下降14.9%和61.1%(图7(b))。
距根尖800 μm的测定结果与距根尖200 μm类似,未施加Mn时Cd2+显示为内流,但距根尖800 μm的内流较距根尖200 μm慢。在测试时随着加入Mn浓度的增加,抑制作用也增加(图7(c));当施加50 μmol·L-1的Mn时,Cd2+的最大抑制率为91.6%,平均Cd2+流速表明,Mn对Cd的抑制作用较不施加Mn增加了13倍(图7(d)),说明加入Mn可抑制Cd2+在根部的吸收速率。
距根尖1 600 μm处未施加Mn时Cd2+均呈现为内流。在测试时加Mn后Cd2+内流受到抑制,在加入10 μmol·L-1和50 μmol·L-1的Mn时最大抑制率分别为74.1%和98.7%(图7(e));平均Cd2+流速表明,施加10 μmol·L-1和50 μmol·L-1的Mn的抑制作用分别比未施加的增加了2倍和4.3倍(图7(f))。由此可见,施加不同浓度的Mn均能抑制青葙根系中Cd2+的内流。这说明Mn对Cd的毒性缓解作用与物质的量浓度比有关。
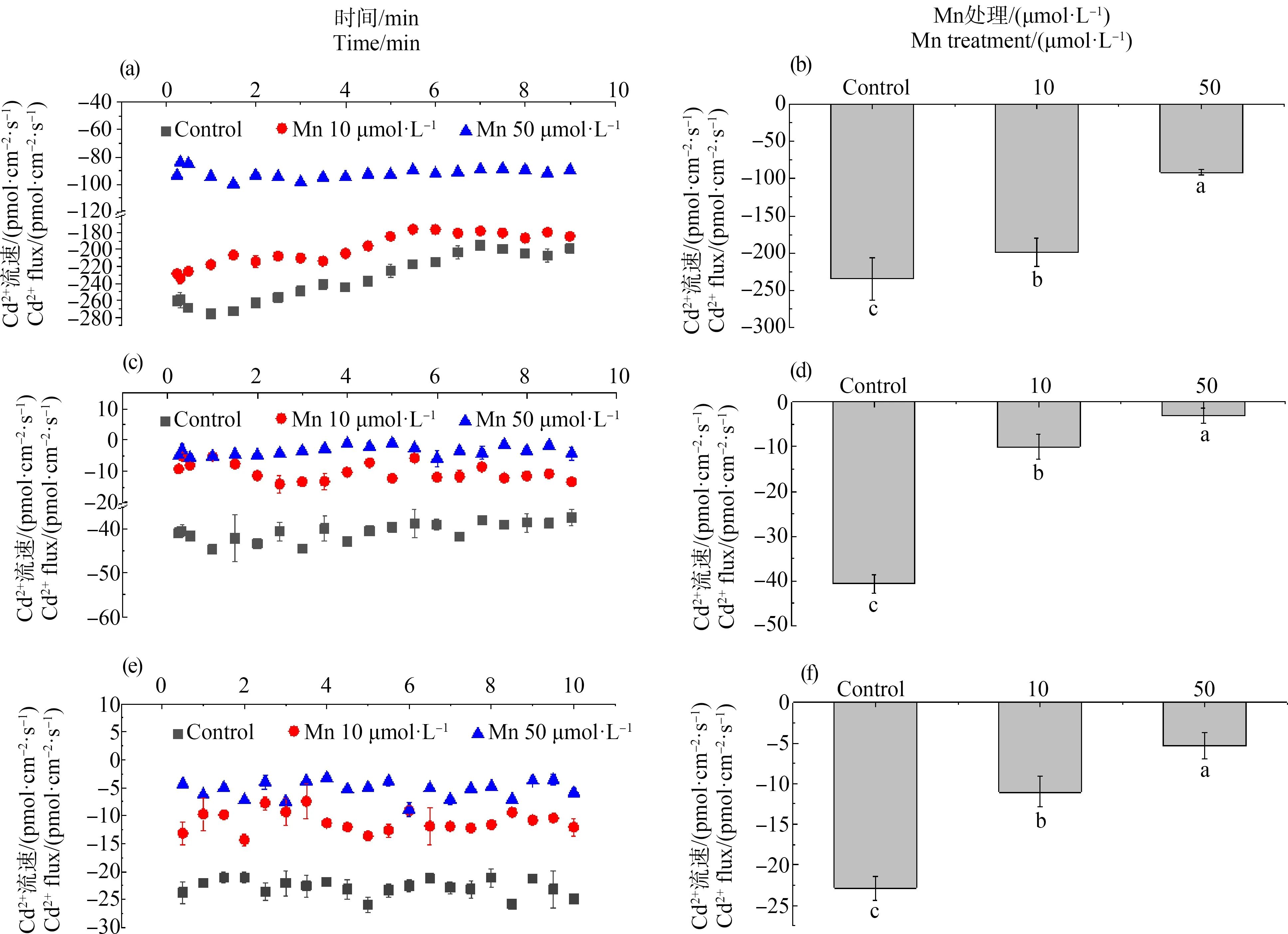
图7 Mn对青葙根部不同区域Cd2+流速的影响
3 讨论(Discussion)
Cd对植物的毒害作用表现为生长受到抑制,生物量下降[26]。Mn是植物生长发育必需的微量元素[12, 27]。目前多数研究结果认为,Mn的添加可缓解Cd的胁迫效应。钟闱桢[28]的研究表明,Mn和Cd共同作用较Cd单独作用能增加玉米和甘蔗的叶绿素。Zornoza等[16]发现,提高Mn供应水平可显著缓解白羽扇豆(LupinusalbusL.)的Cd毒害症状。Mn对Cd毒性的缓解效应在超富集植物中也普遍存在。在Mn超富集植物商陆(PhytolaccaacinosaRoxb)和美洲商陆(PhytolaccaAmericanaL.)中均发现,植物对Mn的积累均有利于提高对Cd的耐受性[15, 27],且Mn对Cd的毒性缓解作用与二者物质的量浓度比有关[24]。这与本研究结果一致,尽管Cd处理显著抑制青葙的生长,但提高Mn供应水平却显著增加了青葙根、茎和叶的生物量(图3)。另外,随着Mn的加入,青葙受Cd毒害作用的黄化现象也有所减轻,叶绿素含量随之增加(图4)。
Mn缓解Cd对青葙的毒害作用可能与Mn减少Cd的积累有关。本研究发现,提高Mn的供应量可显著降低青葙根、茎和叶中的Cd含量(图6),从而缓解Cd对青葙的毒害作用(图6)。这一发现可能与Mn抑制根系Cd吸收有关,Cd和Mn之间的竞争可能是由于Cd共享Mn传输系统的一部分。由于Cd与Mn相似有物理和化学性质,Socha和Guerinot[29]研究发现,Cd和Mn在植物里的吸收和运输可能使用相同的途径。这说明二者之间存在竞争性抑制关系。因此,推测Mn对缓解青葙的Cd毒性具有重要作用。在本实验中,在Cd浓度为25 μmol·L-1、Mn浓度为1 000 μmol·L-1时,青葙茎和根的Cd含量显著降低,分别较施加5 μmol·L-1的Mn处理组降低41.4%和41.5%。这与前人的研究结果一致,在Cd存在下,向溶液中添加Mn可显著促进植株生长,降低植株各器官中Cd的含量[15]。同样,Ramos等[30]报道了在Cd和Mn处理下莴苣叶绿体中有大量的Mn积累,却没有明显Cd中毒的症状,表明Mn的供应减轻了Cd对莴苣的毒害作用。且非损伤微测技术分析结果显示,向测定溶液中添加Mn抑制了Cd2+进入根系的流速(图7)。且在青葙距根尖200 μm处抑制效果最明显,当施加50 μmol·L-1的Mn时,抑制作用明显增强,这主要是由于距根尖200 μm处是分裂产生新细胞的主要地方。Wu等[31]也有类似的发现,Zn的供应显著降低了小白菜根部的Cd2+流速。离子流速结果直观反映Mn可抑制青葙对Cd的吸收,从而缓解Cd对青葙的毒害作用。另外,Mn缓解Cd毒性的原因可能是二者在竞争相同的转运蛋白,定位于质膜上的ZIP家族的转运蛋白PsIRT1和定位于液泡上的NRAMP家族的转运蛋白AtNRAMP3被证明能够同时转运Mn和Cd[29]。前人的研究结果表明,NRAMP5是水稻吸收Mn和Cd的主要转运体[32]。徐莜等[14]研究发现,在Mn和Cd共存的条件下,Mn2+通过优先结合细胞膜上的载体蛋白和通道蛋白对Cd2+产生拮抗作用,从而抑制Cd2+的跨膜运输,减少根系细胞胞液中的Cd含量和向地上部的转运量,缓解Cd2+的生理毒害作用。
在青葙Cd含量没有显著下降的情况下,Mn仍然降低了Cd的毒性。例如,在低Mn处理(100 μmol·L-1)时,青葙体内Cd含量并没有显著减少,但是植物叶绿素含量和干重均较对照有显著增加。Mn抑制青葙对Cd的积累并不能完全解释Mn对Cd毒性的缓解作用。这表明,Mn在缓解青葙Cd毒性时还存在其他的作用机制。本研究发现,在Cd处理组中同时施加不同浓度Mn处理,MDA含量均比单独施加Cd降低(图5)。这说明,Mn供应可能引导青葙体内抗氧化酶系统启动,从而减轻了体内的氧自由基浓度。因此,Mn有效激活抗氧化防御系统,这可能是另一个缓解青葙Cd毒性的积极生理作用机制[20],前人报道了Cd胁迫下,Mn供应水平的增加改善了Phytolaccaacinosa的脂质过氧化、水分吸收和光合作用[28]。Mn的供应显著增强了谷胱甘肽(GSH)、植物络合素(PCs)和非蛋白硫醇等非酶类抗氧化物的合成[33]。这些化合物在植物中Cd的络合和解毒过程中起着重要作用[34]。然而,是酶类氧化系统还是非酶类抗氧化系统在Mn缓解Cd毒性中起主导作用,尚需进一步的研究。
综上所述,施加Mn显著增加了Cd胁迫下青葙的生物量和叶绿素含量,表明提高Mn的供应水平可有效缓解Cd对青葙的毒性效应。Mn对Cd毒性的缓解作用可以归因于2个方面:(1)通过竞争相同转运体系,减少Cd的吸收和积累;(2)提高抗氧化系统的防御,减少Cd的脂质过氧化伤害。

